氟苯尼考对三种猪呼吸道病原菌标准株的体外抗菌类型研究
2017-04-26李先强赵丽刘俊峰郭雪峰江春雨刘永宏
李先强,赵丽,刘俊峰,郭雪峰,江春雨,刘永宏
(塔里木大学动物科学学院/新疆生产建设兵团塔里木畜禽科技重点实验室,新疆阿拉尔 843300)
氟苯尼考对三种猪呼吸道病原菌标准株的体外抗菌类型研究
李先强,赵丽,刘俊峰,郭雪峰,江春雨,刘永宏
(塔里木大学动物科学学院/新疆生产建设兵团塔里木畜禽科技重点实验室,新疆阿拉尔 843300)
【目的】研究氟苯尼考对常见猪呼吸道病原菌的抗菌类型。【方法】对猪链球菌、猪胸膜肺炎杆菌及多杀性巴氏杆菌标准株进行最低抑菌浓度(MIC)、最小杀菌浓度(MBC)、抗菌后效应(PAE)的测定和体外杀菌曲线的绘制。【结果】氟苯尼考对上述病原菌的MIC和MBC依次为0.25~0.5 μg/mL和2~4 μg/mL,PAE结果显示,氟苯尼考对3株病原菌均随暴露浓度的增大和时间的延长其抗菌后效应明显延长;体外杀菌曲线表明,氟苯尼考对上述三株病原菌均有很好的抗菌能力,且抗菌效应随药物浓度的增大而明显增强。【结论】氟苯尼考对常见猪呼吸道病原菌的抗菌类型为浓度依赖型。
氟苯尼考;猪呼吸道病原菌;抗菌类型;抗菌后效应;杀菌曲线;浓度依赖型
0 引 言
【研究意义】猪细菌性呼吸道疾病是造成养猪业经济损失最大的一类传染性疾病,临床发病率为10%~45%,死亡率更是高达2%~20%[1]。氟苯尼考因其抗菌谱广、抗菌活性强、肺部组织浓度高等特点而广泛的应用于临床猪呼吸道疾病的防治[2]。【前人研究进展】近年来,伴随着临床兽药的不合理使用导致耐氟苯尼考菌株的大量滋生,为辅助改善这一不良局面,提出了药动学-药效学(PK-PD)同步模型以制定科学合理的给药方案[3]。PK-PD同步模型可以结合抗菌药物的药动学和药效学特征进行综合研究,将药物不同形式的体内外过程进行整合并全面地分析药物、菌株和宿主三者间的相互关系,为抗菌药物临床使用的安全性和有效性提供了重要的理论依据[4, 5]。【本研究切入点】根据抗菌药物与细菌作用类型的不同可将药物抗菌分为浓度依赖型和时间依赖型两大类,而时间依赖型又可具体分为长PAE和短PAE[6]。不同类型所对应的PK-PD参数也不同,常用的PK-PD结合参数主要有:Cmax/MIC、AUC/MIC和T>MIC[7, 8]。根据已有研究表明抗菌药物的抗菌特点与PK-PD参数密切有关[9],且准确的PK-PD参数在PK-PD模型拟合科学合理的给药方案中占据着重要作用,这就需要准确的判断抗菌药物的抗菌类型,目前药物抗菌类型的判别主要通过体内和半体内杀菌曲线特征[4, 5, 10]。【拟解决的关键问题】对三种猪呼吸道病原菌的标准株进行最低抑菌浓度(MIC)、最小杀菌浓度(MBC)、抗菌后效应(PAE)的测定,以及体外杀菌曲线的绘制,准确判断氟苯尼考对常见猪细菌性呼吸道病原菌的抗菌类型,为PK-PD研究提供准确的PK-PD参数。
1 材料与方法
1.1 材 料
1.1.1 药品与试剂
氟苯尼考标准品购自中国兽医药品监察所,含二甲基甲酰胺的无菌去离子水配成128 μg/mL的药液置于-20℃冰箱保存备用;MH肉汤、TSA琼脂、TSB肉汤培养基和NAD均由青岛新希望生物科技有限公司生产,按说明书配置;胎牛血清(四季青)购自广州瑞特生物技术有限公司。
1.1.2 菌种
猪链球菌cvcc 3928、猪胸膜肺炎杆菌cvcc 268以及多杀性巴氏杆菌cvcc 388购自中国兽医药品检查所并由实验室保存。
1.2 方 法
1.2.1 生长曲线的绘制
分别将三种菌液培养所得的种子液100 μL接种于100 mL含有5%胎牛血清及10 μg/mL NAD的TSB培养基锥形瓶中,同时将5%胎牛血清及10 μg/mL NAD的TSB培养基设有空白对照组,置恒温培养箱(37℃,5%CO2)中培养。每隔2 h抽取1 mL的培养物,用紫外分光光度计在600 nm条件下测定其OD值。以时间为横坐标,细菌培养物的OD值为纵坐标,绘制三种菌株在TSB培养基中的生长曲线。
1.2.2 MIC、MBC、MPC和PAE的测定
参考CLSI标准(CLSI-M07A8-2010)中的微量肉汤稀释法分别测定氟苯尼考对猪链球菌、猪胸膜肺炎杆菌以及多杀性巴氏杆菌的MIC[2]。在此基础上根据CLSI标准(M26-AE)中推荐的方法进行MBC的测定。
根据耐药选择窗(MSW)理论,按照文献报道方法进行MPC的测定[4]。配制含氟苯尼考浓度为1、2、4、8、16、32、64 MIC的TSA琼脂,接种1010CFU/mL菌液100 μL于培养箱(37 ℃,5%CO2)中培养。72 h后无菌落生长的最低氟苯尼考浓度成为MPCpr,根据MPCpr依次线性递减20%氟苯尼考浓度,配制TSA琼脂并重复培养,不出现菌落生长的最低药物浓度即为MPC。
将含氟苯尼考10、20、40 MIC浓度0.2 mL与107CFU/mL菌液1.8 mL混合培养1和2 h,同时进行不含药物的空白对照。然后将培养液稀释100倍去除药物后的菌液和对照菌液各0.5 mL,加入4.5 mL无菌处理的TSB中培养,此为重建后零时。分别于0、1、2、4、6、8、12 h取细菌培养液100 μL进行细菌计数以建立不同浓度处理后各菌液恢复生长的动力学曲线。按照PAE=T-C计算不同浓度的氟苯尼考与猪链球菌、猪胸膜肺炎杆菌以及多杀性巴氏杆菌接触1和2 h后的PAE,其中T和C分别为诱导PAE 的实验组细菌数目高于重建后零时10倍和对照组细菌的数目高于重建后10倍所需要的时间。
1.2.3 体外杀菌曲线的绘制
TSB肉汤稀释的1/2、1、2、4、8、16、32 MIC浓度的氟苯尼考标准液稀1.5 mL与106CFU/mL的1.5 mL菌液混合于细菌瓶中,无菌TSB培养液中的细菌计数为初始细菌浓度。分别于0、1、2、4、6、8、12、18、24 h抽取培养液0.1 mL稀释后进行细菌计数三次取平均值。以时间点为横坐标,不同时间点活菌落数的对数值为纵坐标绘制氟苯尼考对猪链球菌、猪胸膜肺炎杆菌以及多杀性巴氏杆菌的杀菌曲线。
2 结果与分析
2.1 生长曲线
研究表明,猪链球菌、猪胸膜肺炎杆菌以及多杀性巴氏杆菌在TSB肉汤培养基中的生长曲线为,猪链球菌和猪胸膜肺炎杆菌在0~3 h为迟缓期,3~10 h处于对数期,10~24 h处于生长稳定期。多杀性巴氏杆菌在0~4 h处于迟缓期,4~12 h为迟缓期,12~24 h为生长稳定期。图1

图1 猪链球菌、猪胸膜肺炎杆菌以及多杀性巴氏杆菌生长曲线(n=3)
Fig.1 The growth curve ofStreptococcussuis,ActinobacilluspleuropneumoniaeandPasteurellamultocida (n=3)
2.2MIC、MBC、MPC和PAE
氟苯尼考对猪链球菌、猪胸膜肺炎杆菌及多杀性巴氏杆菌标准株的MIC、MBC、MPC和PAE测定结果显示,MIC≤0.5表明氟苯尼考对所选3种猪呼吸道病原菌均较敏感,MBC和MPC依次介于2~4和4~8μg/mL,氟苯尼考对猪链球菌、猪胸膜肺炎杆菌及多杀性巴氏杆菌的耐药突变窗可依次定为0.25~4、0.5~8和0.25~8μg/mL。表1
氟苯尼考对3种猪呼吸道病原菌的PAE结果相似,均表现出随暴露氟苯尼考药物浓度的增大和时间的延长其PAE均明显延长。相比较于时间的延长,暴露1和2h后PAE的长短与氟苯尼考药物浓度呈现一定的正相关,随药物浓度的增大PAE有逐渐增加的趋势。PAE试验表明氟苯尼考对猪链球菌、猪胸膜肺炎杆菌及多杀性巴氏杆菌有着明显的浓度依赖性。表1
表1 氟苯尼考对猪链球菌、猪胸膜肺炎杆菌及多杀性巴氏杆菌的体外药敏
Table 1 In vitro antimicrobial susceptibility of florfenicol againstStreptococcussuis,ActinobacilluspleuropneumoniaeandPasteurellamultocida
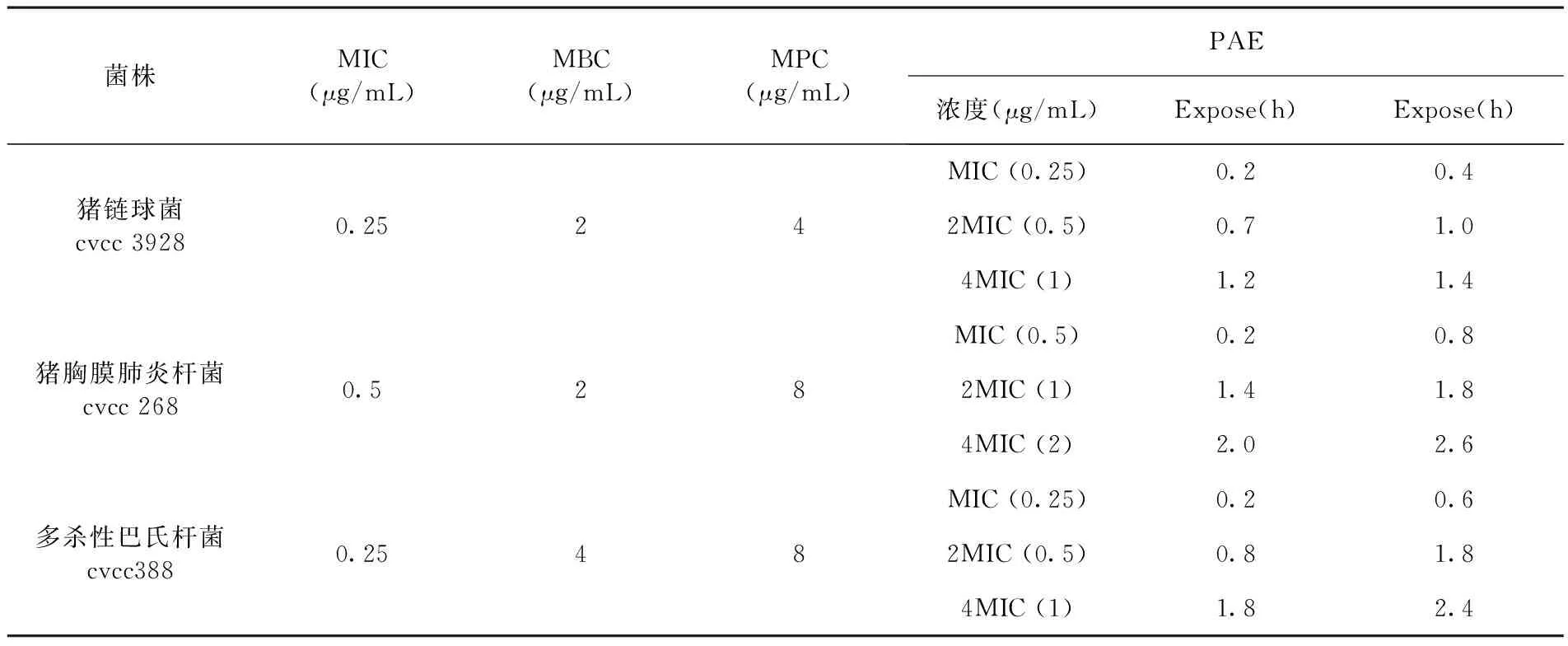
菌株MIC(μg/mL)MBC(μg/mL)MPC(μg/mL)PAE浓度(μg/mL)Expose(h)Expose(h)猪链球菌cvcc39280.2524MIC(0.25)0.20.42MIC(0.5)0.71.04MIC(1)1.21.4猪胸膜肺炎杆菌cvcc2680.528MIC(0.5)0.20.82MIC(1)1.41.84MIC(2)2.02.6多杀性巴氏杆菌cvcc3880.2548MIC(0.25)0.20.62MIC(0.5)0.81.84MIC(1)1.82.4
2.3 氟苯尼考对猪链球菌的杀菌曲线
研究表明,32MIC 2 h可将细菌全部杀灭,8MIC 4 h可将细菌全部杀灭,4 MIC 16 h可将细菌全部杀灭,2MIC 24 h可将细菌全部杀灭;而在1/4MIC、1/2MIC、1MIC和2MIC浓度时,24 h内仍不能将细菌全部杀灭。对比0MIC可知不同浓度氟苯尼考对猪链球菌均有一定杀灭作用,且杀菌能力随着浓度的增加抗菌效果逐渐增强,表现出较为明显的浓度依赖性。图2
2.4 氟苯尼考对猪胸膜肺炎杆菌的杀菌曲线
研究表明,对比0MIC可知不同浓度氟苯尼考对猪胸膜肺炎杆菌均有一定的杀灭作用,在1/4、1/2、1、2、4、8和 32MIC浓度时,24 h内也不能将细菌全部杀灭。杀菌能力在2MIC以下时随着暴露时间的延长其抗菌能力逐渐增强,表现出明显的时间依赖性,而氟苯尼考浓度在2MIC以上时随着药物浓度的增大抗菌能力逐渐增强,这又表现出较弱的浓度依赖性特征。图3

图2 不同浓度氟苯尼考对猪链球菌cvcc 3928杀菌曲线
Fig.2 The killing-curve ofStreptococcussuiscvcc 3928 exposed to various concentration
of florfenicol
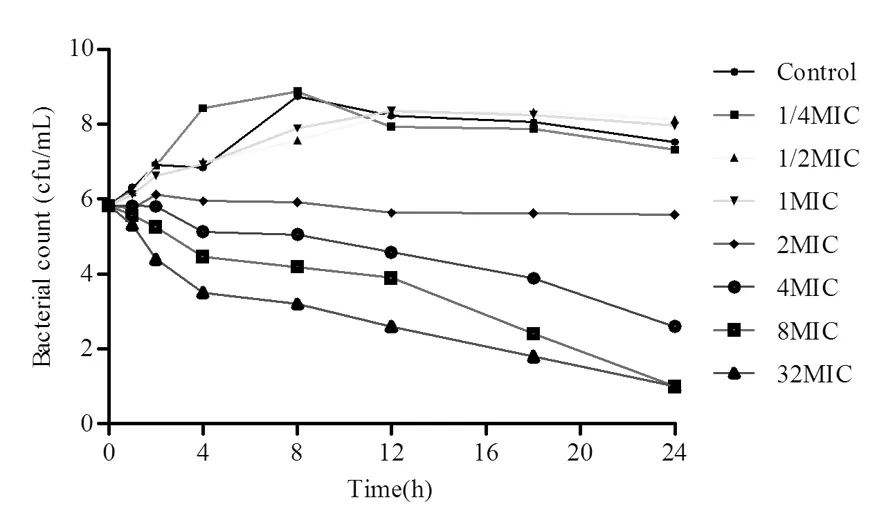
图3 不同浓度氟苯尼考对猪胸膜肺炎杆菌cvcc 268杀菌曲线
Fig.3 The killing-curve ofActinobacilluspleuropneumoniaecvcc 268 exposed to various concentration of florfenicol
2.5 氟苯尼考对多杀性巴氏杆菌的杀菌曲线
研究表明,32MIC 1 h可将细菌全部杀灭,8MIC 2 h可将细菌全部杀灭,4 MIC 8 h可将细菌全部杀灭,2MIC 24 h可将细菌全部杀灭;而在1/4、1/2、1和2MIC浓度时,24 h内也不能将细菌全部杀灭。对比0MIC可知不同浓度氟苯尼考对多杀性巴氏杆菌均有一定杀灭作用,且杀菌能力随着浓度的增加抗菌效果逐渐增强,说明氟苯尼考对多杀性巴氏杆菌的抗菌作用呈现明显的浓度依赖性。图4

图4 不同浓度氟苯尼考对多杀性巴氏杆菌cvcc388杀菌曲线
Fig.4 The killing-curve ofPasteurellamultocidacvcc388 exposed to various concentration of florfenicol
3 讨 论
氟苯尼考对试验所选取的三种常见猪呼吸道病原菌标准株的MIC≤0.5 μg/mL,表明敏感性较好。Ueda等[11]报道了氟苯尼考对90株临床分离的猪胸膜肺炎杆菌的MIC50值为0.39 μg/mL,Sung等[12]测定了氟苯尼考对临床猪源和牛源的胸膜肺炎杆菌MIC90≤1 μg/mL,Saskia等[13]分析了临床756株多杀性巴氏杆菌等常见呼吸道病原菌对氟苯尼考的MIC均≤2 μg/mL。另外,现有PK-PD模型研究表明抗菌药对病原菌的敏感折点值(Cutoff)常分布在0.25 μg/mL左右[14-16]。试验虽没有进行氟苯尼考对相关病原菌的群体药效学研究,但从MIC测定值来看研究所选取的标准菌是具有一定合理性的,可用于氟苯尼考对常见猪呼吸道病原菌标准株的抗菌类型分析。
防止病原菌被选择性富集和扩增所需的最低抗菌药物浓度可定义为防突变浓度,常用于评价抗菌药物抗菌效力和抑制耐药突变菌株生长能力[17],通常把MIC与MPC 之间的浓度范围定义为耐药突变窗(MSW)。研究表明,MPC值介于4~8 μg/mL,可初步将氟苯尼考对猪链球菌、猪胸膜肺炎杆菌及多杀性巴氏杆菌的耐药突变窗可依次定为0.25~4、0.5~8和0.25~8 μg/mL。
体内外抗菌曲线是目前判定抗菌药抗菌类型最常用的方法[4, 5, 10, 15],研究表明,氟苯尼考对猪链球菌、猪胸膜肺炎杆菌及多杀性巴氏杆菌的抗菌能力均随着药物浓度的增大而增强,显示出了氟苯尼考对常见猪呼吸道病原菌具有很强的浓度依赖性。Sidhu等[18]报道了氟苯尼考对牛源多杀性巴氏杆菌具有明显的浓度依赖,Potter等[19]也分析出氟苯尼考具有很强的浓度依赖性,均与研究结果一致。浓度依赖性药物的抗菌效果与血药浓度成正比[20],这就提示临床使用氟苯尼考时应适当提高氟苯尼考的血药浓度,而不宜延长氟苯尼考的给药时间,这就提示在临床上长期使用氟苯尼考防治畜禽呼吸道疾病效果不佳时可考虑换用其他药物或应用氟苯尼考联合用药。另外,如果氟苯尼考的临床给药间隔过小而长时间给药导致动物机体内长时间存在亚剂量的氟苯尼考浓度,便会极大的增加病原菌对氟苯尼考的耐药风险。
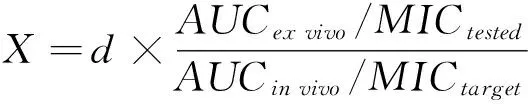
4 结 论
PAE结果显示氟苯尼考对猪链球菌、猪胸膜肺炎杆菌以及多杀性巴氏杆菌均随暴露浓度的增大和时间的延长其抗菌后效应明显延长,体外杀菌曲线表明氟苯尼考对病原菌的抗菌效应随药物浓度的增大而明显增强。初步断定氟苯尼考对常见猪呼吸道病原菌的抗菌类型为浓度依赖型。
References)
[1] Hansen, M. S., Pors, S. E., Jensen, H. E., Bille-Hansen, V., Bisgaard, M., & Flachs, E. M., et al. (2010). An investigation of the pathology and pathogens associated with porcine respiratory disease complex in denmark.JournalofComparativePathology, 143(3):120-131.
[2] Li, X., Xie, S., Pan, Y., Wei, Q., Tao, Y., & Chen, D., et al. (2016). Preparation, characterization and pharmacokinetics of doxycycline hydrochloride and florfenicol polyvinylpyrroliddone microparticle entrapped with hydroxypropyl-β-cyclodextrin inclusion complexes suspension.Colloids&SurfacesBBiointerfaces, 141:634-642.
[3] Xiao, X., Sun, J., Chen, Y., Huang, R. J., Huang, T., & Qiao, G. G., et al. (2015). In vitro, dynamic pharmacokinetic/pharmacodynamic(pk/pd) modeling and pk/pd cutoff of cefquinome against haemophilus parasuis.BMCVeterinaryResearch, 11(1): 1-7.
[4]Sang, K., Hao, H., Huang, L., Wang, X., & Yuan, Z. (2015). Pharmacokinetic-pharmacodynamic modeling of enrofloxacin against escherichia coli in broilers.FrontiersinVeterinaryScience, 2(7).
[5] Wang, J., Hao, H., Huang, L., Liu, Z., Chen, D., & Yuan, Z. (2016). Pharmacokinetic and pharmacodynamic integration and modeling of enrofloxacin in swine for escherichia coli.FrontiersinMicrobiology, 7.
[6] Zhang, B. X., Lu, X. X., Gu, X. Y., Li, X. H., Gu, M. X., & Zhang, N., et al. (2014). Pharmacokinetics and ex vivo pharmacodynamics of cefquinome in porcine serum and tissue cage fluids.VeterinaryJournal, 199(3): 399-405.
[7] Barbour, A. M., Schmidt, S., Zhuang, L., Rand, K., & Derendorf, H. (2014). Application of pharmacokinetic/pharmacodynamic modelling and simulation for the prediction of target attainment of ceftobiprole against meticillin-resistant staphylococcus aureus using minimum inhibitory concentration and time-kill curve based approaches.InternationalJournalofAntimicrobialAgents, 43(1):60-67.
[8] Mckellar, Q. A., Sanchez Bruni, S. F., & Jones, D. G. (2004). Pharmacokinetic/pharmacodynamic relationships of antimicrobial drugs used in veterinary medicine.JournalofVeterinaryPharmacologyandTherapeutics, 27(6): 503-514.
[9] Potter, T., Illambas, J., Pelligand, L., Rycroft, A., & Lees, P. (2013). Pharmacokinetic and pharmacodynamic integration and modelling of marbofloxacin in calves for mannheimia haemolytica and pasteurella multocida.VeterinaryJournal, 195(1):53-58.
[10] Ahmad, I., Hao, H., Huang, L., Sanders, P., Xu, W., & Chen, D., et al. (2015). Integration of pk/pd for dose optimization of cefquinome against staphylococcus aureus causing septicemia in cattle.FrontiersinMicrobiology, (6): 588.
[11] Ueda, Y., & Suenaga, I. (1995). In vitro antibacterial activity of florfenicol against actinobacillus pleuropneumoniae.JournalofVeterinaryMedicalScience, 57(2):363-364.
[12] Shin, S. J., Kang, S. G., Nabin, R., Kang, M. L., & Yoo, H. S. (2005). Evaluation of the antimicrobial activity of florfenicol against bacteria isolated from bovine and porcine respiratory disease.VeterinaryMicrobiology, 106(1-2): 73-77.
[13] Priebe, S., & Schwarz, S. (2003). In vitro activities of florfenicol against bovine and porcine respiratory tract pathogens.AntimicrobialAgents&Chemotherapy, 47(8):2,703-2,705.
[14] Maaland, M. G., Papich, M. G., Turnidge, J., & Guardabassi, L. (2013). Pharmacodynamics of doxycycline and tetracycline against staphylococcus pseudintermedius: proposal of canine-specific breakpoints for doxycycline.JournalofClinicalMicrobiology, 51(11):3,547-3,554.
[15] Zhang, P., Hao, H., Li, J., Ahmad, I., Cheng, G., & Chen, D., et al. (2016). The epidemiologic and pharmacodynamic cutoff values of tilmicosin against haemophilus parasuis.FrontiersinMicrobiology,(7).
[16] Papich, M. G. (2014). Pharmacokinetic-pharmacodynamic (pk-pd) modeling and the rational selection of dosage regimes for the prudent use of antimicrobial drugs ☆.VeterinaryMicrobiology, 171(4): 480-486.
[17] Zhou, J., Dong, Y., Zhao, X., Lee, S., Amin, A., & Ramaswamy, S., et al. (2000). Selection of antibiotic-resistant bacterial mutants: allelic diversity among fluoroquinolone-resistant mutations.TheJournalofInfectiousDiseases, 182(2):517-525.
[18] Sidhu P, Rassouli A, Illambas J, Potter T, Pelligand L, Rycroft A, et al (2014). Pharmacokinetic-pharmacodynamic integration and modelling of florfenicol in calves.JournalofVeterinaryPharmacologyandTherapeutics, 37(3): 231-242.
[19] Potter, T. J., Illambas, J., Sidhu, P. K., Rassouli, A., Rycroft, A., & Lees, P. (2010). Integration of pharmacokinetic and pharmacodynamic data for florfenicol in calves.JournalofVeterinaryInternalMedicine, 24(3): 716-716.
[20] Sargsyan, H., Gabrielyan, L., & Trchounian, A. (2014). Concentration-dependent effects of metronidazole, inhibiting nitrogenase, on hydrogen photoproduction and proton-translocating atpase activity of rhodobacter sphaeroides.InternationalJournalofHydrogenEnergy, 39(1): 100-106.
[21] Ahmad, I., Huang, L., Hao, H., Sanders, P., & Yuan, Z. (2016). Application of pk/pd modeling in veterinary field: dose optimization and drug resistance prediction.BiomedResearchInternational, (8):1-12.
[22] Rottbøll, L. A., Skovgaard, K., Barington, K., Jensen, H. E., & Friis, C. (2015). Intrabronchial microdialysis: effects of probe localization on tissue trauma and drug penetration into the pulmonary epithelial lining fluid.Basic&ClinicalPharmacology&Toxicology, 117(4): 19-21.
Supported by: National Natural Science Fundation "Pharmacokinetic and pharmacodynamic integration and modeling of florfenicol in swine for Streptococcus suis" (31660729); Tarim University president's Fund-Youth Innovation Fund Project "Preparation and characterizationof florfenicol inclusion complexes nanosuspension"(TDZKQN201603)
In Vitro Study on Antimicrobial Type of Florfenicol against Three Standard Porcine Respiratory Pathogens
LI Xian-qiang, ZHAO Li, LIU Jun-feng, GUO Xun-feng, JIANG Chun-yu, LIU Yong-hong
(KeyLaboratoryofTarimAnimalHusbandryScienceandTechnology,XinjaingProductionandConstructionCorps/CollegeofAnimalScience,TarimUniversity,AlarXinjiang843300,China)
【Objective】 The purpose of the present study is to investigate the antimicrobial type of florfenicol against the main primary causative bacteria of pig pneumonia. 【Method】The minimum inhibitory concentration (MIC), minimal bactericidal concentration (MBC) and post-antibiotic effect (PAE) of florfenicol againstStreptococcussuis,PasteurellamultocidaandActinobacilluspleuropneumoniaewere determined. 【Result】The MIC and MBC of florfenicol against the above pathogenic bacterias were 0.25~0.5 μg/mL and 2~4 μg/mL, respectively. The results have shown that the PAE increased with the increasing of drug concentration and extension of expose time, and time-kill curve also demonstrated that the antibacterial ability increased with the increasing of florfenicol concentration. 【Conclusion】According to the results of PAE and time-kill curve in this study, we concluded that the florfenicol is typically concentration dependent against the main primary causative bacteria.
florfenicol; pig respiratory pathogens; antimicrobial type; post antibiotic effect; time-kill curve; concentration dependent
10.6048/j.issn.1001-4330.2017.03.021
2016-11-18
国家自然科学基金“氟苯尼考对猪链球菌的药动学-药效学同步模型研究”(31660729);塔里木大学校长基金-青年创新资金项目“氟苯尼考包合物微球纳米混悬剂的制备”(TDZKQN201603)
李先强(1989-),男,安徽马鞍山人,讲师,研究方向为兽医药理学及药动学,(E-mail)lixianqiang89@sina.com
刘永宏(1981-),男,内蒙古武川人,副教授,博士,研究方向为家畜病理学和临床疾病诊治,(E-mail)lyhdky@126.com
S855.3
A
1001-4330(2017)03-0557-07
