刨根问底纠错误 推本溯源找方法
2017-04-25王志兴杨会平
王志兴 杨会平
《物质结构 元素周期律》的内容是中学化学的重要知识之一,知识抽象,内容杂乱,同学们在学习时很容易陷入各种误区。现将大家在学习过程中遇到的一些典型易错题罗列出来并进行剖析,以期帮助同学们夯实基础,掌握正确的解题方法。
一、元素周期表
1.同周期元素。
例1 某周期第ⅡA族元素的原子序數为x,则同周期的第ⅢA族元素的原子序数( )。
A.为x+1
B.可能是x+8或x+18
C.可能是x+2
D.可能是x+1或x+11或x+25
错因分析:错选A、B或C,原因是不熟悉元素周期表的结构。
正确解答:若第ⅡA族元素位于短周期,则同周期的第ⅢA族元素的原子序数是x+1;若第ⅡA族元素位于第四或第五周期,因出现了过渡元素,故同周期的第ⅢA族元素的原子序数是x+11;若第ⅡA族元素位于第六或第七周期,因出现的过渡元素中又存在镧系或锕系元素,故同周期的第ⅢA族元素的原子序数是x+25。本题选D。
思路点拨:熟悉元素周期表的结构、每个周期内的元素种类及族之间的相邻关系。
2.根据元素的原子序数推断其在元素周期表中的位置。
例2 我国的纳米基础研究能力已跻身于世界前列,科研人员曾制得一种合成纳米材料,其化学式为RN(N为氮元素)。已知该化合物中的Rn+核外有28个电子,则R元素位于元素周期表的( )。
A.第三周期第ⅤA族
B.第四周期第ⅢA族
C.第五周期第ⅢA族
D.第四周期第ⅤA族杨会平
错因分析:错选A、C或D,原因是不能正确推断元素的化合价,无法推断其原子序数,也就不能确定其在元素周期表中的位置。
正确解答:根据RN及Rn+核外有28个电子,推出N为-3价,R为+3价,则R的原子序数为28+3=31。与31最邻近的稀有气体元素的原子序数为36(第四周期),因此R位于第四周期,结合36-31=5,推知R位于第ⅢA族。本题选B。
思路点拨:牢记两种元素形成的化合物中,非金属性强的显负价。熟悉每一周期中稀有气体元素的原子序数,可帮助我们快速推断其他元素在元素周期表中的位置。
3.元素周期表中的相邻元素。
例3 X、Y、Z是元素周期表中相邻的三种元素,其中X、Y同主族,Y、Z同周期,三种元素原子的最外层电子数之和为16,质子数之和为38。则X、Y、Z分别是( )。
A.Li、Na、Al B.N、P、O
C.N、P、S D.C、Si、P
错因分析:错选A、B或D,原因是不熟悉元素原子的最外层电子数与主族序数的关系。
正确解答:由三者的质子数之和为38,推出X、Y、Z均为短周期元素。根据主族序数一最外层电子数,推出三种元素的族序数之和为16。利用数学知识验证X、Y为第ⅤA族元素(族序数之和为10),Z为第ⅥA族元素(族序数为6),有两种情况,如表1、表2。显然N、P、S满足题意,本题选C。
思路点拨:注意元素周期表中元素的相邻关系,对于主族元素,将最外层电子数之和转化为族序数之和,定位验证,确定族序数,快速进行推断。
二、元素的性质与原子结构
1.碱金属元素。
例4 下列关于锂的结构和性质的判断错误的是( )。
a.锂与水反应比钠与水反应剧烈.b.锂的原子半径比钠的小;c.锂的氧化物暴露于空气中易吸收二氧化碳;d.锂的阳离子和钠的阳离子最外层电子数相同.e.锂是还原剂。
A.a B.c和e C.b和d D.a和d
错因分析:错选A、B或C,原因是没有掌握元素原子结构的相似性和递变性。
正确解答:碱金属元素自上而下,随着原子序数的递增,原子半径逐渐增大,金属性逐渐增强。碱金属的氧化物(如Li2O、Na2O2等)都容易和二氧化碳反应。碱金属与水反应的剧烈程度自上而下逐渐增强。在化学反应中碱金属都是还原剂。Li+的最外层有2个电子,Na+的最外层有8个电子。本题选D。
思路点拨:结构决定性质,元素原子的最外层电子数决定元素的化学性质,与次外层电子数关系不大。
2.卤族元素。
例5 下列有关卤素的说法不符合递变规律的是( )。
A.F2、Cl2、Br2、I2的氧化性逐渐减弱
B.HF、HCl、HBr、HI的稳定性逐渐减弱
C.F-、Cl-、Br-、I-的还原性逐渐减弱
D.F2、Cl2、Br2、I2的颜色逐渐变深
错因分析:错选A、B或D,原因是不理解元素的氧化性、还原性、金属性、非金属性之间的关系。
正确解答:F2、Cl2、Br2、I2的氧化性逐渐减弱、颜色逐渐变深,HF、HCl、HBr、HI的稳定性逐渐减弱,F-、Cl-、Br-、I-的还原性逐渐增强。本题选C。
思路点拨:在元素周期表中,同主族元素从上到下,原子核外电子层数依次增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱,金属性逐渐增强,非金属性逐渐减弱。
三、元素、核素、同位素
例6 下列有关叙述正确的是( )。
A.所有天然元素都有多种核素
B.原子都由质子、中子、核外电子组成
C.H2、D2属于同位素
D.1H、2H、3H都是氢元素的核素,化学性质相同
错因分析:错选A、B或C,原因是不理解元素、核素、同位素等概念的范畴。
正确解答:有些元素只有一种核素,如氟、钠元素等;11H不含中子;质子数相同而中子数不同的同一元素的不同原子互称为同位素;元素的化学性质主要由原子的最外层电子数决定。本题选D。
思路点拨:掌握同位素的判断标准,互为同位素的不同原子,物理性质不同,化学性质相同。
四、原子核外电子排布
例7 甲、乙两种元素原子的L层电子数都是其他层电子总数的2倍,下列推断正确的是( )。
A.甲与乙处于同一周期
B.甲与乙处于同一主族
C.甲与乙分别是碳和铝
D.甲与乙的原子序数之和是偶数
错因分析:错选A、B或C,原因是没有掌握短周期元素原子核外电子排布的特点。
正确解答:当L层有8个电子时,镁元素符合;当L层未填满8个电子时,K层的2个电子已填入,此时L层应有4个电子,碳元素符合。本题选D。
思路点拔:因为中学阶段只要求同学们掌握前18号元素的原子核外电子排布,所以解答有关试题时,应从K层电子的结构开始,到L层电子的结构、M层电子的结构进行有序思考,可防止漏掉元素。
五、元素周期律
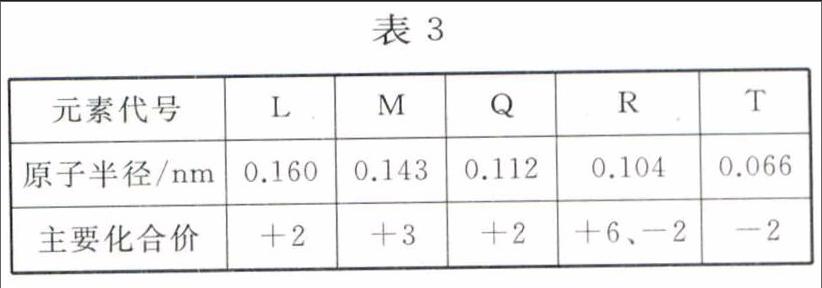
例8 根据表3信息(部分短周期元素的原子半径及主要化合价)判断,以下叙述正确的是( )。
A.H2R的沸点高于H2T的
B.L的单质与稀盐酸反应没有Q的单质与稀盐酸反应剧烈
c.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
错因分析:错选A、B或D,原因是不能有序思考,合理利用数据进行分析。
正确解答:先由R、T的化合价,推出R、T位于第ⅥA族,则有O、S两种元素,再根据R、T的原子半径大小,推出T为0,R为S。先由L、Q都是+2价,推出L、Q位于第ⅡA族,则有Be、Mg兩种元素,再根据L、Q的原子半径大小,推出L为Mg,Q为Be。先由M为+3价,推出M位于第ⅢA族,题目限定为短周期元素,则有B、Al两种元素,再观察r(M)>r(Q),根据同周期元素原子半径的递变规律,推出M为Al。常温下H2O是液体,H2S是气体,H2O的沸点高于H2S的,A项错误;Mg的金属性强于Be的,则Mg与稀盐酸反应剧烈,B项错误;Al与O形成的化合物是Al2O3,Al2O3是两性氧化物,C项正确;Mg2+核外有10个电子,S2-核外有18个电子,D项错误。本题选C。
思路点拨:抓住元素性质和元素在元素周期表中位置的关系,从原子半径的变化、元素的最高正化合价和最低负化合价入手,寻求突破口,注意氧(仅限于中学阶段)、氟元素没有正化合价。
六、元素周期表、元素周期律的应用
例9 X元素的阳离子和Y元素的阴离子与氩原子都具有相同的电子层结构,下列叙述正确的是( )。
A.X的核电荷数比Y的小
B.X和Y形成的化合物的化学式一定是XY
C.X的离子半径比Y的大
D.X的最高正化合价比Y的低
错因分析:错选A、B或C,原因是对具有相同电子层结构的微粒掌握不准。
正确解答:由题意可知X在Y的下一周期,则x是第四周期的金属元素,Y是第三周期的非金属元素。X的核电荷数大于Y的,A项错误;符合条件的阳离子可能是K+、Ca2+,阴离子可能是Cl-、S2-等,形成的化合物可能有XY、XY2、X2Y等,B项错误;具有相同电子层结构的微粒,核电荷数越多,粒子半径越小,C项错误;X的最高正化合价比Y的低,D项正确。本题选D。
思路点拔:主族的金属元素原子形成阳离子后,电子层减少一层,非金属元素原子形成阴离子后,电子层数不变。电子层结构相同的微粒,存在“阴前阳下”“序大径小”的规律。
七、化学键
1.离子键与共价键。
例10 下列说法正确的是( )。
A.只有使原子相互结合的作用力才称为化学键
B.形成离子键、共价键的微粒不相同
C.形成离子键的阴、阳离子间只存在静电引力
D.构成单质分子的微粒一定含有化学键
错因分析:错选A、C或D,原因是对概念模糊不清。
正确解答:形成离子键、共价键的微粒不相同;形成离子键的阴、阳离子间,既有静电引力,又有静电斥力;稀有气体分子中不存在化学键。本题选B。
思路点拨:由离子键、共价键等化学键的概念、形成微粒及作用力的比较,掌握相关概念。
2.离子化合物与共价化合物。
例11 下列物质中既含离子键又含共价键的是( )。
A.CaCl2 B.KoH C.CH4 D.HF
错因分析:错选A、C或D,原因是没有掌握离子化合物、共价化合物与化学键之间的关系。
正确解答:CaCl2是简单的离子化合物,只含离子键;KOH属于复杂的离子化合物,既含离子键又含共价键;CH4、HF属于共价化合物,只含共价键。本题选B。
思路点拨:只有复杂的离子化合物中,才既含离子键又含共价键。
(责任编辑 王琼霞)