肾上腺髓质素对高肺血流大鼠肺组织氧化应激的调节作用*
2017-04-24刘丽平庞璐璐齐建光金红芳杜军保
刘丽平, 庞璐璐, 齐建光△, 高 扬, 白 薇, 金红芳, 杜军保
(1北京大学第一医院儿科, 北京 100034; 2山西省儿童医院呼吸科, 山西 太原 030013)
肾上腺髓质素对高肺血流大鼠肺组织氧化应激的调节作用*
刘丽平1, 2, 庞璐璐1, 齐建光1△, 高 扬1, 白 薇1, 金红芳1, 杜军保1
(1北京大学第一医院儿科, 北京 100034;2山西省儿童医院呼吸科, 山西 太原 030013)
目的: 研究肾上腺髓质素(ADM)对高肺血流性肺动脉高压大鼠肺组织氧化应激的调节作用及其机制。方法: 健康雄性SD大鼠随机分为对照组、分流组和分流+ADM组。对后2组大鼠行腹主动脉-下腔静脉分流术。8周后,对分流+ADM组大鼠皮下埋微量渗透泵持续予ADM 1.5 μg·kg-1·h-1。继续饲养2周后,右心导管法测定平均肺动脉压(mPAP)和右心室/(左心室+室间隔)重量比值,检测肺中、小肌型动脉相对中膜厚度(RMT),比色法测定肺组织匀浆丙二醛(MDA)含量、总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)活性和谷胱甘肽过氧化物酶(GSH-Px)活性,Western blot法检测肺组织还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶4(NOX4)的表达。结果: 与对照组相比,分流组大鼠的mPAP、右心室肥厚程度以及肺中、小肌型动脉RMT均明显增加,肺组织MDA 含量明显升高,T-AOC、SOD活性和GSH-Px活性均明显降低,肺组织NOX4表达明显升高。ADM使肺动脉压力明显回降,右心室肥厚程度减轻,肺血管结构改变缓解,肺组织MDA 含量明显下降,T-AOC、SOD活性和GSH-Px活性明显升高,肺组织NOX4表达明显降低。结论: ADM能够抑制大鼠高肺血流性肺动脉高压和肺血管结构重构形成中的氧化应激反应,作用机制可能与其下调肺组织NOX4表达以及增强抗氧化活性有关。
肺动脉高压; 高肺血流; 氧化应激; 肾上腺髓质素
氧化应激是指机体内活性氧簇(reactive oxygen species,ROS)的产生过多和(或)机体抗氧化能力减弱,ROS清除不足,导致ROS在体内聚集增多并引起细胞氧化损伤的病理过程。肺组织微阵列基因表达分析结果表明在原发性和继发性肺动脉高压患者存在氧化应激状态[1-2],在低氧、野百合碱诱导、高肺血流等多种肺动脉高压动物模型中均有ROS产生增多[3-5],抗氧化治疗可抑制肺动脉高压和肺血管结构重构的形成[6],提示氧化应激参与了肺动脉高压的发生和肺血管重构的发生。肾上腺髓质素(adrenomedullin,ADM)是一种心血管保护活性多肽,参与了肺动脉高压的发生发展[7-9]。我们既往的研究显示,ADM能够缓解高肺血流性肺动脉高压和肺血管结构重构的形成[10]。既往有研究显示ADM对心血管系统氧化应激具有重要的调节作用[11-12]。然而,氧化应激是否参与了ADM对高肺血流性肺动脉高压的调节机制目前尚不清楚。本研究对大鼠行腹主动脉-下腔静脉分流术制备高肺血流性肺动脉高压的大鼠模型,通过观察长期应用ADM对高肺血流大鼠血流动力学、肺形态学和肺组织氧化应激的调节作用,探索ADM对高肺血流性肺动脉高压大鼠肺组织氧化应激的调节作用。
材 料 和 方 法
1 动物和主要材料
健康雄性SD大鼠22只,体重(160±10) g,清洁级,购自军事医学科学院(清洁级, 合格证号为SCXK-2007-004)。微量渗透泵2002型购自ALZE。ADM购自Phoenix。
2 方法
2.1 动物模型及给药方法 将22只大鼠随机分为 对照组(n=7)、分流组(n=8)及分流+ADM组(n=7)。分流组和分流+ADM 组大鼠行腹主动脉-下腔静脉分流术[13]。大鼠腹腔注射10%水合氯醛3~4 mL/kg麻醉后,取仰卧位固定于手术台上。腹部正中切口,沿腹主动脉左侧壁分开后腹膜,显露腹主动脉及下腔静脉,用小哈巴狗钳于左肾动脉起始部下方将腹主动脉夹闭。以腹主动脉的左肾动脉起始部至其末端段的下2/3处之左侧壁为穿刺点,用12号一次性针头以45°角穿透腹主动脉壁进入相邻的下腔静脉内,撤出针头,再用9-0线缝合腹主动脉壁的穿刺口。之后移开小哈巴狗钳,若观察到下腔静脉颜色由暗变红,血流有波动,证实分流手术成功。用4号丝线分别连续缝合腹膜、肌层和皮肤。对照组仅开腹暴露腹主动脉及下腔静脉,不做分流术。大鼠饲养8周后,对分流+ADM组大鼠,于背部皮下做一长约1 cm切口,埋置微量渗透泵,持续皮下给药2周,剂量为1.5 μg·kg-1·h-1。各组大鼠饲养条件相同。
2.2 血流动力学指标测定 实验10周后(第70天)以右心导管法测定肺动脉压力[14]。大鼠腹腔注射10%水合氯醛3~4 mL/kg麻醉。分离大鼠右侧颈外静脉,将聚乙烯导管一端插入右侧颈外静脉,经上腔静脉、右心房、右心室进入肺动脉,另一端经压力传感器与多导生理记录仪(成都泰盟科技有限公司)相连,描记肺动脉压力曲线,记录平均肺动脉压(mean pulmonary artery hypertension,mPAP)。游离大鼠心脏后,剪去左、右心房及脂肪血管等组织,将右心室(right ventricle,RV)和左心室(left ventricle,LV)+室间隔(interventricular septum,SP)剥离,吸干水分称重,计算RV/(LV+SP)比值,为右心室肥厚指标。
2.3 肺血管显微形态学指标的观察 大鼠开胸取相同部位肺叶固定于4%甲醛缓冲液,乙醇脱水,二甲苯透明后石蜡包埋,切片。以醛复红染色弹力纤维。肌型动脉在光镜下具有完整的内外2层弹力层。应用CMIAS 图像处理与分析系统(Leica)计算肺中、小肌型动脉的相对中膜厚度(relative medial thickness,RMT),每只大鼠测量6~10个肺中型(外径50~150 μm)和小型(15~50 μm)肌型动脉的RMT,然后求其均值作为该大鼠的RMT值。
2.4 肺组织氧化应激指标的测定 采用南京建成比色法试剂盒测定大鼠肺组织丙二醛(malondialdehyde,MDA)含量、总抗氧化能力(total antioxidative capacity,T-AOC)、超氧化物歧化酶(superoxide dismutase,SOD)活性及谷胱甘肽过氧化物酶(gluta-thione peroxidase,GSH-Px)的活性,操作严格按说明书进行。
2.5 Western blot方法测定肺组织细胞膜NOX4含量 应用碧云天细胞膜细胞浆分离提取试剂盒,提取大鼠肺组织细胞膜蛋白。以120 μg上样,进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,湿转法将蛋白质从SDS-PAGE凝胶中转移至NC膜,在含5%脱脂奶粉的TBST中封闭1 h,加入I抗(NOX4,1∶1 000稀释),4 ℃孵育过夜,TBST漂洗,加入II抗(辣根过氧化物酶标记的羊抗兔IgG,1∶10 000稀释)1 h,TBST漂洗,ECL发光反应,X线胶片曝光后观察结果,用凝胶成像系统(Alpha Innotech)对曝光后条带的灰度值进行分析,并用细胞膜Na+-K+-ATP酶作为内参照。
3 统计学处理
结果用均数±标准差(mean±SD)表示。应用SPSS 16.0统计软件进行统计学分析。多组间均数比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Bonferroni检验,以P<0.05为差异有统计学意义。
结 果
1 大鼠血流动力学指标的变化
分流组大鼠mPAP和RV/(LV+SP)较对照组均明显升高(P<0.01)。分流+ADM组大鼠mPAP和RV/(LV+SP)较分流组均明显降低(P<0.05),见表1。
2 大鼠肺血管显微形态学指标的变化
分流组大鼠中、小型肺肌型动脉RMT较对照组明显升高(P<0.01)。分流+ADM组大鼠中、小型肺肌型动脉RMT较分流组明显降低(P<0.01),见图1、表1。
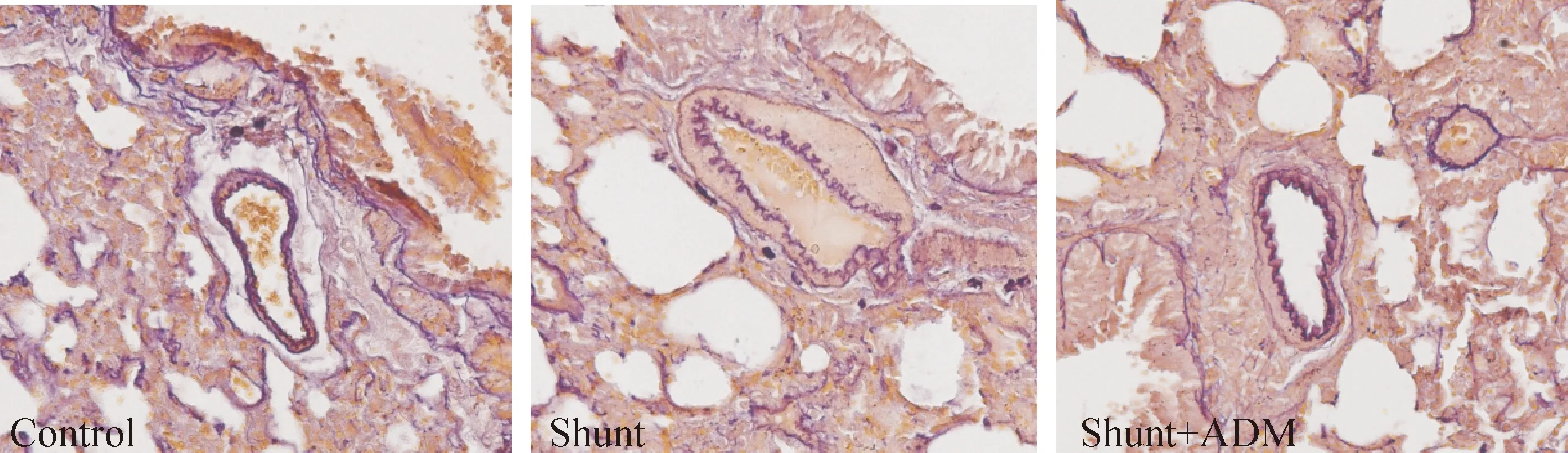
Figure 1.Microphotograph of the rat pulmonary artery (aldehyde fuchsin staining, ×200). The media of pulmonary artery was thicker in rats of shunt group than that of control group. ADM decreased the medial thickness of pulmonary artery in shunt rats.
图1 大鼠肺动脉显微结构
表1 大鼠血流动力学及肺组织形态学指标
Table 1.Haemodynamic index and pulmonary vascular micro-structure in rats (Mean±SD)

GroupnmPAP(mmHg)RV/(LV+RV) Relativemedialthickness(%)MedianPASmallPAControl714.7±2.50.22±0.035.1±1.07.6±1.4Shunt824.7±4.0**0.32±0.05**8.6±1.4**13.0±1.9**Shunt+ADM716.0±2.4##0.27±0.03#7.1±0.8#10.4±2.2#
**P<0.01vscontrol group;#P<0.05,##P<0.01vsshunt group.
3 大鼠肺组织氧化应激指标的变化
分流组大鼠肺组织MDA含量较对照组明显升高(P<0.01),分流+ADM组大鼠肺组织MDA含量较分流组明显降低(P<0.05),见表2。
分流组大鼠肺组织T-AOC、SOD活性和GSH-Px活性较对照组明显降低(P<0.05)。ADM使分流大鼠上述指标明显升高(P<0.05),见表2。
4 肺组织胞膜NOX4表达变化
分流组大鼠肺组织胞膜NOX4表达较对照组明显升高。ADM使NOX4表达明显降低,见图2。
表2 大鼠肺组织氧化应激指标
Table 2.Oxidative stress index in the rat lung tissues (Mean±SD)
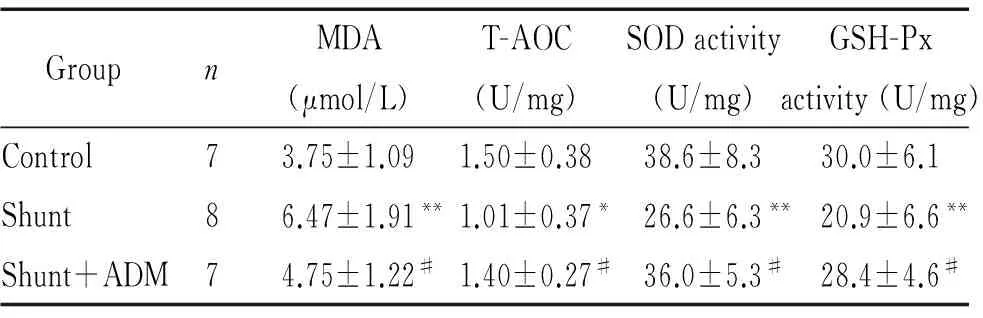
GroupnMDA(μmol/L)T-AOC(U/mg)SODactivity(U/mg)GSH-Pxactivity(U/mg)Control73.75±1.091.50±0.3838.6±8.330.0±6.1Shunt86.47±1.91**1.01±0.37*26.6±6.3**20.9±6.6**Shunt+ADM74.75±1.22#1.40±0.27#36.0±5.3#28.4±4.6#
*P<0.05,**P<0.01vscontrol group;#P<0.05vsshunt group.
讨 论
ADM是1993年发现的一种小分子血管活性肽,具有扩张血管降低血压、抑制血管平滑肌细胞迁移和增殖、排钾、利尿及对抗肾素血管紧张素系统等多种生物学作用。ADM及其受体系统在肺内广泛分布,参与了肺血管功能的调节。我们以及国内外多项研究表明,ADM及其受体的变化参与了肺动脉高压和肺血管结构重构的发生[7-9]。新近本课题组[10]通过皮下埋置微量渗透泵的方法,对腹主动脉-下腔静脉分流所致高肺血流大鼠给予外源性ADM,结果发现长期应用外源性ADM能够抑制高肺血流性肺动脉高压和肺血管结构重构。以上研究均提示ADM 及其受体系统可能参与了对高肺血流性肺动脉高压和肺血管结构重构的调节。但是ADM调节高肺血流性肺动脉高压和肺血管结构重构的机制尚未完全清楚。
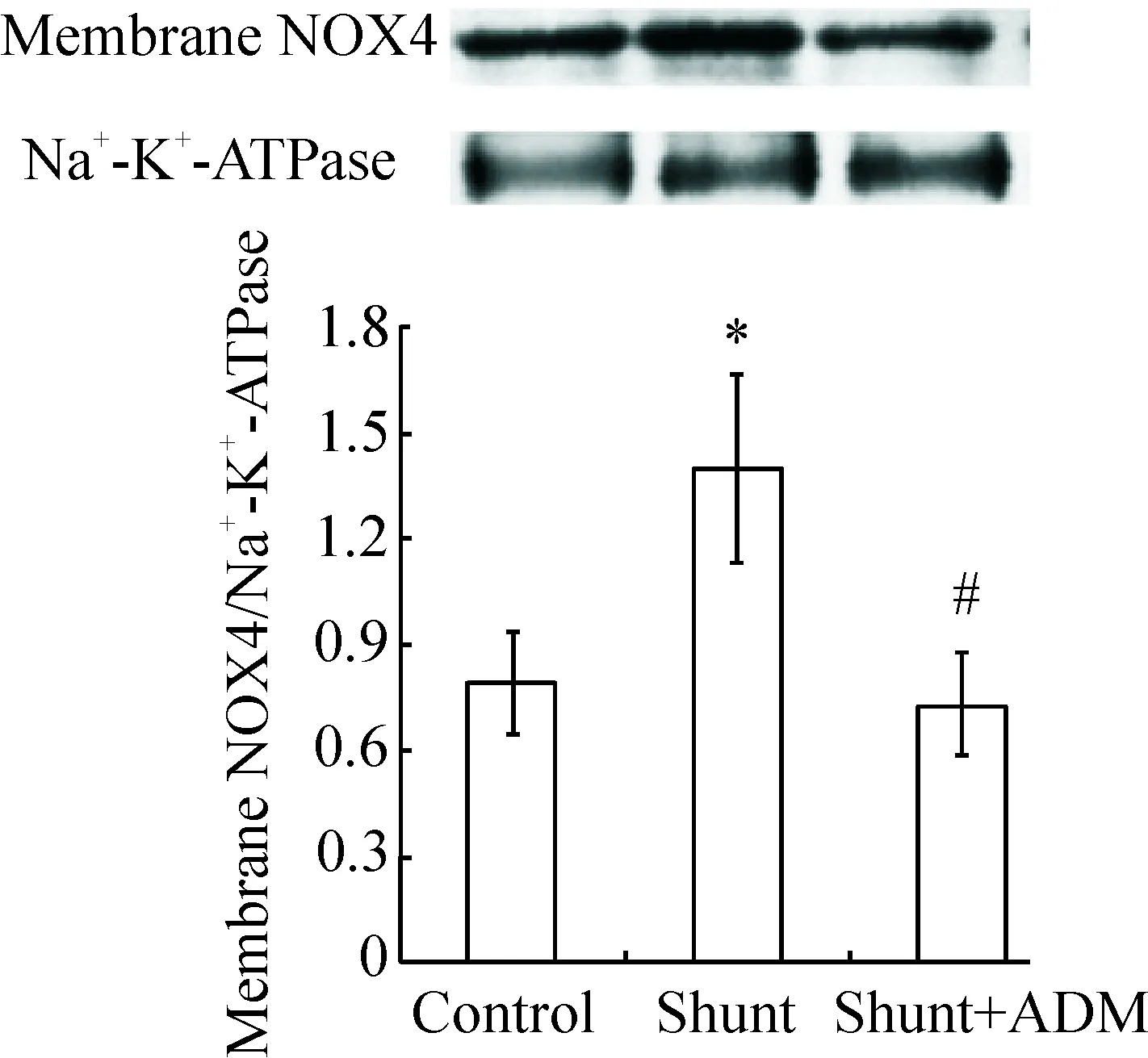
Figure 2.Membrane NOX4 expression in the rat lung tissues determined by Western blot. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsshunt group.
图2 Western blot检测大鼠肺组织细胞膜NOX4的表达
多项研究表明氧化应激参与了肺动脉高压的发病机制,ROS增多和抗氧化能力下降在肺动脉高压和肺血管结构重构的发生发展中起了重要作用[1-6]。Bowers等[1]报道在特发性肺动脉高压患者病变的肺血管部位DNA氧化损伤标志物(8-羟基鸟苷)表达增多,同时肺组织SOD表达和活性下降,提示在肺动脉高压患者存在肺血管氧化损伤。动物实验显示抗氧化治疗则可缓解低氧小鼠肺动脉高压和肺血管结构重构的发生,提示氧化应激参与了肺动脉高压的发生[6]。我们的研究显示,大鼠腹主动脉-下腔静脉分流术后8周,在肺动脉高压和肺血管结构重构的同时,肺组织中自由基导致脂质过氧化的终产物MDA含量也明显升高,提示氧化应激也参与了高肺血流性肺动脉高压和肺血管结构重构的形成。
有研究表明ADM对心血管系统氧化应激具有重要的调节作用。在醛固酮依赖的恶性高血压大鼠,ADM可通过抑制NADPH通路,缓解心脏氧化应激,减少左心室胶原蛋白沉积[11]。Liu等[12]利用离体培养的大鼠主动脉平滑肌细胞,观察到ADM可呈剂量依赖性地减少Ang-Ⅱ诱导的主动脉平滑肌细胞ROS产生增多,提示ADM可抑制血管壁氧化应激的产生。本实验结果发现,通过皮下埋放微量渗透泵的方法持续给予分流大鼠ADM,在使肺动脉压力明显降低和肺血管结构改变明显缓解的同时,肺组织MDA含量也明显降低,提示ADM干预高肺血流性肺动脉高压和肺血管结构重构的作用可能与抑制肺内氧化应激的产生有关。
血管壁内ROS主要由NADPH氧化酶途径产生。研究显示,肺动脉高压时NAPDH氧化酶活性和含量升高[5,15],ROS产生增多。ROS通过损伤内皮细胞、促进肺动脉平滑肌增殖和肺血管外胶原沉积导致肺血管结构重构。NOX4是NADPH氧化酶细胞膜亚基的重要组成部分,在血管壁内皮细胞,平滑肌细胞和外膜成纤维细胞中均有表达,尤其中层平滑肌细胞中表达最显著[16-17]。有研究表明,在肺动脉高压的动物模型中,NOX4表达增多,刺激ROS的产生,导致ecSOD的失活,并通过激活NF-κB和上调cyclin D1的表达导致血管重构[18]。应用NOX4抑制剂GKT137831和减轻低氧诱导的肺血管壁细胞增殖[19]。ADM抑制高肺血流性肺动脉高压大鼠氧化应激的作用机制是否与其对ROS产生的影响有关,我们对此进行了研究,结果发现高肺血流性肺动脉高压组大鼠肺组织NOX4表达上调,而ADM使高肺血流大鼠肺组织NOX4表达下调,提示ADM可能通过抑制肺组织NOX4表达、抑制NADPH氧化酶,进一步抑制大鼠ROS产生、抑制肺组织氧化应激,从而缓解高肺血流性肺动脉高压和肺血管结构重构。
正常机体内存在SOD、GSH-Px等酶促抗氧化系统和维生素E等非酶促抗氧化系统来维持机体ROS产生和消除的平衡。SOD等可通过酶促反应将ROS还原成O2和水,从而缓解氧化应激状态。GSH则可在GSH-Px作用下将脂质过氧化物和H2O2还原成脂醇和水,同时生成GSSG。因此SOD、GSH-Px活性,以及GSH/GSSG比值常被作为评估机体抗氧化能力的指标。研究表明应用SOD类似物或肺组织SOD过表达可减轻低氧诱导的肺血管结构重构[6,20]。在本实验中,我们观察到高肺血流性肺动脉高压大鼠肺组织T-AOC降低,SOD和GSH-Px活性下调,ADM则使上述改变缓解,提示ADM可能通过激活SOD、GSH-Px等酶促抗氧化系统,促进ROS的消除,进一步抑制大鼠肺组织氧化应激,从而缓解高肺血流性肺动脉高压和肺血管结构重构。
总之,ADM可能通过减少高肺血流大鼠ROS产生,增强抗氧化能力,进一步减轻肺组织氧化应激损伤,从而缓解高肺血流性肺动脉高压和肺血管结构重构。这为临床肺动脉高压的防治提供了一条新的思路。
[1] Bowers R, Cool C, Murphy RC, et al. Oxidative stress in severe pulmonary hypertension[J]. Am J Respir Crit Care Med, 2004, 169(6):764-769.
[2] Ghasemzadeh N, Patel RS, Eapen DJ, et al. Oxidative stress is associated with increased pulmonary artery systolic pressure in humans[J]. Hypertension, 2014, 63(6):1270-1275.
[3] Aras-López R, Tovar JA, Martínez L. Possible role of increased oxidative stress in pulmonary hypertension in experimental diaphragmatic hernia[J]. Pediatr Surg Int, 2016, 32(2):141-145.
[4] Ahmed LA, Obaid AA, Zaki HF, et al. Role of oxidative stress, inflammation, nitric oxide and transforming growth factor-beta in the protective effect of diosgenin in monocrotaline-induced pulmonary hypertension in rats[J]. Eur J Pharmacol, 2014, 740:379-387.
[5] Grobe AC, Wells SM, Benavidez E, et al. Increased oxidative stress in lambs with increased pulmonary blood flow and pulmonary hypertension: role of NADPH oxidase and endothelial NO synthase[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 290(6):L1069-L1077.
[6] Nozik-Grayck E, Suliman HB, Majka S, et al. Lung EC-SOD over expression attenuates hypoxic induction of Egr-1 and chronic hypoxic pulmonary vascular remodeling[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 295(3):L422-L430.
[7] Qi JG, Ding YG, Tang CS, et al. Chronic administration of adrenomedullin attenuates hypoxic pulmonary vascular structural remodeling and inhibits proadrenomedullin N-terminal 20-peptide production in rats[J]. Peptides, 2007, 28(4):910-919.
[8] Harada-Shiba M, Takamisawa I, Miyata K, et al. Intratracheal gene transfer of adrenomedullin using polyplex nanomicelles attenuates monocrotaline-induced pulmonary hypertension in rats[J]. Mol Ther, 2009, 17(7):1180-1186.
[9] 赵 强, 齐建光, 杜军保. 肾上腺髓质素对肺动脉高压作用的研究进展[J]. 临床儿科杂志, 2011, 29(12):1182-1184.
[10]高 扬, 齐建光, 李晓惠, 等. 肾上腺髓质素对大鼠高肺血流性肺血管结构重构的干预作用[J]. 实用儿科临床杂志, 2012, 27(22): 1751-1753.
[11]Rahman M, Nishiyama A, Guo P, et al. Effects of adrenomedullin on cardiac oxidative stress and collagen accumulation in aldosterone-dependent malignant hypertensive rats[J]. J Pharmacol Exp Ther, 2006, 318(3):1323-1329.
[12]Liu J, Shimosawa T, Matsui H, et al. Adrenomedullin inhibits angiotensin II-induced oxidative stress via Csk-mediated inhibition of Src activity[J]. Am J Physiol Heart Circ Physiol, 2007, 292(4):H1714-H1721.
[13]庞璐璐, 齐建光, 高 扬, 等. 中介素抑制高肺血流性肺动脉高压大鼠肺组织胶原生成[J]. 中国病理生理杂志, 2014, 30(12):2185-2189.
[14]齐建光, 丁亚光, 李晓惠, 等. 慢性低氧性肺动脉高压大鼠肾上腺髓质素前体N端20肽的变化[J]. 中国病理生理杂志, 2008, 24(2):285-288.
[15]Brennan LA, Steinhorn RH, Wedgwood S, et al. Increased superoxide generation is associated with pulmonary hypertension in fetal lambs: a role for NADPH oxidase[J]. Circ Res, 2003, 92(6):683-691.
[16]Mittal M, Roth M, König P, et al. Hypoxia-dependent regulation of nonphagocytic NADPH oxidase subunit NOX4 in the pulmonary vasculature[J]. Circ Res, 2007, 101(3): 258-267.
[17]Chen F, Haigh S, Barman S, et al. From form to function: the role of Nox4 in the cardiovascular system[J]. Front Physiol, 2012, 412(3):1-12.
[18]Wedgwood S, Lakshminrusimha S, Czech L, et al. Increased p22phox/Nox4 expression is involved in remodeling through hydrogen peroxide signaling in experimental persistent pulmonary hypertension of the newborn[J]. Antioxid Redox Signal, 2013, 18(14):1765-1776.
[19]Green DE, Murphy TC, Kang BY, et al. The Nox4 inhi-bitor GKT137831 attenuates hypo-xia-induced pulmonary vascular cell proliferation[J]. Am J Respir Cell Mol Biol, 2012, 47(5):718-726.
[20]Villegas LR, Kluck D, Field C, et al. Superoxide dismutase mimetic, MnTE-2-PyP, attenuates chronic hypo-xia-induced pulmonary hypertension, pulmonary vascular remodeling, and activation of the NALP3 inflammasome[J]. Antioxid Redox Signal, 2013, 18(14):1753-1764.
(责任编辑: 林白霜, 罗 森)
Regulatory effect of adrenomedulin on pulmonary tissue oxidative stress in rats with pulmonary hypertension induced by high pulmonary blood flow
LIU Li-ping1, 2, PANG Lu-lu1, QI Jian-guang1, GAO Yang1, BAI Wei1, JIN Hong-fang1, DU Jun-bao1
(1DepartmentofPediatrics,FirstHospitalofPekingUniversity,Beijing100034,China;2DepartmentofPulmonology,ChildrenHospitalofShanxi,Taiyuan030013,China.E-mail:qjg2006@126.com)
AIM: To explore the regulatory effect of adrenomedullin (ADM) on pulmonary oxidative stress in the rats with pulmonary hypertension induced by high blood flow. METHODS: Healthy male SD rats (n=22) were randomly divided into control group, shunt group and shunt with ADM group. Abdominal aorta and inferior vena cava shunting was produced in the rats in shunt group and shunt with ADM group. After 8 weeks, ADM (1.5 μg·kg-1·h-1) was administered into the rats in shunt with ADM group subcutaneously by mini-osmotic pump for 2 weeks. Mean pulmonary artery pressure (mPAP) was evaluated by a right cardiac catheterization procedure. The ratio of right ventricular mass to left ventricular plus interventricular septal mass [RV/(LV+SP)] and relative medial thickness (RMT) in pulmonary muscularized arteries were calculated. The content of malonaldehyde (MDA), total antioxidative capacity (T-AOC), and activity of superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px) in lung tissues were detected by colorimetry. The expression of NADPH oxidase 4 (NOX4) in the lung tissue was analyzed by Western blot. RESULTS: Compared with control group, the mPAP, RV/(LV+SP) and RMT in pulmonary muscularized arteries in shunt group were all significantly increased. The content of MDA and the expression of NOX4 in the lung tissues were significantly increased. The T-AOC, and activity of SOD and GSH-Px in the lung tissues were significantly decreased. However, mPAP, RV/(LV+SP) and RMT in pulmonary muscularized arteries in shunt with ADM group were significantly decreased as compared with shunt group. Meanwhile, ADM decreased the content of MDA and the expression of NOX4 in the lung tissues, but increased the T-AOC, and activity of SOD and GSH-Px in the lung tissue of shunt rats. CONCLUSION: ADM inhibits oxidative stress response in the development of pulmonary hypertension and pulmonary vascular structural remodeling induced by high pulmonary blood flow in the rats by down-regulating the NOX4 expression and strengthening the anti-oxidation response.
Pulmonary hypertension; High pulmonary blood flow; Oxidase stress; Adrenomedullin
1000- 4718(2017)04- 0735- 05
2016- 07- 18
2017- 01- 16
国家自然科学基金资助项目(No. 30973226)
R393
A
10.3969/j.issn.1000- 4718.2017.04.026
△通讯作者 Tel: 010-83573238; E-mail: qjg2006@126.com
