槲芪散可通过激活Hedgehog信号通路抑制大鼠肝癌前病变的形成*
2017-04-24李若菲白云飞王芸姣杜尊赎韩文祺王学江
李若菲, 白云飞, 王芸姣, 杜尊赎, 韩文祺, 王学江, 江 瑛
(首都医科大学基础医学院, 北京 100069)
槲芪散可通过激活Hedgehog信号通路抑制大鼠肝癌前病变的形成*
李若菲, 白云飞, 王芸姣, 杜尊赎, 韩文祺, 王学江, 江 瑛△
(首都医科大学基础医学院, 北京 100069)
目的: 探讨槲芪散是否通过调控Hedgehog信号通路抑制大鼠肝癌前病变的机制。方法: 采用改良的Solt-Farber二步法复制大鼠肝癌前病变模型,于肝大部切除术后3 d开始给予槲芪散(8 g/kg)灌胃治疗,4周后收集血清和肝脏标本。分别采用HE染色、免疫组织化学、免疫荧光染色、Western blot、实时荧光定量PCR等方法,观察肝脏病理变化,检测肝组织谷胱甘肽S-转移酶π(glutathioneS-transferase-π,GST-π)、甲胎蛋白(alpha-fetoprotein,AFP)、OV6、白蛋白(albumin, ALB)、Hedgehog信号分子Shh、Smo、Gli2及下游靶分子cyclin D、cyclin E的表达水平;利用比色法检测血清丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)和γ-谷氨酰转移酶(gamma-glutamyltransferase,GGT)水平;给予Hedgehog信号通路抑制剂环杷明观察槲芪散在体外对肝卵圆细胞的影响。结果: 与模型组比较,槲芪散可降低肝癌前病变大鼠血清ALT、AST和GGT水平,减轻肝癌前病变大鼠肝脏的病理变化,降低肝癌前病变标志物GST-π和AFP的表达;槲芪散可促使肝卵圆细胞标志物OV6和肝细胞标志物ALB的表达;槲芪散可激活肝脏Hedgehog信号通路,增加Shh、Smo、Gli2及其下游靶分子cyclin D、cyclin E的表达。结论: 中药复方槲芪散可通过激活Hedgehog信号通路促进肝前体细胞增殖和诱导肝前体细胞向肝细胞分化,抑制肝癌前病变的形成,促进肝脏修复。
肝癌前病变; Hedgehog信号通路; 肝前体细胞; 槲芪散
原发性肝癌是严重威胁人类健康的恶性肿瘤之一,其发病率在我国位居所有恶性肿瘤中的第3位。由于肝癌起病隐匿、进展迅速、恶性程度高、易转移和复发等特点,肝癌的死亡率在我国已跃居所有恶性肿瘤中第2位[1]。目前认为肝癌的发生和发展是一种长期的、多因素影响的、多基因参与的、癌细胞与微环境和机体代谢免疫等因素间相互作用的复杂连续过程。肝癌前病变是肝癌发生过程的必经阶段,由肝癌前病变进展为肝癌的发生机制至今仍不清楚。因此探讨肝癌形成和进展的可能机制以及寻找相关的干预措施成为肝癌防治研究的重要课题之一。Hedgehog信号通路是一条高度保守的信号转导通路,具有调控前体细胞的自我更新、增殖及分化的功能,不仅在机体内环境的稳定和组织修复中发挥重要作用,而且与恶性肿瘤的侵袭和转移[2-3]密切相关。中药复方槲芪散(Huqi San,HQS)系钱英教授在临床应用多年的经验方,具有逆转肝纤维化和抑制肝癌前病变的功效[4],但其具体作用机制尚不十分清楚。本研究旨在探讨槲芪散是否通过调控Hedgehog信号通路抑制大鼠肝癌前病变的机制,为槲芪散的进一步临床应用提供实验依据。
材 料 和 方 法
1 动物
雄性 Wistar大鼠45只,6周龄,体重120~140 g,购自北京维通利华实验动物技术有限公司,于首都医科大学实验动物中心饲养,动物合格号为SCXK(京 2012-00011)。采用数字表法将大鼠随机分为3组(每组15只):对照(control)组、模型(model)组及槲芪散(HQS)组。采用改良的Solt-Farber二步法[5-6]复制大鼠肝癌前病变模型,即给予大鼠腹腔一次性注射二乙基亚硝胺(diethylnitrosamine,DEN; 200 mg/kg)作为启动剂,2周后皮下植入二乙酰氨基芴(2-acetylaminofluorene,2-AAF)进入选择性促进程序,于第3周行肝大部切除术,治疗组于肝大部切除术后3 d开始连续给予槲芪散(8 g/kg)灌胃治疗,对照组和模型组给予等量生理盐水,4周后,在10%的水合氯醛腹腔麻醉下,手术快速收集肝脏标本,并分别固定于4%甲醛和冻存于-80 ℃冰箱备用。
2 主要试剂
DEN购自Sigma;2-AAF购自Innovative Research;兔抗鼠谷胱甘肽S-转移酶π(glutathioneS-transferase-π,GST-π)多克隆抗体购自MBL;兔抗鼠甲胎蛋白(alpha-fetoprotein, AFP)多克隆抗体购自Biomedicine;兔抗鼠Shh、Smo和Gli2多克隆抗体均购自Santa Cruz;兔抗鼠cyclin D和cyclin E多克隆抗体均购自Cell Signaling Technology;Smo抑制剂环杷明(cyclopamine)购自Selleck;检测丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)和γ-谷氨酰转移酶(gamma-glutamyltransferase,GGT)的试剂盒购自Roche;免疫组化试剂盒购自中杉金桥公司;RT-qPCR试剂盒购自Promega;引物根据Genbank数据库设计,由上海生工生物工程技术服务有限公司合成。
3 实验方法
3.1 HE染色 石蜡切片常规脱蜡水化,苏木素染色5~10 min,伊红染色1 min,脱水、透明、中性树脂封片,光学显微镜下观察并摄片。
3.2 免疫组织化学染色 石蜡切片常规脱蜡水化,微波修复抗原,3%H2O2处理10 min以封闭内源性过氧化物酶; BSA封闭1 h。滴加I抗(GST-π和AFP),4℃湿盒过夜。加HRP标记的II抗,37 ℃孵育1 h, DAB显色,显微镜下观察以确定显色时间,苏木素复染核。脱水、透明、中性树脂封片,光学显微镜观察并摄片。
黍子的施肥宜早不宜迟,为了保证幼苗养分供应,要注意施足种肥,每亩尿素3-5斤。黍子追肥是一项有效的增产措施,第一次追肥在拨节前配合浇水进行,亩追尿素10-15斤,可促进幼苗生长强壮。孕穗期追第二次肥以10斤为宜,这次追肥能促进穗大粒多,籽粒饱满。
3.3 免疫荧光染色 冰冻切片于丙酮固定10 min(4 ℃),1% BSA 封闭30 min,孵育 I 抗(OV6和Gli2),置于湿盒中4 ℃过夜,滴加荧光标记的Ⅱ抗(FITC和Cy3)1 h, DAPI复染细胞核, 抗荧光淬灭封片剂封片,荧光显微镜观察并摄片。
3.4 Western blot法检测GST-π、AFP、cyclin D、cyclin E、Shh、Smo、Gli2和ALB的蛋白水平 用含蛋白酶抑制剂的裂解液裂解组织,利用BCA蛋白定量试剂盒对蛋白定量,按约50 μg的蛋白量上样,经SDS-PAGE后,低温恒压电转至PVDF膜上,5%脱脂奶粉封闭,I 抗4 ℃孵育过夜, 加入HRP标记的 II 抗,室温下孵育1 h,ECL化学发光,ImageJ进行定量分析。
3.5 RT-qPCR实验 采用TRIzol提取肝组织总RNA,利用Promega反转录试剂盒反转录为cDNA,用实时荧光定量PCR检测Shh、Smo、Gli2基因和内参照18S的表达水平。Shh的上游引物为5’-TCTCGAGACCCAACTCCGAT-3’,下游引物为5’-TAACCTTGCCTGCTCTTGCT-3’;Smo的上游引物为5’-ATGCGTGTTTCTTTGTGGGC-3’,下游引物为5’-ACACAGGATAGGGTCTCGCT-3’;Gli2的上游引物为5’-AACATGAGCCCTTCTGCTCC-3’,下游引物为5’-TGCCAGACCTCACTTCGTTC-3’;18S的上游引物为5’-GTAACCCGTTGAACCCCATT-3’,下游引物为5’-CCATCCAATCGGTAGTAGCG-3’。PCR条件为:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s;共40循环。用2-ΔΔCt法计算mRNA表达。
3.6 全自动生化分析仪检测血清ALT、AST和GGT水平 大鼠血清ALT、AST和GGT水平的检测采用Roche的试剂盒(IFCC酶比色法)在Cobas C311 全自动生化分析仪上进行,由首都医科大学临床检验中心完成检测。
3.7 细胞培养 大鼠肝卵圆细胞系WB-F344由首都医科大学友谊医院尤红教授馈赠。WB-F344 细胞贴壁生长于含10%胎牛血清的DMEM/F12培养液中,于37 ℃、5% CO2孵箱中进行培养,每2~3 d传代。细胞依据处理方式不同分为WB-F344细胞对照组、HQS药物血清组、cyclopamine组和HQS+cyclopamine组。细胞培养用HQS药物血清终浓度为15%,作用于细胞72 h;cyclopamine终浓度为5 mmol/L, 作用于细胞48 h。
4 统计学处理
计量数据以SPSS 17.0统计学软件进行分析,数据均采用均数±标准差(mean±SD)表示。多组比较采用单因素方差分析,各组均数间的两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 大鼠肝癌前病变的病理变化观察
肉眼观察,与正常对照组比较,模型组大鼠肝脏颜色略浅,表面粗糙,可见许多灰白色直径1~3 mm的细小颗粒,再生肝叶饱满边缘钝;与模型组比较,槲芪散组肝脏病变明显减轻,表面较光滑,再生肝叶饱满体积较大。镜下观察,模型组肝组织结构紊乱,可见肝细胞变性和坏死,汇管区小胆管增生,沿小胆管外侧可见核呈圆形或卵圆形、胞浆较少的卵圆细胞增生,并可见异型增生的嗜酸细胞灶、嗜碱细胞灶和透明细胞灶,异型增生灶细胞密集成团,体积较肝细胞小,细胞核浆比增大,与文献报道[5]结果一致;而槲芪散组可见大部分肝小叶结构近乎完整,汇管区小胆管显著增生,部分肝细胞可见脂肪变性,但细胞异型增生灶显著减少,见图1。
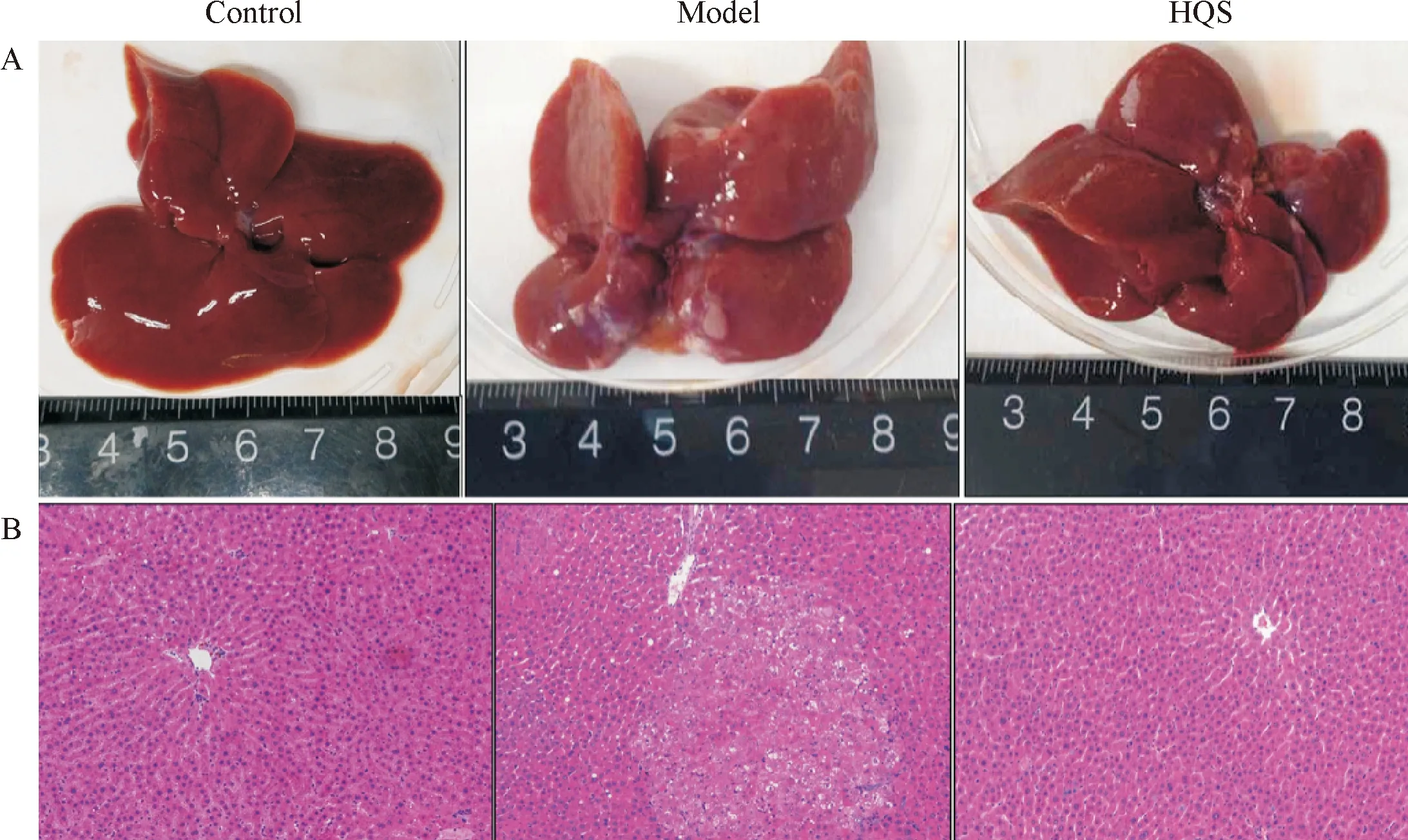
Figure 1.The histopathological observation of the liver tissues in the rats. A: bulk specimen; B: HE staining (×100).
图1 各组大鼠肝脏病理变化
2 大鼠血清ALT、AST和GGT的变化
与正常对照组比较,模型组大鼠血ALT、AST和GGT水平明显升高(P<0.01);与模型组比较,槲芪散组ALT、AST和GGT水平明显下降(P<0.05),见图2。
3 大鼠肝组织GST-π和AFP蛋白表达水平的变化
与正常对照组比较,模型组大鼠肝脏癌前病变标志物GST-π及肝癌标志物AFP的表达水平明显增加,阳性病灶多呈圆形或类圆形分布,主要定位于细胞浆中(P<0.01);与模型组比较,而槲芪散组大鼠肝组织GST-π及AFP的表达水平明显降低,阳性表达灶的强度和面积明显减少(P<0.05),见图3。上述结果表明槲芪散抑制大鼠肝癌前病变的形成。
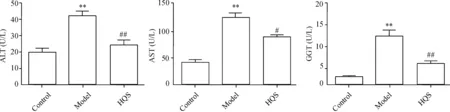
Figure 2.The activity of ALT, AST and GGT in the rat serum. Mean±SD.n=15.**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
图2 各组大鼠血清ALT、AST和GGT的水平
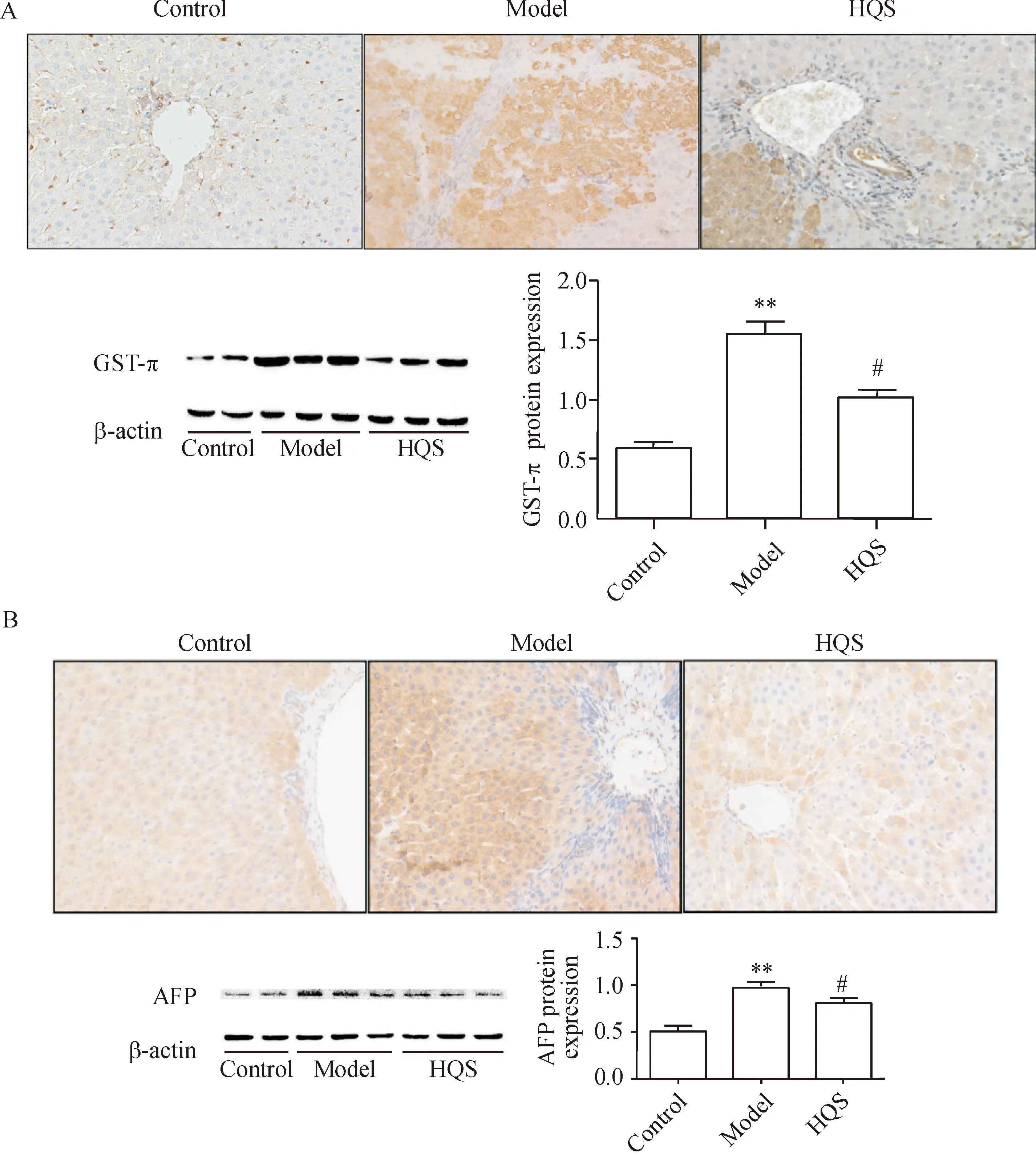
Figure 3.The protein expression of GST-π (A) and AFP (B) in the rat liver tissues measured by IHC staining (×200) and Western blot. Mean±SD.n=15.**P<0.01vscontrol group;#P<0.05vsmodel group.
图3 各组大鼠肝组织GST-π和AFP蛋白的表达
4 大鼠肝组织Hedgehog信号分子mRNA及蛋白表达水平的变化
与正常对照组比较,模型组Shh、Smo和Gli2表达增高(P<0.05);与模型组比较,槲芪散治疗后,Shh、Smo和Gli2表达进一步增高(P<0.05),表明槲芪散可能促使肝癌前病变大鼠肝脏Hedgehog信号通路的持续激活从而参与组织损伤修复,见图4。
5 大鼠肝组织cyclin D和cyclin E蛋白表达水平的变化
与正常对照组比较,模型组cyclin D和cyclin E表达升高(P<0.05),提示肝癌前病变大鼠肝脏细胞增生活跃;与模型组比较,槲芪散组cyclin D和cyclinE表达进一步升高(P<0.05),表明槲芪散可能通过促使肝癌前病变大鼠的肝脏细胞增殖以促进损伤修复,从而抑制肝癌前病变形成,见图5。
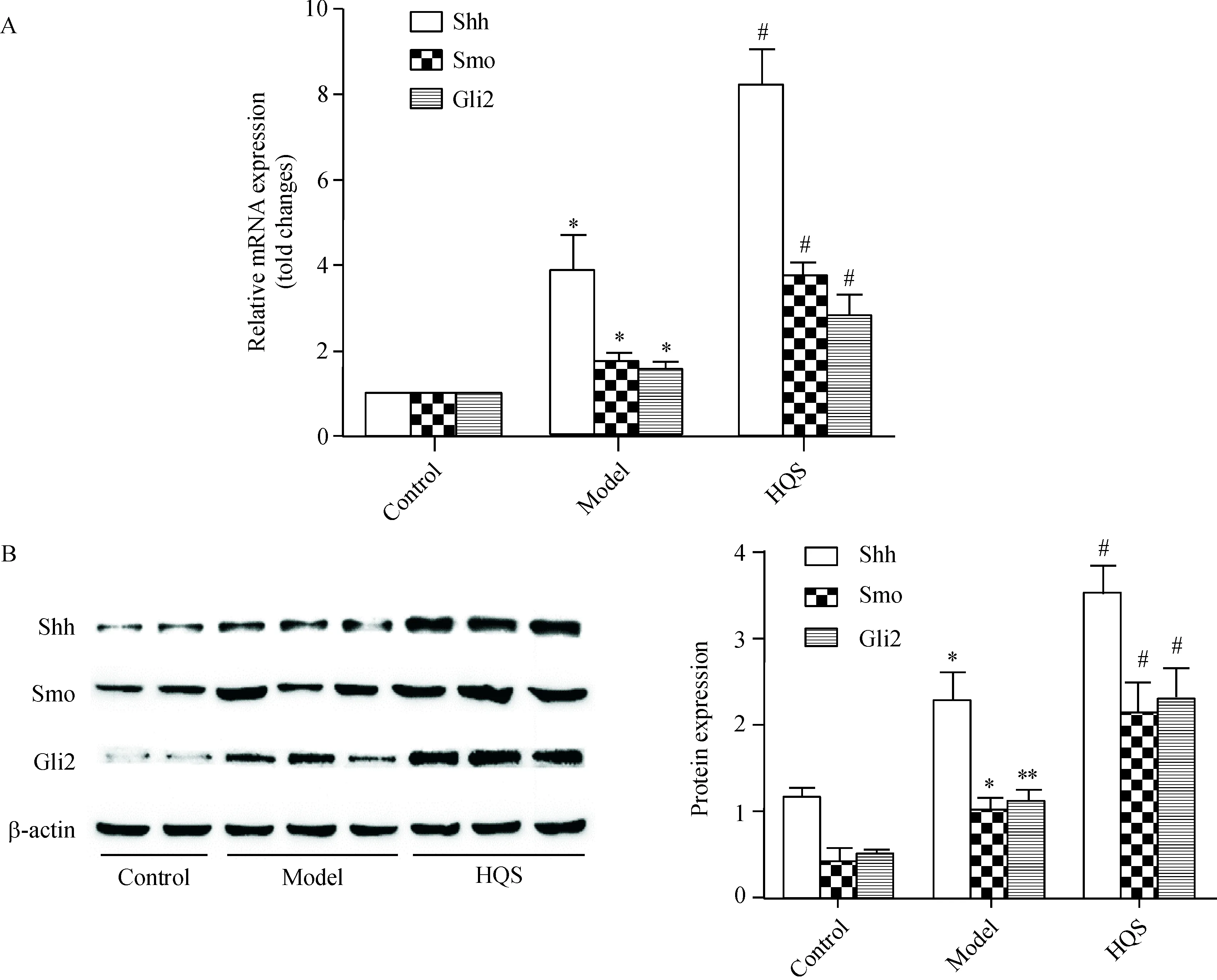
Figure 4.The mRNA (A) and protein (B) expression of Hedgehog signaling molecules in the rat liver tissues. Mean±SD.n=15.*P<0.05,**P<0.01vscontrol group;#P<0.05vsmodel group.
图4 各组肝组织Hedgehog信号通路分子mRNA及蛋白的表达
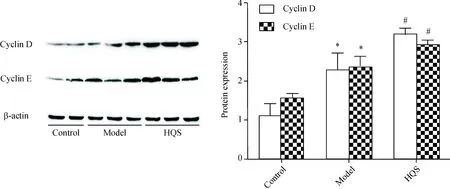
Figure 5.The protein expression of cyclin D and cyclin E in the rat liver tissues. Mean±SD.n=15.*P<0.05vsmodel group;#P<0.05vsHQS group.
图5 各组大鼠肝组织cyclin D和cyclin E蛋白的表达
6 大鼠肝前体细胞Gli2蛋白表达水平的变化
与正常对照组比较,模型组出现大鼠肝卵圆细胞标志物OV6与Gli2双标阳性区,表明肝癌前病变大鼠肝前体细胞增生活跃;与模型组比较,槲芪散组OV6与Gli2双标阳性区显著增多,表明槲芪散可能通过活化的Hedgehog信号通路促进肝癌前病变大鼠肝前体细胞的增殖以发挥其保护作用,见图6。
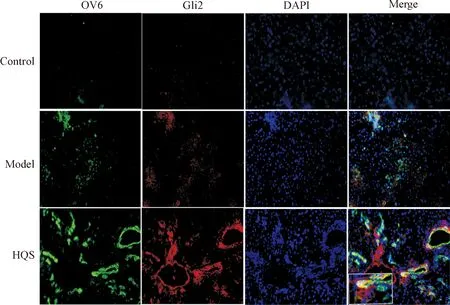
Figure 6.The co-localization of OV6 and Gli2 proteins in the rat liver tissues (immunofluorescence staining, ×200).
图6 各组肝组织中OV6和Gli2共定位的荧光显微镜观察
7 大鼠肝组织ALB蛋白表达水平的变化
与正常对照组比较,模型组ALB表达降低(P<0.05),表明肝癌前病变大鼠成熟肝细胞的不足;与模型组比较,槲芪散组ALB表达明显增高(P<0.05),表明槲芪散可促进肝癌前病变的大鼠肝前体细胞向肝细胞的分化,见图7。
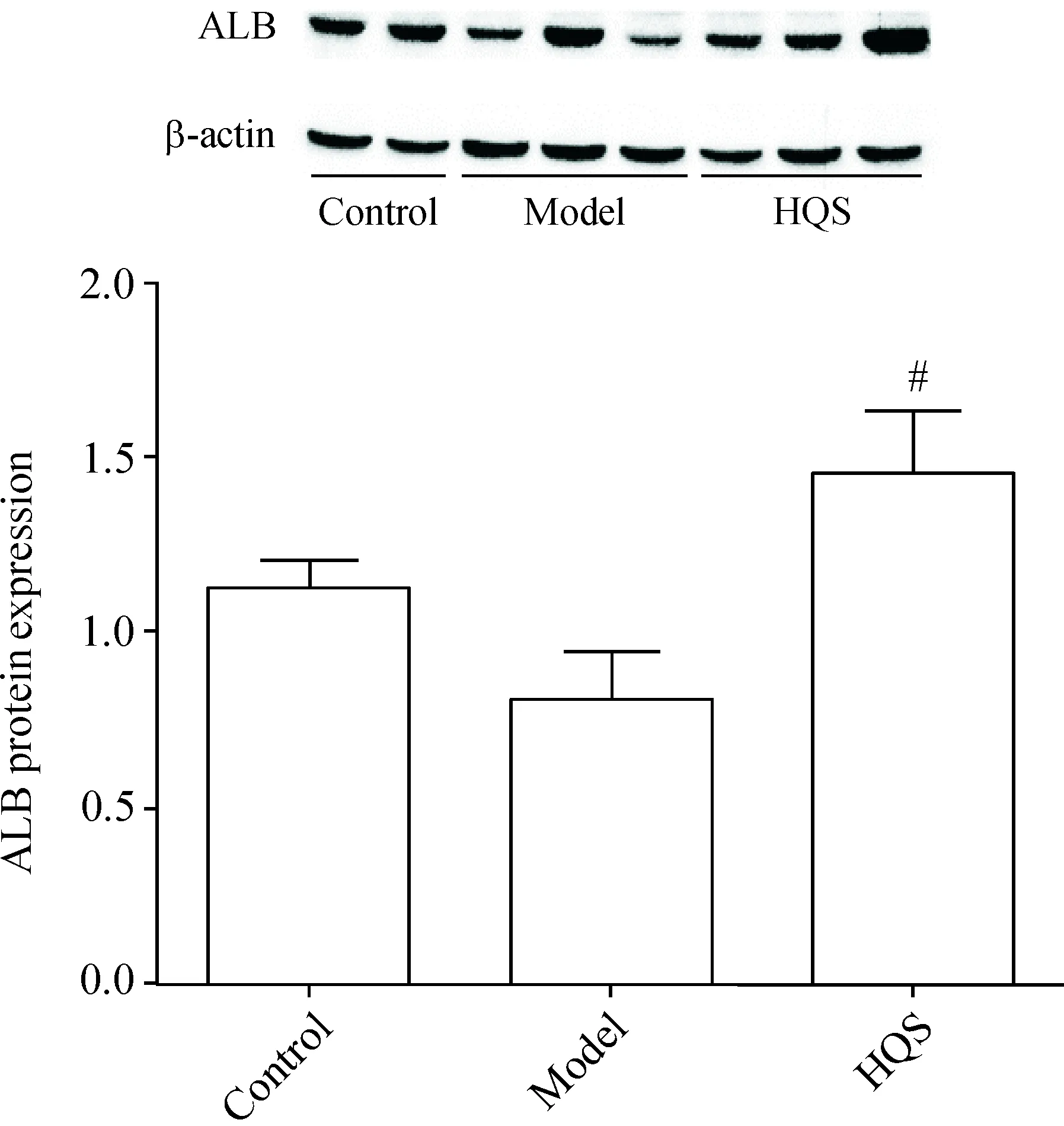
Figure 7.The protein expression of ALB in the rat liver tissues. Mean±SD.n=15.#P<0.05vsmodel group.
图7 各组肝组织ALB蛋白的表达
8 大鼠肝卵圆细胞系WB-F344中Gli2、cyclin D和cyclin E蛋白表达水平的变化
与WB-F344细胞对照组比较,HQS组的Gli2、cyclin D和cyclin E表达增高(P<0.05);与cyclopamine组比较,HQS+cyclopamine组的Gli2、cyclin D和cyclin E表达降低(P<0.01),表明槲芪散可促使大鼠卵圆细胞的Hedgehog信号通路激活,见图8。
讨 论
肝癌是我国常见的恶性肿瘤之一。尽管临床研究已取得了诸多进展,但肝癌的总体疗效并不尽如人意,其主要原因与其发病隐匿、进展快、预后凶险有关。目前,普遍认为肝癌的发生是一个多因素、多基因共同参与的过程,可分为启动、促进和演进3个阶段[7],此过程初期可逆但后期不可逆。启动阶段通常由病毒、化学致癌物等引起,虽经历时间短,但此时肝细胞已出现了GGT及GST-π等很多酶学改变;促进阶段时间较长,此时已启动的肝细胞和肝前体细胞进一步增生,可形成异型增生灶,在致癌因素的持续作用下,形成癌前期病变细胞;演进阶段是指少部分癌前期病变细胞在特定因素作用下继续异型增生,使其细胞形态、超微结构及表面标志物等方面逐渐具有癌细胞的特点,进而演变成肝癌。癌前病变是癌变进展中启动和促进阶段,此时绝大部分细胞可以被“重建”,只有少部分细胞在特定因素作用下进一步癌变最终发展为癌,因此通常认为癌前病变阶段是可逆的,成为阻断癌变的理想靶点[8]。中药槲芪散是国家级名老中医钱英教授在临床沿用多年的、用于治疗肝纤维化和肝癌前病变的经验方[4,9],由黄芪、郁金、丹参等8位中药组成,其以调补肝脾肾、扶正为主;行气活血、通络祛邪为辅;并具清热祛湿、解毒疏肝、利胆化痰的作用。我们课题组前期的动物实验研究业已证实槲芪散具有抑制大鼠肝癌前病变形成的作用,其作用机制与槲芪散调控端粒酶活性[10]、抑制c-myc[4]、诱导肝癌细胞凋亡[11]有关。但是槲芪散是否会影响肝前体细胞增殖和分化以及与Hedgehog信号分子的关系并不清楚。
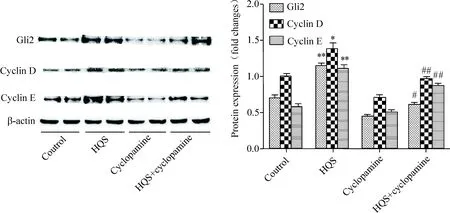
Figure 8.The protein expression of Gli2, cyclin D and cyclin E in the oval cells (WB-F344 cell line). Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vscyclopamine group.
图8 在卵圆细胞中Gli2、cyclin D和cyclin E蛋白的表达
本实验利用改良的的Solt-Farber二步法[5-6]复制的大鼠肝癌前病变模型中,化学致癌物DEN系诱癌过程的启动剂,而2-AAF作为促癌剂并通过抑制严重肝损伤后的肝细胞分裂增生和促进肝卵圆细胞的增生和活化的机制形成大鼠肝癌前病变。GST-π是肝脏的胚胎性酶,在正常成年大鼠肝脏基本无活性,在癌前病变时,肝细胞的去分化和卵圆细胞的异常分化和增生均可促使GST-π生成增多,成为肝细胞癌前病变的特征和标志,是实验性肝癌研究中检测癌前病变、观察癌变程度的常用指标[11-12]。AFP则常作为未成熟细胞或肝癌细胞的标志。ALT、AST和GGT是评价肝脏功能的常用指标,当肝脏损伤时,其血清水平明显升高。本实验结果发现,槲芪散可抑制肝癌前病变大鼠血清ALT、AST和GGT的升高,并且明显减轻模型组大鼠肝脏病理变化,抑制异型增生灶形成,降低肝癌前病变标志物GST-π和AFP的表达,表明槲芪散可明显抑制肝癌前病变的进展。
已知Hedgehog信号通路具有调控细胞生长、增殖和分化的功能,是胚胎发育过程中参与调控组织、器官生长、发育的一条重要的信号通路,与组织损伤修复和再生及恶性肿瘤的发展及侵袭和转移密切相关[2, 13]。Hedgehog信号通路主要由Shh、Ihh、Dhh配体、Patched(Ptc)受体、Smo跨膜蛋白、核转录因子Gli构成。当Hedgehog信号被激活时,Hedgehog配体与Ptc结合后,解除了Ptc对Smo的抑制,Smo将信号向胞内传递,继而激活核转录因子Gli,从而诱导c-myc、cyclin D、cyclin E等调控细胞增殖的下游靶基因的转录。已有文献报道, Hedgehog信号分子在肝癌组织和许多肝癌细胞株高表达,Gli2蛋白表达与肝癌的病理分级及侵袭转移有明显的相关性[2, 14]。本实验结果发现,肝癌前病变大鼠肝脏Hedgehog信号通路激活,提示Hedgehog信号通路的活化也参与了大鼠肝癌前病变的形成。
最近的研究证实,Hedgehog信号通路亦可调控肝前体细胞的增殖和分化参与肝再生和肝损伤后的修复过程[15-16],Ochoa等[17]的研究发现予小鼠70%肝大部切除术后,肝脏的再生修复可通过激活Hedgehog信号通路,促进肝前体细胞的累积和增殖以及肝细胞和胆管上皮细胞的增殖来完成的。而其促使肝前体细胞增殖的机制与Hedgehog信号分子配体Shh抑制细胞凋亡和促进细胞增殖有关。而肝前体细胞与Hedgehog信号通路活性之间的关系同样也在临床研究中得到了证实,在原发性胆汁性肝硬化和酒精性脂肪性肝病患者均发现Hedgehog信号通路的激活,并同时伴有肝前体细胞的增殖和活化[18]。肝卵圆细胞是大鼠的肝前体细胞,来源于赫氏管,属于肝内胆管系统源性的多潜能分化细胞群,在肝细胞严重受损或分裂增生受抑制时卵圆细胞具有向肝细胞和胆管上皮细胞多向分化的潜能[19],发挥修复受损肝脏的作用。而当致癌因素存在时,卵圆细胞也可演变为癌前期病变细胞,后者可分化为肝细胞,也可演变为肝癌细胞[20-21]。本研究结果发现,中药槲芪散促使肝癌前病变大鼠的肝脏及肝卵圆细胞的Hedgehog信号通路活化及其下游靶分子cyclin D和cyclin E升高,促使卵圆细胞标志物OV6和成熟肝细胞标志物ALB升高,表明中药槲芪散阻断大鼠肝癌前病变的机制可能与其促使Hedgehog信号通路进一步活化、促进肝卵圆细胞增殖和向肝细胞分化而促使肝脏修复有关。体外实验的研究结果证实槲芪散可直接促进Hedgehog信号通路的活化和肝卵圆细胞的增殖。
综上所述,本研究结果表明中药复方槲芪散可通过激活Hedgehog信号通路促进卵圆细胞增殖和向肝细胞分化,进而抑制大鼠肝癌前病变的形成。本研究为槲芪散的临床应用研究提供了实验依据,但其活化Hedgehog信号通路的具体机制尚待进一步的研究。
[1] 陈万青, 郑荣寿, 张思维, 等. 2012年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2016, 25(1):1-8.
[2] Omenetti A, Diehl AM. The adventures of Sonic hedgehog in development and repair. II. Sonic hedgehog and liver development, inflammation, and cancer[J]. Am J Physiol Gastrointest Liver Physiol, 2008, 294(3):G595-G598.
[3] Mcmillan R, Matsui W. Molecular pathways: the hedgehog signaling pathway in cancer[J]. Clin Cancer Res, 2012, 18(18):4883-4888.
[4] Li X, Shi ZM, Feng P, et al. Effect of Qi-protecting powder (Huqi San) on expression of c-jun, c-fos and c-myc in diethylnitrosamine-mediated hepatocarcinogenesis[J]. World J Gastroenterol, 2007, 13(31):4192-4198.
[5] Solt D, Farber E. New principle for the analysis of chemical carcinogenesis[J]. Nature, 1976, 263:701-703.
[6] Luo Q, Siconolfi-Baez L, Annamaneni P, et al. Altered protein expression at early-stage rat hepatic neoplasia[J]. Am J Physiol Gastrointest Liver Physiol, 2007, 292(5): G1272-G1282.
[7] Farber E. The multistep nature of cancer development [J]. Cancer Res, 1984, 44(10):4217-4223.
[8] Sangro B, Herraiz M, Prieto J. Gene therapy of neoplastic liver diseases[J]. Int J Biochem Cell Biol, 2003, 35(2):135-148.
[9] Jiang Y, Wang C, Li YY, et al. Mistletoe alkaloid fractions alleviates carbon tetrachloride-induced liver fibrosis through inhibition of hepatic stellate cell activation via TGF-β/Smad interference[J]. J Ethnopharmacol, 2014, 158(Pt A):230-238.
[10]刘树红, 吕 喆, 李 霞, 等. 槲芪散及其君药槲寄生提取物对人肝癌细胞生长和端粒酶活性的影响[J]. 中药药理与临床, 2007, 230(3):62-65.
[11]董 坤, 丰 平, 江 瑛, 等. 槲寄生碱和多糖对肝癌细胞增生和凋亡的影响[J]. 首都医科大学学报, 2009, 30(1):80-84.
[12]Soma Y, Satoh K, Sato K. Purification and subunit-structural and immunological characterization of five glutathioneS-transferases in human liver, and the acidic form as a hepatic tumor marker[J]. Biochim Biophys Acta, 1986, 869(3):247-258.
[13]Ruiz i Altaba A, Snchez P, Dahmane N. Gli and hedgehog in cancer: tumours,embryos and stem cells[J]. Nat Rev Cancer, 2002, 2(5):361-372.
[14]Wang YH, Sui XM, Sui YN, et al. BRD4 induces cell migration and invasion in HCC cells through MMP-2 and MMP-9 activation mediated by the Sonic hedgehog signaling pathway[J]. Oncol Lett, 2015, 10(4):2227-2232.
[15]金 海,刘慧玲,李学俊,等. 大鼠部分肝切除术后Hedgehog信号分子的表达[J]. 中国病理生理杂志, 2012, 28(1):90-93.
[16]Choi SS, Omenetti A, Syn WK, et al. The role of Hedgehog signaling in fibrogenic liver repair[J]. Int J Biochem Cell Biol, 2011, 43(2):238-244.
[17]Ochoa B, Syn WK, Delgado I, et al. Hedgehog signaling is critical for normal liver regeneration after partial hepatectomy in mice[J]. Hepatology, 2010, 51(5):1712-1723.
[18]Jung Y, Brown KD, Witek RP, et al. Accumulation of hedgehog-responsive progenitors parallels alcoholic liver disease severity in mice and humans[J]. Gastroenterology, 2008, 134(5):1532-1543.
[19]Strick-Marchand H, Morosan S, Charneau P, et al. Bipotential mouse embryonic liver stem cell lines contribute to liver regeneration and differentiate as bile ducts and hepatocytes[J]. Proc Natl Acad Sci U S A, 2004, 101(22):8360-8365.
[20]Aterman E. The stem cell of the liver: a selective review[J]. J Cancer Res Clin Oncol, 1992, 118(2):87-115.
[21]Sell S, Dunsford HA. Evidence for the stem cell origin of hepatocellular carcinoma and cholangiocarcinoma[J]. Am J Pathol, 1989, 134(6):1347-1363.
(责任编辑: 林白霜, 罗 森)
Huqi San inhibits prehepatocarcinoma in rats probably through activating Hedgehog signaling pathway
LI Ruo-fei, BAI Yun-fei, WANG Yun-jiao, DU Zun-shu, HAN Wen-qi, WANG Xue-jiang, JIANG Ying
(CollegeofBasicMedicine,CapitalMedicalUniversity,Beijing100069,China.E-mail:jiangy@ccmu.edu.cn)
AIM: To explore the influence of Huqi San on the Hedgehog signaling pathway in rats with prehe-patocarcinoma. METHODS: The model of prehepatocarcinoma in the rats was established by a modified solt-farber method. The rats were intragastric administrated with Huqi San solution for 3 d after subtotal hepatectomy. Four weeks after administration of the Huqi San solution, the hepatic damage was observed by histopathological analysis. The protein expression of glutathioneS-transferase-π (GST-π), alpha-fetoprotein (AFP), OV6, albumin (ALB) and glioma-associated oncogene homolog 2 (Gli2) was detected by immunohistochemistry and immunofluorescence staining. The expression of Sonic hedgehog (Shh), Smoothened (Smo), Gli2, cyclin D and cyclin E at mRNA and protein levels in the rats was determined by RT-qPCR and Western blot, respectively. The serum levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST) and gamma-glutamyltransferase (GGT) were assayed using diagnostic kits. RESULTS: Compared with model group, Huqi San decreased the serum levels of ALT, AST and GGT, and alleviated the pathological changes in prehepatocarcinoma rats. Huqi San inhibited the protein expression of GST-π and AFP (P<0.05) in the prehepatocarcinoma rats. Huqi San also promoted the protein expression of OV6 and ALB (P<0.05). Furthermore, Huqi San activated Hedgehog signaling pathway and its downstream targeting molecules such as Shh, Smo, Gli2, cyclin D and cyclin E. In addition, the resultsinvitroshowed that Huqi San may activate Hedgehog signaling pathway and promoted oval cell proliferation. CONCLUSION: Huqi San not only promotes hepatic progenitor cell proliferation, but also induces hepatic progenitor cell differentiation and inhibits prehepatocarcinoma in the rats probably via activating Hedgehog signaling pathway.
Prehepatocarcinoma; Hedgehog signaling pathway; Hepatic progenitor cells; Huqi San
1000- 4718(2017)04- 0661- 08
2016- 12- 07
2017- 01- 12
北京市自然科学基金资助项目(No. 7102013); 北京市中医药科技一般规划项目(No. JJ2013-02); 北京市教委面上项目(No. KM20160025004)
R730.23
A
10.3969/j.issn.1000- 4718.2017.04.014
△通讯作者 Tel: 010-83911687; E-mail: jiangy@ccmu.edu.cn
