CCR5第二胞外环的拮抗短肽对哮喘小鼠肺组织炎症细胞浸润和TNF-α表达的影响*
2017-04-24梁蓉蓉李雯静沈溪明黄花荣
梁蓉蓉, 李雯静▲, 刘 娟, 沈溪明, 黄花荣△
(中山大学孙逸仙纪念医院 1儿科, 2病理科, 广东 广州 510120)
CCR5第二胞外环的拮抗短肽对哮喘小鼠肺组织炎症细胞浸润和TNF-α表达的影响*
梁蓉蓉1, 李雯静1▲, 刘 娟1, 沈溪明2, 黄花荣1△
(中山大学孙逸仙纪念医院1儿科,2病理科, 广东 广州 510120)
目的: 研究与CC趋化因子受体5(CC chemokine receptor 5,CCR5)第二胞外环特异性结合的拮抗短肽对哮喘小鼠肺组织炎症细胞浸润和TNF-α表达的影响。方法: 筛选最适宜的卵白蛋白(ovalbumin,OVA)致敏浓度,构建OVA诱导的BALB/c小鼠哮喘模型。模型构建成功后通过尾静脉注射不同浓度拮抗短肽干预模型小鼠,HE染色对肺组织进行病理细胞学分析及炎症分级,real-time PCR与Western blot实验分别检测小鼠肺组织TNF-α的mRNA和蛋白表达水平。结果: 筛选出的OVA最佳致敏浓度为500 mg/L (0.1 mL)。尾静脉注射0.2 mL不同浓度(1.5 g/L、2.5 g/L和3.5 g/L)拮抗短肽干预哮喘小鼠,能减轻哮喘小鼠肺组织炎症程度,抑制TNF-α的表达,以2.5 g/L浓度效果最佳,较模型组炎症程度减轻2级,炎症细胞数明显减少,TNF-α的mRNA表达量较模型组下降近90%,蛋白表达水平下降约70%。同时该短肽(2.5 g/L)也起到了一定的预防作用,炎症程度改善1级,TNF-α的mRNA及蛋白水平较模型组下降约50%左右。结论: CCR5第二胞外环的拮抗短肽能有效减轻哮喘小鼠肺组织炎症程度,抑制TNF-α的表达。
CC趋化因子受体5; 拮抗短肽; 哮喘; TNF-α
哮喘的本质是气道的慢性免疫性炎症,气道上皮细胞以及多种炎症细胞和细胞组分共同参与其发生及发展[1-2]。研究表明趋化因子及其受体通过对炎症细胞的募集与激活,在哮喘的发生发展中发挥重要作用,CC趋化因子受体5(CC chemokine receptor 5, CCR5)具有调控T细胞和单核细胞/巨噬细胞系的迁移、增殖与免疫功能,成为近年来哮喘发病机制和治疗的重要研究内容[3-4],TNF-α是激活CCR5启动子转录活性的关键环节,TNF-α是由激活的单核巨噬细胞分泌的Ⅱ型膜蛋白,通过与细胞膜上特异性受体结合,促进细胞生长、分化、凋亡及诱发炎症,在哮喘多种炎症细胞相互作用中发挥重要作用[5]。本研究拟探讨不同浓度的CCR5第二胞外环拮抗短肽对卵白蛋白(ovalbumin, OVA)致敏的哮喘小鼠肺组织炎症细胞的浸润和TNF-α 表达的影响,为支气管哮喘的精准治疗提供新的靶点。
材 料 和 方 法
1 材料与仪器
1.1 动物 SPF级BALB/c小鼠70只,雌性,6~8周,体重20~22 g,由中山大学医学动物实验中心提供,许可证号为IACUC-DB-15-0702。
1.2 主要试剂与仪器 CCR5第二胞外环的拮抗短肽和OVA购自Sigma;TRIzol试剂盒和real-time PCR试剂盒购自TaKaRa;引物由上海生工生物工程技术服务有限公司设计合成;TNF-α和NF-κB通路抗体购自CST。实时荧光定量PCR仪(Light Cycler 480)。
2 方法
2.1 模拟肽的合成 由中山大学孙逸仙纪念医院钟英强教授惠赠,纯度>95%,用PBS将其稀释成1.5 g/L、2.5 g/L和3.5 g/L 备用。
2.2 OVA诱导BALB/c小鼠哮喘模型的建立 参考文献方法加以改良[6-7],OVA溶液采用不同浓度(0、250、500和1 000 mg/L)加等量10%硫酸铝钾混匀,10 mol/L NaOH调pH值至6.5,室温孵育60 min,离心750×g15 min,去上清使OVA仍保持原有浓度。于实验开始时及第5天2次致敏,途径采用腹腔+皮内注射相结合,总量为每只0.1 mL,其中腹腔注射0.05 mL,皮内分3点注射0.05 mL,于第12、13和14天开始予滴鼻激发。激发前用1%戊巴比妥钠50 mg/kg腹腔麻醉,将50 μL激发液(含100 μg OVA及生理盐水)经鼻滴入,每天1次,连续3 d,利用小鼠自然呼吸将液滴吸入气道,滴完后转动小鼠体位数次以促进激发液在肺内均匀分布,缓慢分次进行。观察小鼠激发后行为表现,根据表1从呼吸频率、肺部听诊、咳嗽/喷嚏、持续时间及黏膜改变5个方面对小鼠行症状评分,根据得分对小鼠行哮喘发作程度分级:轻度2~4分;中度5~7分;重度8~10分。于实验第15天收集标本,并对肺组织炎症细胞计数及气管周围炎症分级。

表1 小鼠激发后哮喘发作评分表
2.3 应用CCR5拮抗短肽在OVA诱导的BALB/c小鼠哮喘模型进行体内实验 将70只小鼠随机分为7组:空白对照组(control组):等体积的NS代替OVA相同部位致敏、激发;哮喘致敏组(sensitization组):OVA致敏(以筛选出最适宜的OVA致敏浓度,下同),等体积的NS代替OVA激发;哮喘模型组(model组):OVA致敏、激发;预防组(prevention组):OVA致敏,第6天起通过尾静脉予2.5 g/L拮抗短肽注射液(0.2 mL),每天1次,共7 d,后激发同模型组;治疗组(peptide组):按治疗剂量的不同分3个组,第15天起予OVA诱导的小鼠哮喘模型通过尾静脉予3个梯度浓度(1.5 g/L、2.5 g/L和3.5 g/L)拮抗短肽注射液(0.2 mL),每天1次,共7 d。
2.4 收集标本与炎症分级 于实验第22天各组小鼠眼眶取全血,断颈处死后经右心室灌注,待双肺组织发白后将肺组织分离,4%多聚甲醛溶液固定,石蜡包埋,切片,HE染色后进行肺组织病理细胞学观察。先在低倍镜下随机选取10个视野,然后转200倍镜下分析。各类炎症细胞进行分类直接计数,对气管外周炎症进行分级,共6级(每张切片炎症分级=每个视野中支气管周围炎症细胞分级总数/10个视野中支气管总数,以3个淋巴细胞的厚度为1周):1级为支气管周围缺乏炎症细胞;2级为少于支气管周长25%的散在炎症细胞;3级为集中于支气管周围25%~75%周长的炎症细胞;4级为围绕支气管1周的炎症细胞浸润;5级为围绕支气管2周的炎症细胞浸润;6级为围绕支气管3周或更多的炎症细胞浸润[8],以评估气道炎症的严重程度;部分肺组织置于-80 ℃冻存。
2.5 Real-time PCR检测TNF-α的mRNA表达水平 用TRIzol法提取肺组织总RNA,以β-actin为内参照,反应条件为95 ℃ 3 min;95 ℃10 s、55 ℃ 30 s、40个循环,根据Ct值,利用2-ΔΔCt法计算基因的相对表达情况。TNF-α的上游引物为5’-CCT CTA GCC CAC GTC GTA GC-3’,下游引物为5’-AGC AAT GAC TCC AAA GTA GAC C-3’;β-actin的上游引物为5’-TGG AAT CCT GTG GCA TCC ATG AAA C-3’,下游引物为5’-TAA AAC GCA GCT CAG TAA CAG TCC CG-3’。
2.6 Western blot检测TNF-α蛋白的表达水平 用RIPA细胞裂解液收集蛋白,用BCA试剂盒将蛋白定量,加热变性后进行SDS-PAGE;电泳后将蛋白转移至PVDF膜;5%脱脂奶粉摇床上室温封闭60 min,加入相应 I 抗(使用1∶2 000的 TNF-α抗体),4 ℃孵育过夜;TBST洗脱3次后加入 II 抗室温下孵育60 min,TBST洗脱10 min、3次,用高灵敏度化学发光检测试剂盒进行化学发光反应,显影、定影,观察蛋白条带并用相关软件(Image-Pro Plus 6.0)进行图像分析。
3 统计学处理
采用SPSS 20.0统计软件进行分析,计量资料采取均数±标准差(mean±SD)表示,结果采用单因素方差分析(one-way ANOVA),组间比较采用LSD法;等级资料结果采用多组有序多分类资料的秩和检验(Kruskal-WallisH检验)。以P<0.05为差异有统计学意义。
结 果
1 筛选OVA最佳致敏浓度
500 mg/L OVA组小鼠激发后症状为中度,小鼠体重、胃纳和活动能力稳定,激发完毕后肺组织炎症细胞浸润程度适中,以嗜酸性粒细胞及淋巴细胞为主,支气管外周炎症分级为4.00±0.67,较空白对照组提高3倍左右,程度适中,故选取500 mg/L OVA (配成0.1 mL致敏液)构建小鼠哮喘模型。详见图1及表2、3。

Figure 1.The lung tissues of the mice stimulated with different concentrations of OVA observed with HE staining (×200).
图1 各致敏浓度模型小鼠肺组织的HE染色观察
表2 各致敏浓度模型小鼠激发后症状评分、程度及肺组织炎症细胞的直接计数比较
Table 2.The score and degree of asthma attacks, and direct counting of inflammatory cells in the lung tissues after sensitization by different concentrations of OVA (Mean±SD.n=10)

GroupScoreDegreeInflammatorycellsEosinophilLymphocyteNeutrophil250mg/LOVA3.00±0.82Mild248±15*76±6*88±8*70±10*500mg/LOVA6.80±0.63Moderate329±12*#106±9*#118±9*#89±11*#1000mg/LOVA9.00±0.94Severe430±10*150±8* 174±10*92±12*Control0.00±0.00-35±3 8±215±3 10±3
*P<0.05vscontrol group;#P<0.05vs1 000 mg/L OVA group.

表3 各致敏浓度模型小鼠气管外周炎症分级的比较
*P<0.05vscontrol group.
2 OVA诱导BALB/c小鼠哮喘模型的特点
以最适宜致敏浓度(500 mg/L)的OVA 0.1 mL构建哮喘小鼠模型。如图2所示,致敏组小鼠仅予致敏液致敏,镜下可见支气管周围炎症细胞呈灶性浸润,炎症细胞浸润25%~75%,尚未完全包绕气管,炎症分级较空白对照组提高2倍左右(P<0.05)。模型组小鼠激发后明显出现不同程度的头面部瘙痒,呼吸加深加快,点头呼吸,安静少动,弓背,前肢缩抬,口唇、耳、尾巴黏膜发紫,双肺闻及哮鸣音,二便失禁等哮喘急性相表现。肉眼可见肺脏体积增大,有形状不规则的暗红色充血区。镜下可见支气管及伴行血管周围大量炎症细胞浸润,以嗜酸性粒细胞和淋巴细胞为主。支气管管腔内可见黏液栓,黏膜皱壁减少,杯状细胞增生,血管平滑肌明显增生,部分肺泡间隔融合形成肺气肿。致敏组和模型组小鼠炎症分级均在3级以上,空白对照组小鼠无阳性反应,确定哮喘模型建立成功。
3 CCR5第二胞外环拮抗短肽对小鼠肺组织病理细胞学的影响
致敏组与模型组的炎症分级均明显高于空白对照组,以嗜酸性粒细胞和淋巴细胞为主,炎症分级均在3级以上(P<0.05)。在拮抗短肽的干预下,预防组及各剂量治疗组肺组织炎症细胞数及炎症分级出现不同程度减少和下降,以2.5 g/L短肽治疗组效果最为显著(P<0.05),炎症细胞总数较空白对照组减少近50%,以嗜酸性粒细胞及中性粒细胞减少最明显,减少幅度约50%,炎症分级降至2.30±0.67,较治疗前改善了2级左右。预防组肺组织炎症程度改善1级,与致敏组炎症程度相近。详见图2及表4、5。
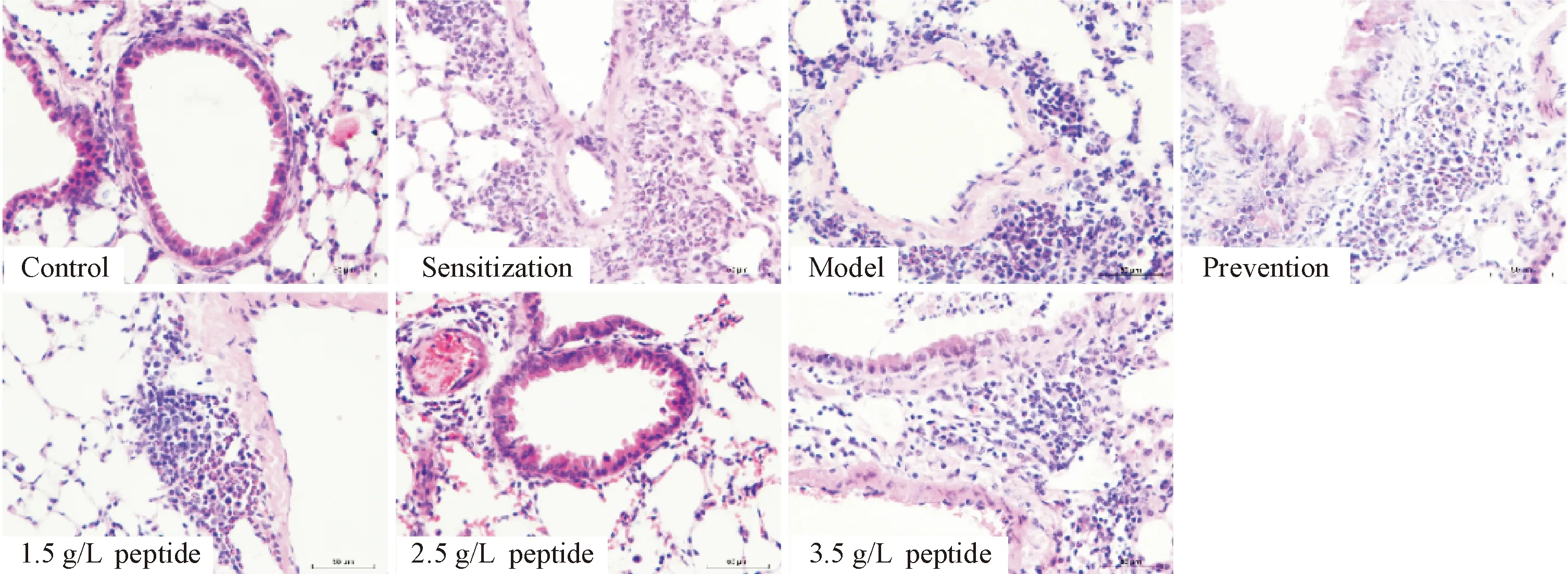
Figure 2.HE staining of lung tissue in different groups (×200).
图2 各组小鼠肺组织HE染色的观察
4 CCR5第二胞外环拮抗短肽对小鼠肺组织TNF-α mRNA表达水平的影响
相对于空白对照组,致敏组和模型组的TNF-α的mRNA相对表达量明显升高,以模型组最为明显,升高1倍左右,在拮抗短肽的干预下,预防组、1.5 g/L 短肽治疗组、2.5 g/L短肽治疗组及3.5 g/L短肽治疗组的TNF-α mRNA相对表达量相较于致敏组及模型组均有不同程度的降低,其中预防组及1.5 g/L 短肽治疗组较模型组表达量下调近50%左右,2.5 g/L短肽治疗组治疗效果最佳,TNF-α相对表达量相较于模型组下降了近90%(P<0.05)。3.5 g/L短肽治疗组经拮抗短肽干预后, TNF-α mRNA相对表达量相较于模型组下调了60%左右,见图3。

表4 各组肺组织炎症细胞直接计数的比较
*P<0.05vscontrol group;#P<0.05vsmodel group.

表5 各组小鼠气管外周炎症分级的比较
*P<0.05vscontrol group;#P<0.05vsmodel group.
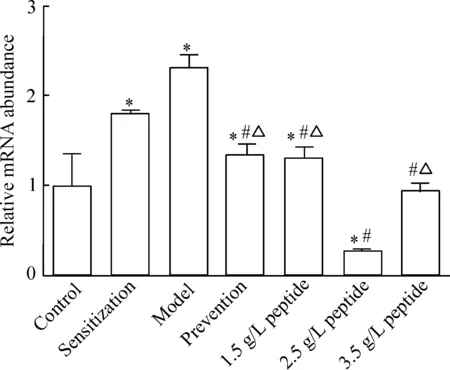
Figure 3.Comparison of the relative mRNA expression of TNF-α in the lung tissues of each group. Mean±SD.n=10.*P<0.05vscontrol group;#P<0.05vsmodel group;△P<0.05vs2.5 g/L peptide group.
图3 各组小鼠肺组织TNF-α的mRNA表达水平
5 CCR5第二胞外环拮抗短肽对小鼠肺组织TNF-α蛋白表达水平的影响
相对于空白对照组,致敏组和模型组的TNF-α蛋白相对表达量明显升高,以模型组最为明显,升高1倍余,预防组、1.5 g/L短肽治疗组、2.5 g/L短肽治疗组及3.5 g/L短肽治疗组的TNF-α蛋白相对表达量相较于致敏组及模型组均有不同程度的降低,其中预防组较模型组表达量下调近50%左右。1.5 g/L短肽治疗组较模型组表达量下调近68%,2.5 g/L短肽治疗组下调效果最佳,TNF-α蛋白相对表达量相较于模型组下降了70%左右(P<0.05),3.5 g/L短肽治疗组经拮抗短肽干预后, TNF-α相对表达量相较于模型组下调了55%左右,见图4。
讨 论
随着哮喘的基础研究不断进展,构建小鼠哮喘模型的方法已较成熟,尤其以OVA致敏的BALB/c小鼠易产生气道高反应性和高滴度的IgE[9]。为了增强免疫应答反应,本研究在致敏液配制过程中加入了氢氧化铝。Hayashi等[10]研究发现雌性小鼠迟发型反应明显强于雄性小鼠,故本实验中均选取雌性的BALB/c小鼠。激发方式上,无论滴鼻激发还是雾化激发模型的成功率均很高。Jeong等[11]通过雾化OVA溶液20 min激发的哮喘模型也具有明显的气道炎症和反应性;研究表明滴鼻激发建立的哮喘模型炎症更明显、稳定,且操作更加简单[12],故本研究采用滴鼻法激发小鼠哮喘发作模拟人类哮喘发病。以往主要是以肺组织是否存在明显的嗜酸性粒细胞浸润为标准判断造模的成功与否,没有明确的诊断标准。本研究首先采用了激发后小鼠的症状评分,同时结合肺组织炎症细胞计数及支气管周围炎症分级来确定造模是否成功以及炎症的程度,使得模型的建立更加客观与精准。

Figure 4.Comparison of the relative protein expression of TNF-α in the lung tissues of each group. Mean±SD.n=10.*P<0.05vscontrol group;#P<0.05vsmodel group;△P<0.05vs2.5 g/L peptide group.
图4 各组小鼠肺组织TNF-α蛋白表达水平
近年来研究表明CCR5在哮喘、炎症性肠病、类风湿关节炎、COPD等疾病的发生发展中起重要作用[13-14]。CCR5能够调控T细胞和单核细胞/巨噬细胞系的迁移、增殖与免疫功能,CCR5与其特异性配体RANTES、MIP-1、MIP-1b结合后,通过酪氨酸激酶信号转导,引发白细胞的趋化性、炎症因子的释放(如TNF-α、IL-6、IL-8等)及炎症反应等各种生理功能。TNF-α作为重要的促炎症因子,能刺激气道平滑肌,产生RANTES、IL-8和GM-CSF,增加ICAM-1的表达,促进炎症细胞在气道表面的黏附力,并可趋化嗜酸粒细胞释放LTs、PAF、PG等炎性介质,还可刺激其它对气道有强烈收缩作用的物质产生,如内皮素等,从而使哮喘的炎症反应更强烈,在诱导哮喘多细胞相互作用中发挥重要作用[15]。因此对CCR5及其拮抗剂的研究,为多种免疫炎症性疾病的治疗提供了新的方法[16]。Suzaki 等[17]利用TAK 799 (一种新型CCR5 和CXCR3拮抗剂)干预小鼠哮喘模型,结果发现该拮抗剂可以下调CCR5、CXCR3及Th1 型细胞因子的表达,改善肺功能、减轻气道炎症,起到防止哮喘发生、发展的作用。Lefebvre等[18]利用CCR2/CCR5拮抗剂cenicriviroc干预动物肝肾纤维化模型,结果发现cenicriviroc发挥了显著的抗炎及抗纤维化作用。
CCCR5的天然结构存在3个胞外环。在研究HIV感染人体的过程时发现,R5嗜性的HIV-1主要是通过其膜蛋白gP120与细胞表面辅助受体CCR5的N端和第二胞外环相互作用,从而介导HIV-1进入细胞内[19]。由于第一、三胞外环较短,没有明确的生物学功能,因此在本研究选取的是CCR5第二胞外环的拮抗短肽。本课题组先前应用噬菌体展示肽库技术淘选了大鼠CCR5第一、二胞外环特异性结合的活性拮抗肽,并进行了初步鉴定[20]。在本研究中,我们发现CCR5第二胞外环的拮抗短肽能有效减轻哮喘小鼠肺组织炎症程度,抑制TNF-α的表达,且具有浓度依赖性和饱和性。同时,在哮喘小鼠激发前给予一定剂量的拮抗短肽(2.5 g/L)也能够在一定程度上减轻其炎症程度及TNF-α的表达,这提示CCR5第二胞外环的拮抗短肽在小鼠哮喘模型中起到了一定的抗炎作用。传统哮喘的治疗主要以β受体激动剂及糖皮质激素为主,但因不少不良反应而在一定程度上限制其长期应用。传统的哮喘治疗药物大多是在炎症细胞进入组织后才发挥作用的,而CCR5第二胞外环拮抗短肽则是通过抑制炎症细胞进入组织起到治疗作用,在哮喘的急性期使用能有效缓解炎症程度。
综上所述,本研究首先发现了在哮喘小鼠体内应用CCR5第二胞外环的拮抗短肽能有效减轻哮喘小鼠肺组织炎症程度,抑制TNF-α的表达,证实CCR5在哮喘进程中发挥重要作用,为哮喘治疗提供了新靶点。
[1] Martinez FD, Vercelli D. Asthma [J]. Lancet, 2013, 382(9901):1360-1372.
[2] 李雯静, 黄花荣. ADAM33基因调控哮喘患儿气道重塑的机制进展[J]. 新医学, 2014, 45(10):635-639.
[3] Gluck J, Rymarczyk B, Rogala B. Chemokine receptors expression on CD3+blood cells in bronchial asthma[J]. Adv Med Sci, 2016, 61(1):7-11.
[4] 梁蓉蓉, 黄花荣. CCR5与支气管哮喘免疫学发病机制研究进展[J]. 新医学, 2016, 47(1):12-16.
[5] Lee SU, Sung MH, Ryu HW, et al. Verproside inhibits TNF-α-induced MUC5AC expression through suppression of the TNF-α/NF-κB pathway in human airway epithelial cells[J]. Cytokine, 2016, 77(1):168-175.
[6] Lloyd CM, Gonzalo JA, Coyle AJ, et al. Mouse models of allergic airway disease[J]. Adv Immunol, 2001, 77:263-295.
[7] 沈 璐, 赖克方, 姜 华, 等.不同激发方式对小鼠过敏性支气管哮喘模型的影响[J]. 中华哮喘杂志, 2009, 3(6):404-408.
[8] Cho JY, Miller M, Baek KJ, et al. Immunostimulatory DNA sequences inhibit respiratory syncytial viral load, airway inflammation, and mucus secretion[J]. J Allergy Clin Immunol, 2001, 108(5):697-702.
[9] Agrawal T, Gupta GK, Agrawal DK. Vitamin D supplementation reduces airway hyperresponsiveness and allergic airway inflammation in a murine model [J]. Clin Exp Allergy, 2013, 43(6):672-683.
[10]Hayashi T, Adachi Y, Hasegawa K, et al. Less sensitivity for late airway inflammation in males than females in BALB/c mice[J]. Scand J Immunol, 2003, 57(6):562-567.
[11]Jeong H, Rhim T, Ahn MH, et al. Proteomic analysis of differently expressed proteins in a mouse model for allergic asthma[J]. J Korean Med Sci, 2005, 20(4):579-585.
[12]程 胜, 陈辉龙, 王正云, 等. 滴鼻和雾化两种不同激发方式对小鼠支气管哮喘模型气道炎症的影响[J]. 华中科技大学学报:医学版, 2014, 18(2):121-124.
[13]Marques RE, Guabiraba R, Russo RC, et al. Targeting CCL5 in inflammation[J]. Expert Opin Ther Targets, 2013, 17(12):1439-1460.
[14]叶小研, 刘思雪, 胡 梅, 等. CCR5在炎症性肠病患者肠黏膜的表达及其与β-arrestin 2表达的关系[J]. 中国病理生理杂志, 2016, 32(4):713-718.
[15]Huang H, Nie W, Qian J, et al. Effects of TNF-α polymorphisms on asthma risk: a systematic review and meta-analysis[J]. J Investig Allergol Clin Immunol, 2014, 24(6):406-417.
[16]Boesecke C, Pett SL. Clinical studies with chemokine receptor-5 (CCR5)-inhibitors[J]. Curr Opin HIV AIDS, 2012, 7(5):459-462.
[17]Suzaki Y, Hamada K, Nomi T, et al. A small-molecule compound targeting CCR5 and CXCR3 prevents airway hyperresponsiveness and inflammation[J]. Eur Respir J, 2008, 31(4):783-789.
[18]Lefebvre E, Moyle G, Reshef R, et al. Antifibrotic effects of the dual CCR2/CCR5 antagonist cenicriviroc in animal models of liver and kidney fibrosis[J]. PLoS One, 2016, 11(6):e0158156.
[19]Hutter G, Bodor J, Ledger S, et al. CCR5 targeted cell therapy for HIV and prevention of viral escape[J]. Viruses, 2015, 7(8):4186-4203.
[20]刘思雪, 胡 梅, 叶小研, 等. 应用噬菌体展示肽库技术淘选大鼠CCR5膜外第一、二胞外环特异性结合的活性拮抗肽与初步鉴定[J]. 中国病理生理杂志, 2015, 31(7):1225-1230.
(责任编辑: 林白霜, 罗 森)
Effects of antagonistic peptide specifically binding to second extracellular loop of CCR5 on inflammatory cell infiltration and TNF-α expression in lung tissues of asthmatic mice induced by OVA
LIANG Rong-rong1, LI Wen-jing1, LIU Juan1, SHEN Xi-ming2, HUANG Hua-rong1
(1DepartmentofPediatrics,2DepartmentofPathology,SunYat-senMemorialHospitalofSunYat-senUniversity,Guangzhou510120,China.E-mail:hhrvivi@126.com)
AIM: To investigate the effects of antagonistic peptide specifically binding to the second extracellular loop of CC chemokine receptor 5 (CCR5) on inflammatory cell infiltration and TNF-α expression in lung tissues of asthmatic mice. METHODS: The asthmatic model of BALB/c mice was induced by ovalbumin (OVA) and the optimal sensitization concentration of OVA was screened. After modeling, the mice were intervened by gradual concentrations of antagonistic peptide via tail-vein injection. The pathocytological analysis and grading were performed in the lung tissues with HE staining. The expression of TNF-α at mRNA and protein levels in the lung tissues was determined by real-time PCR and Western blot. RESULTS: The optimal concentration of OVA was 500 mg/L (0.1 mL) as this concentration of OVA stably induced moderate degree of inflammation in the BALB/c mice. Treatment with different concentrations (1.5 g/L, 2.5 g/L and 3.5 g/L) of antagonistic peptide at 0.2 mL through tail-vein injection inhibited the expression of TNF-α, and markedly reduced the degree of inflammation in the lung tissues. The optimal concentration of antagonistic peptide was 2.5 g/L as the lung inflammation degree in 2.5 g/L group alleviated by 2 grades, and the number of inflammatory cells was also significantly reduced. Moreover, the mRNA expression abundance of TNF-α was nearly decreased by 90%, and the protein expression of TNF-α was decreased by 70% compared with model group. Meanwhile, the use of antagonistic peptide at 2.5 g/L before OVA stimulation confirmed the preventive function to some degree. In this group, the lung inflammation degree alleviated by 1 grade, and the expression of TNF-α at both mRNA and protein levels decreased by nearly 50%. CONCLUSION: The antagonistic peptide of CCR5 effectively inhibits the expression of TNF-α and relieves the inflammation in the asthmatic mouse lung tissues in a concentration-dependent manner.
CC chemokine receptor 5; Antagonistic peptide; Asthma; TNF-α
1000- 4718(2017)04- 0596- 07
2016- 12- 19
2017- 01- 16
广东省自然科学基金资助项目(No. 2014A030313020; No. 2015A030313027; No. 2016A03031343)
R725.6; R363
A
10.3969/j.issn.1000- 4718.2017.04.004
△通讯作者 Tel: 020-81332003; E-mail: hhrvivi@126.com
▲并列第1作者
