HIF-1α介导低氧诱导的内皮细胞Brm表达上调的机制研究*
2017-04-24王授衔陈德伟高文祥高钰琪
王授衔, 陈德伟△, 高文祥, 徐 刚, 吴 刚, 陈 建, 高钰琪△
(第三军医大学高原军事医学系 1病理生理学与高原病理学教研室, 2高原特需药品与卫生装备研究室, 3全军高原医学重点实验室,重庆 400038)
·论 著·
HIF-1α介导低氧诱导的内皮细胞Brm表达上调的机制研究*
王授衔1, 3, 陈德伟1, 3△, 高文祥1, 3, 徐 刚2, 3, 吴 刚1, 3, 陈 建2, 3, 高钰琪2, 3△
(第三军医大学高原军事医学系1病理生理学与高原病理学教研室,2高原特需药品与卫生装备研究室,3全军高原医学重点实验室,重庆 400038)
目的: 本研究拟探讨低氧诱导因子1α(HIF-1α)在低氧诱导的血管内皮细胞Brm表达上调中的作用及机制,为低氧性肺动脉高压的防治提供理论依据。方法: 在内皮细胞中过表达或siRNA干扰HIF-1α的表达,并给予1%低氧处理24 h后,运用萤光素酶报告基因检测方法检测Brm启动子的转录活性,运用RT-qPCR检测Brm的mRNA表达水平,运用Western blot检测Brm的蛋白表达水平。运用ChIP技术检测低氧条件下HIF-1α与Brm启动子区域的结合变化情况。结果: 过表达HIF-1α可显著上调Brm的启动子活性、mRNA及蛋白表达,而siRNA干扰HIF-1α可显著抑制Brm的启动子活性、mRNA及蛋白表达,ChIP实验揭示低氧可显著增强HIF-1α与Brm启动子的结合。结论: 低氧上调内皮细胞中Brm的表达依赖HIF-1α的转录调控作用。
低氧性肺动脉高压; 低氧诱导因子1α; Brm蛋白; 内皮细胞
低氧性肺动脉动脉高压(hypoxic pulmonary hypertension,HPH)是一种由于低氧引起的,以持续性肺血管收缩和肺血管结构改建为特点的,并伴有右心室进行性肥大的慢性进行性疾病。同时也是肺源性心脏病和高原心脏病发病的中心环节。肺动脉高压的直接后果是右心室肥厚、右心功能不全乃至右心衰,严重者可导致死亡。其中由高原低氧引起的肺动脉高压乃至高原心脏病是严重威胁着高原群众及高原官兵健康的慢性高原病[1]。目前对HPH发病机制认识尚不清楚,也缺乏有效的防治措施。越来越多的研究提示免疫炎症反应在HPH发生、发展中发挥重要作用[2-3]。研究发现HPH小鼠肺血管周围有大量炎症细胞浸润,肺组织中炎症因子和黏附分子表达显著增高。体外实验证实,低氧(1% O2)可直接上调内皮细胞中细胞黏附分子(cell adhesion molecules,CAMs)的转录和表达,并增强炎症细胞与内皮细胞的黏附[4-5]。这说明低氧可诱导内皮细胞中CAMs基因的转录激活,增强血管内皮细胞和循环炎症细胞的相互作用,使之在肺血管周围形成促炎微环境,从而介导或促进肺血管收缩和肺血管结构改建,这可能是HPH形成的重要机制。
Brahma (Brm)蛋白是哺乳动物染色体重构复合物switch (SWI)/sucrose nonfermentable (SNF)的核心ATP酶亚单位,也是调节核小体结构改变和基因转录的核心蛋白。它可通过水解ATP释放能量,改变核小体的结构,从而调节基因的转录[6]。前期研究发现低氧可诱导Brm表达上调,并调控内皮细胞中CAMs和内皮素1(endothelin-1,ET-1)的表达,内皮特异性干扰Brm可显著抑制低氧肺血管炎症反应、肺血管结构改建、右心室肥厚及右心室压力升高[4-5]。但低氧如何诱导Brm表达增多,其机制尚不明确。通过生物信息学分析后发现Brm的启动子区域存在低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)的结合位点。因此,本实验将在内皮细胞模型中,运用质粒过表达或siRNA干扰HIF-1α的表达,再给予低氧处理后,采用萤光素酶报告基因、RT-qPCR、Western blot及染色质免疫沉淀(chromatin immunoprecipitation, ChIP)技术等检测方法,明确HIF-1α在低氧上调内皮细胞中Brm表达中的作用及机制,为低氧性肺动脉高压的防治提供理论依据。
材 料 和 方 法
1 主要材料
胎牛血清、高糖DMEM培养基和0.25%胰蛋白酶(HyClone);RNA提取试剂盒(Omega);β-巯基乙醇(重庆川东化工集团有限公司);逆转录试剂盒和SYBR Green Real-Time PCR试剂盒(TaKaRa);青-链霉素、BCA蛋白定量试剂盒和Western blot实验 I抗稀释液(碧云天生物技术研究所);HRP标记山羊抗兔、HRP标记山羊抗小鼠和HRP标记驴抗山羊IgG 抗体(北京中杉金桥生物技术有限公司);抗Brm和HIF-1α抗体(Abcam);抗β-actin抗体(Sigma);Lipofectamine 3000转染试剂(Invitrogen);Lipofectamine RNAiMAX转染试剂(Invitrogen);Luciferase Assay System 试剂盒(Promega);Flag-HIF-1α由南京医科大学徐涌教授惠赠;pGL3-Brm(深圳百恩维生物技术有限公司);HIF-1αsiRNA(上海吉玛生物有限公司)。
2 方法
2.1 细胞培养 人脐静脉内皮细胞EA.hy926用含青霉素1×105U/L、链霉素100 mg/L和10%胎牛血清的高糖DMEM培养基常规培养,细胞置于 37 ℃、 5% CO2细胞培养箱中培养。等细胞处于对数生长期时用于实验。细胞进行低氧处理时,将接种的细胞放入接有N2和 CO2的三气培养箱中,并将O2浓度设定为 1%(5% CO2、94% N2) ,培养相应的时间后取出进行后续实验。
2.2 萤光素酶报告基因检测Brm启动子活性 转染前1 d,将对数增长期的内皮细胞接种于24孔板中,每孔1×105个细胞。倒置显微镜下观察细胞生长情况,待培养板中细胞约 80%~90% 融合时开始转染。按照Invitrogen的Lipofectamine 3000或Lipofectamine RNAiMAX转染试剂说明书进行转染,siRNA组加入60 nmol/L的HIF-1αsiRNA(5′-AGAGGUGGAUAUGUGUGGG-3′),过表达组加入0.3 μg的HIF-1α表达质粒。置于 37 ℃、 5% CO2细胞培养箱中培养6 h后更换培养基,继续培养或低氧处理后,参照Promega的Luciferase Assay System 试剂盒说明书进行萤光素酶报告基因检测启动子活性。
2.3 RT-qPCR检测Brm的mRNA表达 将EC细胞以(2~3)×108/L种于35 mm的培养皿中,过夜培养后给予转染或低氧处理,收集细胞并按照试剂盒说明书操作,提取各组的RNA,使用NanoDrop ND-100超微量分光光度计测量浓度后,按照逆转录及荧光定量PCR试剂盒说明进行逆转录和扩增,PCR反应条件为:95 ℃ 30 s;95 ℃ 5 s, 60 ℃ 30 s,循环40次。引物由Invitrogen公司合成,Brm的上游引物为5′-TGCAAGAGCGGGAATACAGACT-3′,下游引物为5′- ACCTCCTGTCTCAGCTGACGCT-3′,扩增产物长度为160 bp;HIF-1α的上游引物为5′-GGACAAGTCACCACAGGACA-3′,下游引物为5′-GGGAGAAAATC-AAGTCGTGC -3′,扩增产物长度为169 bp;β-actin的上游引物为5′-CATGGAGTC CTGTGGCATCC-3′,下游引物为5′-AATGCCAGGGTACATGGTGG-3′,扩增产物长度为124 bp。
2.4 Western blot检测Brm的蛋白表达 收集各实验组细胞,预冷PBS清洗后加入含有蛋白酶抑制剂的RIPA裂解液,冰上裂解15 min后,用细胞刮收集细胞于离心管中,12 000 r/min离心10 min后转移上清于新的离心管中,BCA法测定蛋白浓度并调整蛋白浓度一致,加入上样缓冲液95 ℃10 min。采用8%的分离胶进行SDS-PAGE分离,100 V湿转60 min,转膜后将PVDF膜置于5%脱脂奶粉中室温封闭1 h,然后置于 I 抗稀释液稀释的Brm(1∶500)、β-actin(1∶3 000)和HIF-1α(1∶1 000)抗体中4 ℃孵育过夜。TBST漂洗 10 min、3次;置于5%脱脂奶粉稀释的HRP标记 II 抗(1∶3 000)中室温孵育1 h,TBST漂洗10 min×3次,ECL化学发光法显色,使用ImageJ软件对条带进行光密度分析,计算各组蛋白相对表达量。
2.5 ChIP检测HIF-1α与Brm启动子的结合 接种内皮细胞并进行低氧处理后,终浓度1%甲醛进行交联10 min,甘氨酸解交联5 min,加入含蛋白酶抑制剂的预冷PBS,细胞刮刮取细胞于EP管中,800×g4 ℃离心5 min,弃上清,用0.5 mL含蛋白酶抑制剂的细胞裂解液重悬细胞沉淀,冰上裂解15 min。超声破碎DNA后12 000 r/min离心10 min弃沉淀。BCA法测定蛋白浓度,取300 μg蛋白于新的离心管中,加入抗HIF-1α或IgG抗体5 μg,置于4 ℃ 旋转孵育过夜。同时取1/10作为 Input。次日每管加入60 μL Protein A/G agarose/Salmon sperm DNA,4 ℃旋转孵育1 h后,离心弃上清;分别加低盐、高盐、LiCl buffer和TE buffer进行清洗,加入新鲜配制的elution buffer进行洗脱,加入20 μL 5 mol/L的NaCl 65 ℃水浴4~5 h充分解交联;采用酚/氯仿/异戊醇(25∶24∶1)及糖原沉淀法提取DNA,PCR检测DNA富集量。上游引物为5′-CACATTCTTGCACACCGCCC-3′,下游引物为5′-TCCTCCCTGCCCGTCC-3′。
3 统计学处理
数据分析运用 SPSS 18.0 统计软件。每组实验重复3次,结果用均数±标准差(mean±SD)表示,多组间差异的比较用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 低氧诱导内皮细胞Brm表达增多的变化规律及特点
RT-qPCR检测内皮细胞低氧处理12 h、24 h和48 h后Brm的mRNA表达变化,结果显示与常氧对照组相比,低氧各组Brm的mRNA表达水平显著升高,差异有统计学意义(P<0.05),且随低氧时间延长而逐渐增加,见图1A。
Western blot检测内皮细胞低氧12 h、24 h及48 h后Brm的蛋白表达的变化,结果显示与常氧对照组相比,低氧处理组Brm的蛋白表达随缺氧时间延长而逐渐增加,见图1B。
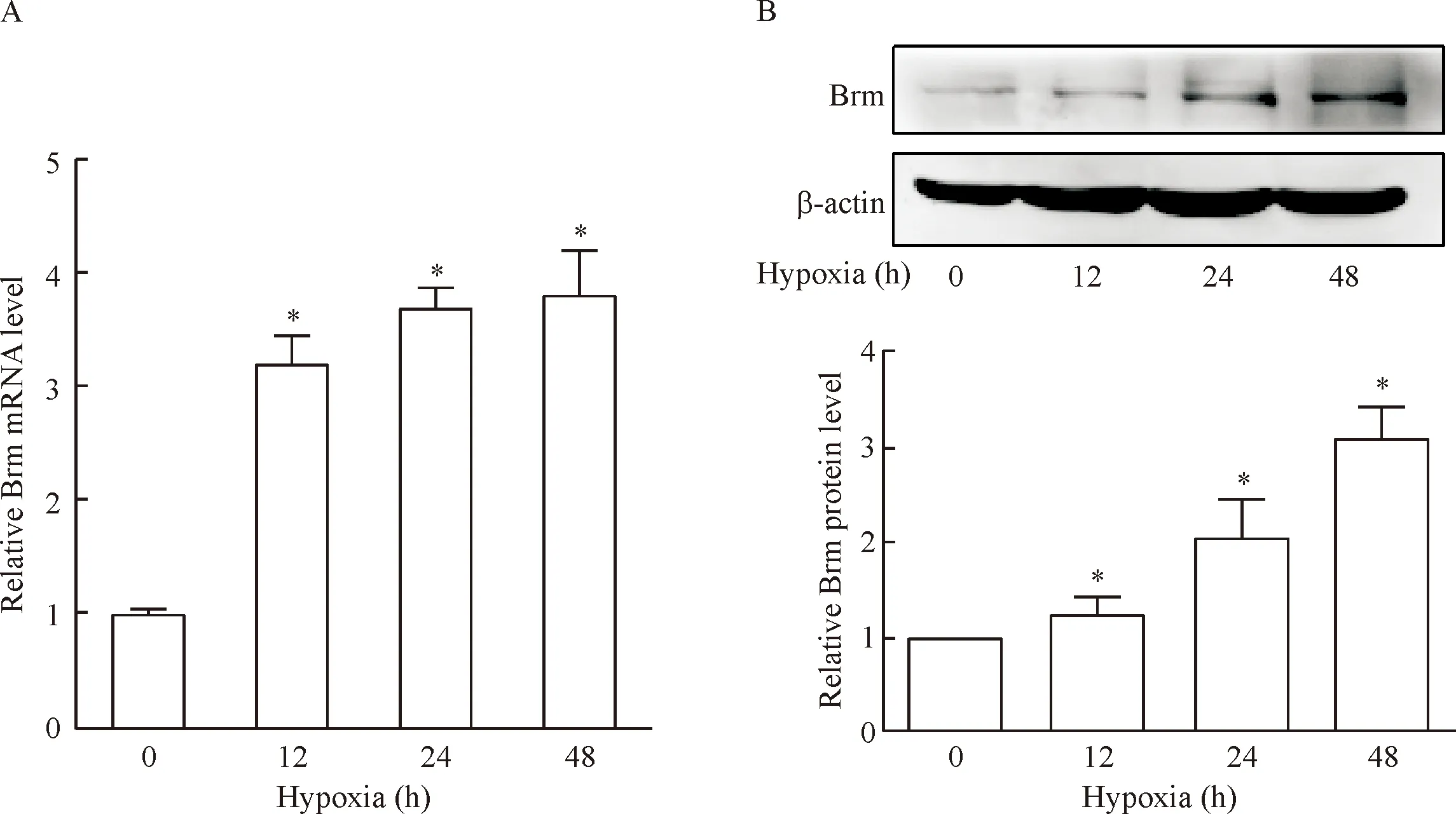
Figure 1.Hypoxia activated the expression of Brm in endothelial cells. HUVECs were exposed to 1% O2for 12, 24 and 48 h, and the mRNA (A) and protein (B) levels of Brm were detected with RT-qPCR and Western blot. Mean±SD.n=3.*P<0.05vs0 h.
图1 RT-qPCR和Western blot检测不同时点内皮细胞中Brm的mRNA及蛋白表达变化
2 HIF-1α调控Brm的转录活性
HIF-1α过表达和siRNA干扰效果的检测结果显示,siRNA干扰HIF-1α后HIF-1α的mRNA和蛋白表达均显著降低(P<0.05),见图2A。质粒转染过表达HIF-1α后HIF-1α的mRNA和蛋白表达均显著升高(P<0.05),见图2B。
萤光素酶报告基因检测低氧情况下HIF-1α对Brm启动子活性的影响,结果显示低氧24 h可显著上调Brm启动子活性,干扰HIF-1α后Brm启动子活性显著受到抑制;而过表达HIF-1α可显著上调Brm启动子活性(P<0.05),见图2C。
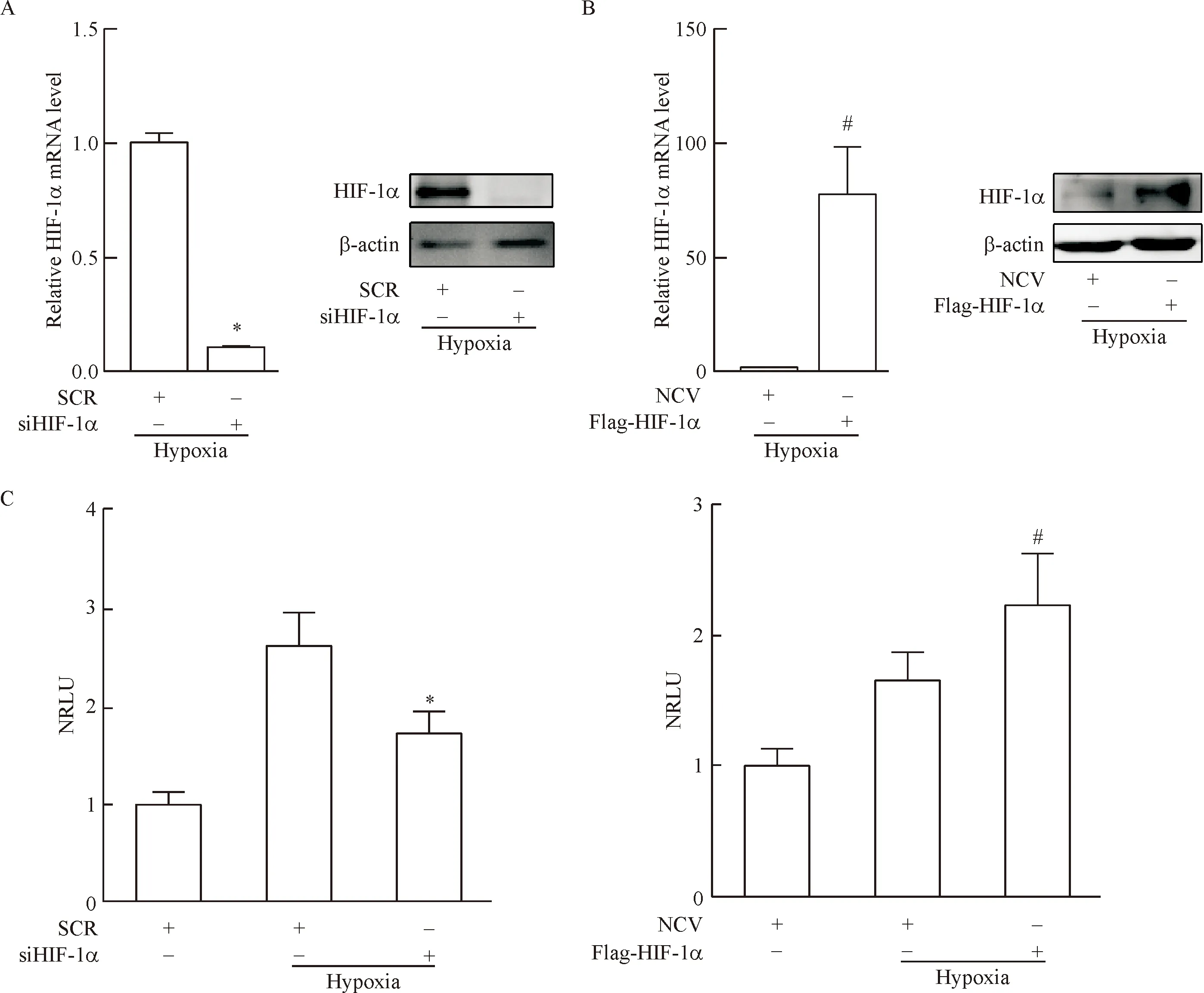
Figure 2.HIF-1α regulated hypoxia-induced Brm transcription. A: HUVECs were transfected with scrambled (SCR) or specificHIF-1αsiRNA (siHIF-1α). Cells were harvested 24 h after hypoxia (1% O2), and then the mRNA and protein levels of HIF-1α were measured by RT-qPCR and Western blot. B: HUVECs were transfected with negative control vector (NCV) or expression construct for HIF-1α (Flag-HIF-1α) and then exposed to 1% O2for 24 h. The mRNA and protein levels of HIF-1α were measured by RT-qPCR and Western blot. C: theBrmpromoter construct was transfected into HUVECs with specific siRNA or indicated expression constructs and then exposed to 21% or 1% O2for 24 h. Luciferase activity was expressed as normalized relative luciferase unit (NRLU). Mean±SD.n=3.*P<0.05vsSCR+hypoxia;#P<0.05vsNCV+hypo-xia.
图2HIF-1α的过表达及干扰效果检测,以及萤光素酶报告基因检测HIF-1α对Brm启动子活性的影响
3 HIF-1α调控Brm的mRNA及蛋白表达
RT-qPCR的结果显示,低氧24 h可显著上调Brm的mRNA表达,干扰HIF-1α后Brm的mRNA表达显著降低(P<0.05),而过表达HIF-1α后Brm的mRNA表达显著升高(P<0.05)。Western blot实验结果显示,低氧24 h可显著上调Brm的蛋白表达,干扰HIF-1α后Brm的蛋白表达显著降低(P<0.05),而过表达HIF-1α后Brm的蛋白表达显著升高(P<0.05),见图3。
4 低氧促进HIF-1α与Brm启动子结合
ChIP检测低氧条件下HIF-1α与Brm启动子结合变化,结果显示与常氧对照组相比,低氧24 h可显著增加HIF-1α与Brm启动子的结合,具有统计学差异(P<0.05),见图4。
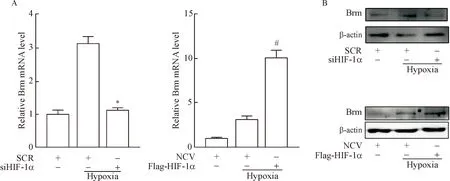
Figure 3.HIF-1α regulated hypoxia-induced Brm mRNA (A) and protein (B) expression. Mean±SD.n=3.*P<0.05vsSCR+hypoxia;#P<0.05vsNCV+hypoxia.
图3 RT-qPCR及Western blot检测HIF-1α对Brm表达的影响

Figure 4.HIF-1α was recruited to the Brm promoter under hypoxia. HUVECs was exposed to 21% or 1% O2for 24 h and harvested. ChIP assays were performed with indicated antibodies. Mean±SD.*P<0.05vsnormoxia.
图4 CHIP检测低氧条件下HIF-1α与Brm启动子结合变化
讨 论
研究表明,炎症免疫反应在HPH形成中发挥了重要作用,染色质重构蛋白Brg1和Brm参与了低氧肺血管炎症反应及肺血管重构[7]。Brg1与Brm结构极其相似,约74%的序列是相同的,功能上也类似,且有一定的互补作用,都可通过水解ATP释放能量来改变核小体的结构,从而调控基因的转录[8-10]。本课题组前期研究发现,Brg1与Brm在低氧应激反应及HPH形成中具有相似的作用和功能。因此,本实验中着重关注了低氧诱导Brm上调的调控机制,在Brg1的转录调控中也可能存在类似的机制。
HIF-1α在调节细胞低氧应激反应中发挥着至关重要的作用[1, 11]。面对低氧刺激,细胞会发生一系列低氧应激反应,尤其是在转录水平做出的快速特异性反应,来调节氧供给与利用之间的不平衡,使细胞适应低氧刺激。而这些应激反应绝大多数是通过的HIF-1α来介导的。低氧条件下,HIF-1α与HIF-1β形成二聚体进入细胞核内与靶基因启动子上的低氧反应元件(hypoxia response elements,HRE)结合来发挥转录调控作用,从而参与一系列的细胞低氧应激反应。而在常氧条件下,HIF-1α在脯氨酸羟化酶(proline hydroxylase,PHD)的作用下被羟基化,进而被VHL E3泛素连接酶辨识并泛素化,之后透过蛋白酶体使其被快速降解,所以,在常氧条件下很难检测到HIF-1α的表达。因此,本研究中检测HIF-1α的过表达和干扰效率时都是在低氧条件下检测的。
Brm和Brg1在维持胚胎发育过程中的血管平衡,促进应激相关疾病的发生过程中都发挥着重要作用[12],也参与调节细胞的增殖分化、迁移、DNA损伤修复以及DNA 甲基化修饰等[13]。HIF-1α 也可以招募 Brg1 和 Brm 到其下游靶基因上参与细胞低氧反应[11]。低氧条件下,Brg1和Brm可以在转录水平上调促红细胞生成素(erythropoietin,EPO)的表达,从而促进 EPO 分泌来增加红细胞[14]。同时,本课题组在人脐静脉内皮细胞低氧模型中发现Brm在转录水平(mRNA)和翻译水平(蛋白)的表达都随低氧(1%)时间的延长而逐渐增加。进一步研究发现,HIF-1α也可直接调控Brm的转录和表达。提示我们Brm既是HIF-1α的靶基因,也参与调控HIF-1α的其它靶基因,形成了一个调控网络。
本研究在明确低氧可显著上调内皮细胞中Brm的表达,且Brm在低氧肺血管炎症反应及HPH形成中发挥重要作用后,进一步去探讨低氧诱导内皮细胞中Brm上调的具体分子机制。首先,使用生物信息学预测发现Brm启动子上存在HRE,进一步采用质粒过表达和siRNA干扰HIF-1α的表达后,分别在转录和翻译水平检测了Brm的启动子活性、mRNA及蛋白表达变化。实验结果显示,在低氧处理下,内皮细胞中Brm的启动子活性、mRNA及蛋白表达较常氧时显著增加,过表达HIF-1α后Brm启动子活性、mRNA及蛋白表达进一步增加,而干扰HIF-1α后,Brm启动子活性、mRNA及蛋白表达显著降低。这提示HIF-1α作为转录因子可能直接参与了Brm的转录调控。为了进一步明确低氧条件下HIF-1α是否通过直接结合到Brm启动子区域的HRE来转录激活Brm的表达。通过ChIP实验,我们明确了低氧条件下HIF-1α与Brm启动子的结合显著增多。上述实验结果都有力地证明了低氧条件下,HIF-1α与Brm之间的直接转录调节关系,而作为结构功能相似的染色体重构蛋白Brg1在低氧下是否也存在相似转录调节机制,以及Brg1和Brm是否参与调控HIF-1α的转录和表达,还有待我们进一步实验发现与验证。
综上所述,本研究首次明确了低氧诱导Brm表达上调的分子机制,低氧条件下,内皮细胞中的HIF-1α可直接结合到Brm启动子上,参加调控Brm的转录和表达。
[1] 高钰琪. 高原军事医学 [M]. 重庆: 重庆出版社, 2004:54-74.
[2] Pugliese SC, Poth JM, Fini MA, et al. The role of inflammation in hypoxic pulmonary hypertension: from cellular mechanisms to clinical phenotypes[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 308(3):L229-L252.
[3] Price LC, Wort SJ, Perros F, et al. Inflammation in pulmonary arterial hypertension[J]. Chest, 2012, 141(1):210-221.
[4] Chen D, Fang F, Yang Y, et al. Brahma-related gene 1 (Brg1) epigenetically regulates CAM activation during hypoxic pulmonary hypertension[J]. Cardiovas Res, 2013, 100(3):363-373.
[5] Fang F, Chen D, Yu L, et al. Proinflammatory stimuli engage Brahma related gene 1 and Brahma in endothelial injury[J]. Circ Res, 2013, 113(8):986-996.
[6] Kadam S, Emerson BM. Transcriptional specificity of human SWI/SNF BRG1 and BRM chromatin remodeling complexes[J]. Mol Cell, 2003, 11(2):377-389.
[7] Burke DL, Frid MG, Kunrath CL, et al. Sustained hypo-xia promotes the development of a pulmonary artery-speci-fic chronic inflammatory microenvironment[J]. Am J Physiol Lung Cell Mol Physiol, 2009, 297(2):L238-L250.
[8] Reyes JC, Barra J, Muchardt C, et al. Altered control of cellular proliferation in the absence of mammalian brahma (SNF2α)[J]. EMBO J, 1998, 17(23):6979-6991.
[9] Kadoch C, Crabtree GR. Mammalian SWI/SNF chromatin remodeling complexes and cancer: mechanistic insights gained from human genomics[J]. Sci Adv, 2015, 1(5):e1500447.
[10]Schnitzler G, Sif S, Kingston RE. Human SWI/SNF interconverts a nucleosome between its base state and a stable remodeled state[J]. Cell, 1998, 94(1):17-27.
[11]Sena JA, Wang L, Hu CJ. BRG1 and BRM chromatin-remodeling complexes regulate the hypoxia response by ac-ting as coactivators for a subset of hypoxia-inducible transcription factor target genes[J]. Mol Cell Biol, 2013, 33(19):3849-3863.
[12]Takeuchi JK, Lou X, Alexander JM, et al. Chromatin remodelling complex dosage modulates transcription factor function in heart development[J]. Nat Commun, 2011, 2:187.
[13]Dykhuizen EC, Hargreaves DC, Miller EL, et al. BAF complexes facilitate decatenation of DNA by topoisomerase IIα[J]. Nature, 2013, 497(7451):624-627.
[14]Wang F, Zhang R, Beischlag TV, et al. Roles of Brahma and Brahma/SWI2-related gene 1 in hypoxic induction of the erythropoietin gene[J]. J Biol Chem, 2004, 279(45):46733-46741.
(责任编辑: 陈妙玲, 罗 森)
HIF-1α mediates hypoxia-induced Brm transactivation in endothelial cells
WANG Shou-xian1, 3, CHEN De-wei1, 3, GAO Wen-xiang1, 3, XU Gang2, 3, WU Gang1, 3, CHEN Jian2, 3, GAO Yu-qi2, 3
(1DepartmentofPathophysiologyandHighAltitudePathology,2InstituteofMedicineandHygienicEquipmentforHighAltitudeRegion,3KeyLaboratoryofHighAltitudeMedicineofPLA,CollegeofHighAltitudeMilitaryMedicine,ThirdMilitaryMedicalUniversity,Chongqing400038,China.E-mail:gaoy66@yahoo.com;cdw528913@163.com)
AIM: To clarify the molecular mechanism of Brm activation in endothelial cells during hypoxia and hypoxic pulmonary hypertension. METHODS: Hypoxia-inducible factor 1 alpha (HIF-1α) was over-expressed or depleted in the endothelial cells under hypoxia. Luciferase activity was assayed after transfection using a luciferase reporter assay system. The expression of Brm at mRNA and protein levels was detected by RT-qPCR and Western blot. The occupancy of HIF-1α onBrmpromoter was detected by the method of chromatin immunoprecipitation (ChIP). RESULTS: Brm expression was induced in cultured endothelial cells challenged with hypoxia. Over-expression ofHIF-1αenhanced, while the depletion ofHIF-1αattenuated Brm transactivation and expression under hypoxia. The results of ChIP revealed that hypoxia up-regulated the occupancy of HIF-1α onBrmpromoter. CONCLUSION: HIF-1α, which is induced by hypoxia, binds toBrmpromoter, and further promotes Brm transactivation in endothelial cells.
Hypoxic pulmonary hypertension; Hypoxia-inducible factor 1 alpha; Brm protein; Endothelial cells
1000- 4718(2017)04- 0577- 06
2016- 10- 18
2017- 01- 06
国家自然科学基金资助项目(No. 81501626); 军队重大项目(No. AWS14C007);国家科技部“973”项目(No. 2012CB518201)
R392.12
A
10.3969/j.issn.1000- 4718.2017.04.001
△通讯作者 高钰琪 Tel: 023-68752399; E-mail: gaoy66@yahoo.com; 陈德伟 Tel: 023-68752392; E-mail: cdw528913@163.com
