血栓内微泡联合尿激酶介导的超声溶栓体外实验
2017-04-24高顺记郭梦娇
朱 琼,高顺记,郭梦娇,高 原,刘 政*,谢 峰
(1.第三军医大学新桥医院超声科,重庆 400037;2.内布拉斯加大学医学中心心内科,内布拉斯加 奥马哈 68198)
·基础与实验研究·
血栓内微泡联合尿激酶介导的超声溶栓体外实验
朱 琼1,高顺记1,郭梦娇1,高 原1,刘 政1*,谢 峰2
(1.第三军医大学新桥医院超声科,重庆 400037;2.内布拉斯加大学医学中心心内科,内布拉斯加 奥马哈 68198)
目的 探讨血栓内微泡联合尿激酶介导的超声溶栓对体外血栓的溶解效果。方法 取牛全血制作血栓样本50个,随机平均分为5组后于带有侧支循环的体外循环装置中进行处理。实验1组为超声微泡尿激酶组,实验2组为超声微泡组,实验3组为超声尿激酶组,实验4组为单纯尿激酶组,实验5组为无处理组。计算并比较各组的溶栓率。并进行HE染色及免疫荧光组织学观察。结果 实验1组溶栓率为(73.64±14.16)%,实验2组为(47.97±11.66)%,实验3组为(57.33±8.65)%,实验4组为(50.85±9.63)%,实验5组为(29.76±18.06)%。其中实验1组溶栓率高于其余各组,差异均有统计学意义(P均<0.05);该组HE染色组织学检查可见明显多灶状血栓溶解,边缘可见血栓崩裂,免疫荧光可见纤维蛋白网断裂。结论 血栓内微泡联合尿激酶介导的超声溶栓在体外实验中可提高血栓的溶解率。
血栓形成;微泡;超声学;溶栓
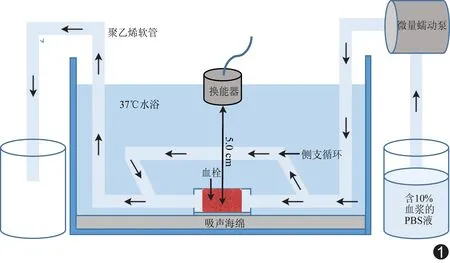
图1 体外溶栓实验循环装置示意图
经静脉溶栓是血栓的经典治疗方法,但溶栓时间窗短[1],且溶栓效率不理想[2-4]。微泡介导的超声溶栓技术是一种溶栓新方法[4-6],其主要机制是微泡降低空化阈值,增加超声空化强度,从而增强超声溶栓效果[5,7-8]。但由于临床多数为梗阻性血栓,经静脉注射微泡无法进入血栓内部,仅接触梗阻性血栓两端,造成血栓内部的溶栓效应不足,不利于超声溶栓。本课题组前期设计了血栓内微泡介导的超声溶栓(intraclot microbubble mediated ultrasound thrombolysis, IMUT)方法,即经导管向血栓内注射尿激酶和微泡,使微泡和尿激酶同时聚集在血栓内部,从而提高体外超声溶栓的效果[9]。但IMUT法存在不足:①循环装置无侧支循环,不能将血栓模型做成梗阻性;②循环液为单纯磷酸盐缓冲液(phosphate buffered saline, PBS),缺乏纤溶酶原,尿激酶无法充分发挥溶栓作用。本研究采用更符合生理状态的梗阻性血栓模型联合带有侧支循环的实验装置,并在循环液中加入血浆以补充纤溶酶原,进行IMUT溶栓实验,评价溶栓效果。
1 材料与方法
1.1实验材料
1.1.1血栓制备 取抗凝牛全血(郑州九龙生物制品有限公司)50份,每份1 ml,至预先加入5%氯化钙溶液(33 μl)的平底EP管(内径0.9 cm)中,于37℃恒温水浴锅中温育3 h后取出,以PBS冲洗3次,滤纸吸干后保存备用。
1.1.2体外循环装置组装 体外循环装置由KY-100E/TH15微量蠕动泵(重庆杰恒蠕动泵有限公司)和自制模拟体循环的管道组成,循环液为含10%牛冰冻血浆(郑州九龙生物制品有限公司)的PBS液,流速为5 ml/min。血栓放置处两端有管道以模拟侧支循环,血栓底部放置厚度为2 cm的吸声海绵。整个循环装置置于37℃恒温水浴锅中,见图1。
1.2实验方法 采用Excel随机数字法将前期制备的50个血栓样本随机分为5组,每组10个样本:实验1组(超声微泡尿激酶组)、实验2组(超声微泡组)、实验3组(超声尿激酶组)、实验4组(单纯尿激酶组)、实验5组(无处理组)。
对实验1组采用带侧孔的乙醇注射针(日本八光医疗)向血栓内注入稀释后的自制微泡(全氟丙烷脂质微泡“脂氟显”)0.02 ml(相当于0.9×107~1.7×107MB)和尿激酶0.1 ml(2万U)[10],对实验2组以同样方法注射0.02 ml微泡,对实验3组和实验4组注射0.1 ml尿激酶,对实验5组不做处理。以滤纸吸干血栓表面后以YP3102型电子天平(上海光正医疗仪器有限公司)称量血栓的初始质量(W0),而后植入循环管道内备用。根据分组情况,对实验1~3组采用SL-10型超声空化治疗仪(深圳市威尔德医疗电子有限公司),在距离血栓正上方5 cm处给予超声辐照,超声频率2 MHz,声压708 kPa,工作占空比5%,辐照时间10 min。对实验4组和实验5组不予超声辐照。
处理10 min后,取出血栓,以PBS冲洗3次后用滤纸吸干表面液体,再次应用电子天平称量溶栓后血栓质量(W1)。而后根据公式计算血栓溶栓率,溶栓率=(W0-W1)/W0×100%。
将血栓置于4%多聚甲醛中固定,制做石蜡切片,并进行HE染色和免疫荧光观察。于Leica TCS SP5荧光显微镜下观察处理后各组血栓中细胞及纤维分布情况。于Olympus BX63激光共聚焦显微镜下观察牛纤维蛋白原抗体(北京博奥森生物技术有限公司)标记的纤维蛋白骨架结构。

表1 各组溶栓前后血栓质量和溶栓率
2 结果
2.1溶栓率 处理前各组血栓质量W0差异无统计学意义(χ2=4.16,P=0.39)。实验1组溶栓率为(73.64±14.16)%,实验2组为(47.97±11.66)%,实验3组为(57.33±8.65)%,实验4组为(50.85±9.63)%,实验5组为(29.76±18.06)%。各组溶栓率差异有统计学意义(F=19.23,P<0.01),且实验1组与其余各组间差异均有统计学意义(P均<0.05),实验2组与实验3组间、实验5组与其余各组间溶栓率差异亦有统计学意义(P均<0.05),实验2组与实验4组间、实验3组与实验4组间溶栓率差异无统计学意义(P均>0.05)。见表1。
2.2组织学表现
2.2.1HE染色 实验1组较其余各组血栓内红细胞分布更稀疏,血栓内可见较多岛状溶解灶,其内未见红细胞,且血栓边缘可见多处血栓裂解。实验3组可见
少量的溶解灶,其余各组血栓仍较致密,未见明显血栓溶解区。见图2。
2.2.2免疫荧光 实验1组中网状结构疏松,大量纤维蛋白网断裂,仅见少量绿色荧光标记的纤维蛋白,绿色荧光强度弱,表明大量纤维蛋白溶解。其余各组纤维蛋白结构仍较致密,无明显断裂溶解区域。见图3。
3 讨论
经血管介入的导管溶栓方法是临床常用的介入溶栓方法,广泛应用于下肢深静脉血栓[11]、冠状动脉血栓[12]和脑血栓的治疗[8]。该方法将溶栓药直接注射入血栓的同时,也为超声微泡注入血栓内部提供通道,从而解决超声溶栓治疗中微泡无法进入梗阻性血栓内部的局限性。本课题组在前期研究中采用单通道闭合循环装置,如采用梗阻血栓模型则可能因循环压力不断增高而导致爆管或冲走血栓[9-10],因而只能选择非梗阻性血栓以防止循环液压力过高;此外,前期研究中循环液为单纯PBS,使尿激酶激活纤溶酶原形成纤溶酶的反应中的底物纤溶酶原较少,可能未充分发挥尿激酶在溶栓过程中的作用[13]。
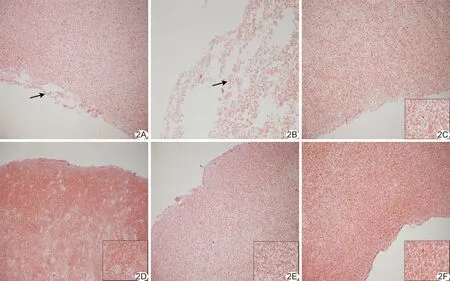
图2 血栓体外实验HE染色组织学表现 A、B.实验1组,200倍(A)及400倍(B)镜下血栓内见大量腔隙样血栓溶解,边缘血栓崩解(箭); C.实验2组,200倍镜下血栓内未见明显溶解; D.实验3组,200倍镜下可见少量灶状溶解; E.实验4组,200倍镜下未见明显溶解灶; F.实验5组,200倍镜下未见明显溶解灶,血栓结构较其余各组均更致密 (右下方图像为400倍镜下图像)

图3 血栓体外实验免疫荧光组织学表现 A、B.实验1组,800万倍(A)及1 600万倍(B)镜下纤维蛋白网结构最疏松,可见大量岛状无纤维蛋白结构区域,荧光强度较弱; C.实验2组,800万倍镜下未见明显纤维蛋白网断裂,荧光强度较强; D.实验3组,800万倍镜下可见部分纤维蛋白网断裂,荧光强度较弱; E.实验4组,800万倍镜下未见明显纤维蛋白网断裂,荧光强度较强; F.实验5组,800万倍镜下未见明显纤维蛋白网断裂,荧光强度较强 (绿色代表荧光标记的纤维蛋白;蓝色代表红细胞)
本实验的循环装置新增加了侧支循环,模拟在体血栓发生后开放的侧支循环,降低了血流对血栓的冲击,可更好地模拟临床梗阻性血栓,也更符合在体溶栓时的生理情况;同时,本实验将循环液更换为含有10%血浆的PBS液,提高了循环液中的纤溶酶原含量,进而在尿激酶催化作用下,可有更多的纤溶酶原转化为纤溶酶,从而有望加速纤维蛋白的降解,加快血栓溶解。本研究采用前期实验优化后的超声辐照参数,即声压708 kPa,占空比大于2%[10]。该参数下的能量低,输出功率为0.75 W/cm2,接近诊断超声能量水平。
本实验结果显示,实验1组的溶栓率高达 (73.64±14.16)%,明显高于其余各组(P均<0.05);且HE染色和免疫荧光组织学检查结果也与溶栓率结果相符,实验1组HE染色可见大量不规则岛状血栓溶解灶,血栓边缘崩解明显,免疫荧光见少量绿色荧光蛋白,表明尿激酶在超声和微泡的作用下使大量纤维蛋白结构降解。本研究结果提示超声辐照联合微泡对尿激酶溶栓具有增强作用,超声辐照、微泡、尿激酶3个治疗因素的联合,较任意2个因素或单因素产生的溶栓作用更大。
尽管本课题组前期研究[10]采用声压708 kPa和占空比10%的超声参数实施超声联合微泡和尿激酶溶栓,其占空比(即超声能量发射密度)较本实验高一倍(本实验占空比为5%),其溶栓率仅为46.19%,而本实验中实验1组的溶栓率却高达(73.64±14.16)%。本实验中不利于溶栓率提高的因素有两个方面:①循环装置增设了侧支循环,血流对血栓的直接冲击力较无侧支循环时减小;②选用血栓为梗阻性血栓,与前期研究中所用的不完全梗阻性血栓[10]相比,其与循环液的接触面积更小。而最终本研究可获得较高的溶栓率,这主要得益于在循环液中加入血浆,增加了纤溶酶原,使尿激酶的作用发挥更充分。但由于本实验采用抗凝牛血制备血栓,而本课题组的前期研究[10]采用健康志愿者血液制备血栓,溶栓率不同是否是由于动物源性血栓和人源性血栓成分和结构不同所致,有待进一步验证。
总之,本实验改进了循环装置和循环液成分,结果表明血栓内微泡联合尿激酶介导的超声溶栓可有效提高溶栓率,获得较好的溶栓效果。本研究为IMUT技术的临床应用提供了理论依据。基于本实验结果,笔者设想,借助临床常用的导管,将微泡注入血栓内部,同时体外给予超声辐照,实现体内的IMUT,是否有望提高溶栓效率,从而实现血管的快速再通,今后本课题组将进一步在在体实验基础上进行临床试验加以验证。
[1] Emberson J, Lees KR, Lyden P, et al. Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: A meta-analysis of individual patient data from randomized trials. Lancet,2014,384(9958):1929-1935.
[2] Rha JH, Saver JL. The impact of recanalization on ischemic stroke outcome: A meta-analysis. Stroke, 2007,38(3):967-973.
[3] 急性ST段抬高心肌梗死溶栓治疗中国专家共识组.急性ST段抬高心肌梗死溶栓治疗的中国专家共识(修订版).中华内科杂志,2008,47(2):170-174.
[4] Alexandrov AV,Molina CA, Grotta JC, et al. Ultrasound-enhanced systemic thrombolysis for acute stroke. N Engl J Med, 2004,351(21):2170-2178.
[5] Schellinger PD, Molina CA. Sonothrombolysis: Current status. Perspective in Medicine, 2012,1:11-13.
[6] Siegel RJ, Luo H. Ultrasound thrombolysis. Ultrasonics, 2008,48(4):312-320.
[7] Hwang JH, Brayman AA, Reidy MA, et al. Vascular effects induced by combined 1-MHz ultrasound and microbubble contrast agent treatments in vivo. Ultrasound Med Biol, 2005,31(4):553-564.
[8] Chen X, Leeman JE, Wang J, et al. New insights into mechanisms of sonothrombolysis using ultra-high speed imaging. Ultrasound Med Biol, 2014,40(1):258-262.
[9] 郭梦娇,高顺记,屠娟,等.经导管注射微泡介导的体外超声溶栓实验.中国介入影像与治疗学,2015,12(3):23-27.
[10] 高原,郭梦娇,高文宏,等.不同声学参数对血栓内微泡介导的超声辅助溶栓效果的影响.中国医学影像技术,2016,31(12):1783-1786.
[11] 中华医学会放射学分会介入学组.下肢深静脉血栓形成介入治疗规范的专家共识.介入放射学杂志,2011,45(7):293-296.
[12] Miao Z, Jiang L, Wu H, et al. Randomized controlled trial of symptomatic middle cerebral artery stenosis: Endovascular versus medical therapy in a Chinese population. Stroke, 2012,43(12):3284-3290.
[13] 杨正浩,周晓红,朱俊铭.溶血栓药物的发展概况.中国生物制品学杂志,2015,28(8):875-879.
Intraclot microbubble combined with urokinase mediated ultrasound thrombolysis: Experiment in vitro
ZHUQiong1,GAOShunji1,GUOMengjiao1,GAOYuan1,LIUZheng1*,XIEFeng2
(1.DepartmentofUltrasound,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China; 2.CardiologySectionofInternalMedicine,MedicalCenterofNebraskaUniversity,Omaha68198,USA)
Objective To investigate the efficiency of intraclot microbubbles (MB) combined with urokinase (UK) mediated ultrasound (US) thrombolysis. Methods Fifty clots prepared by bovine whole blood were equally divided into 5 groups and were treated in a circulation system with collateral circulation tube. The clots were treated by US, MB and UK in group 1, by US and MB in group 2, by US and UK in group 3 and by UK in group 4. The group 5 was the control group without any treatment. The thrombolysis rate of each group was measured and compared. Residual clots were histologically observed with hematoxylin-eosin staining and immunofluorescence. Results The thrombolysis rate of group 1 ([73.64±14.16]%) was significantly higher than group 2 ([47.97±11.66]%), group 3 ([57.33±8.65]%), group 4 ([50.85±9.63]%), and group 5 ([29.76±18.06]%, allP<0.05). Histological examination of the clots in group 1 showed multiple thrombolysis foci with clots collapse, and the degradation of fibrin network was further confirmed by immunofluorescence. Conclusion The intraclot MB mediated US thrombolysis combined with UK can enhance the rate of thrombolysis in vitro experiment.
Thrombosis; Microbubbles; Ultrasonics; Thrombolysis
国家自然科学基金科学仪器专项(82227004)。
朱琼(1990—),女,重庆人,在读硕士。研究方向:超声空化溶栓治疗。E-mail: zhuzhu9056@sina.com
刘政,第三军医大学新桥医院超声科,400037。E-mail: liuzhengs@163.com
2016-11-30
2017-03-01
R445.1; R-332
A
1672-8475(2017)04-0242-05
10.13929/j.1672-8475.201611037
