大鼠成骨细胞微小RNAs的筛选研究
2017-04-21曾思良梁兴伦嵇承栋周文博周文锐朱敏洁
潘 欣,曾思良,梁兴伦,嵇承栋,周文博,周文锐,李 琛,朱敏洁,沈 琪
·基础研究·
大鼠成骨细胞微小RNAs的筛选研究
潘 欣,曾思良,梁兴伦,嵇承栋,周文博,周文锐,李 琛,朱敏洁,沈 琪
目的 应用微小RNAs(microRNAs,miRNAs)芯片技术筛选补肾方含药血清干预大鼠成骨细胞后差异表达的miRNAs,与前期获得的软骨细胞差异miRNAs比较,筛选出共有差异miRNAs,以探讨补肾方通过共有miRNAs调控靶基因表达发挥治疗效应的机制。方法 原代培养的大鼠成骨细胞经碱性磷酸酶染色、Ⅰ型胶原免疫荧光染色和矿化结节染色鉴定后,用补肾方含药血清干预成骨细胞,在给定时间点收获细胞,抽提纯化总RNAs行miRNAs芯片检测,并挑选差异表达4倍以上的miRNAs行实时荧光定量逆转录-聚合酶链反应验证。结果 所培养的原代细胞具有典型的成骨细胞形态和功能,碱性磷酸酶染色、Ⅰ型胶原免疫荧光染色和矿化结节染色均为阳性。与补肾方含药血清干预成骨细胞1 d相比,干预6 d的共有229个2倍以上表达差异的miRNAs,其中上调的52个、下调的177个。差异表达4倍以上的miRNAs实时荧光定量逆转录-聚合酶链反应结果与芯片数据一致。与前期软骨细胞差异miRNAs芯片数据比较,miRNAs均上调2倍以上的有8个、下调4倍以上的2个。结论 补肾方含药血清干预成骨细胞获得了一套较为特异的miRNAs,初步预测上调的miRNAs可能通过靶向Runx2、Wnt、Notch、Axin2等基因在骨发育、骨形态发生、骨吸收以及软骨内成骨形成等相关的信号通路中发挥作用。
补肾方;成骨细胞;微小RNAs芯片;差异表达;大鼠
骨质疏松症(osteoporosis,OP)是一种进展性、长病程、世界性流行病。补肾填精法是中医治疗OP的基本治则[1]。目前各种用于治疗OP的补肾中药剂中均配制了富含植物性雌激素的中药淫羊藿等,这些方剂及其有效成分在治疗OP作用机制方面的研究已从多方面展开,调控骨形成和吸收重要的转录因子有Runx2/Cbfα1和Osx/SP7;在细胞分子信号通路水平研究较多的有Wnt/β-catenin信号转导通路、Axin2/β-catenin信号转导通路、β-catenin OPG信号转导通路、FoxO1-Runx2信号通路、BMP-Smad-Runx2信号通路、JAK/STAT信号通路、Notch信号通路、RANK-OPG-RANKL信号通路、MAPK信号通路、TGF-β信号通路,以及这些通路激活后引起相关基因的表达、抑制,进而影响成骨细胞的骨形成与破骨细胞的骨吸收功能之间的再平衡等。这些研究对认识补肾方药剂对OP病理变化的影响,以及如何对抗OP的这些变化、改善骨矿密度、重塑骨质量(骨微结构、骨转换、骨矿化和骨微损伤等)提供了重要资料。然而,由于OP发病机制的复杂性,仍有许多重要问题尚待阐明。
微小RNAs(microRNAs,miRNAs)是一类小分子内源性单链非编码RNAs(18~24个核苷酸),它通过与靶信使RNAs 3′-端非翻译区完全或不完全的互补结合,快速促进靶信使RNAs降解或抑制转录后基因的表达,进而在细胞演化、增殖、分化、癌变及凋亡等多种细胞进程中发挥重要作用[2]。目前已知[3]可触发骨形成的功能性miRNAs主要有miR-196a、miR-210、miR-22、miR-309、miR-379、miR-764-5b、miR-2861、miR-29;抑制骨形成的功能性miRNAs主要有miR-125b、miR-206、miR-100、miR-138、miR-141、miR-637和miR-93。为进一步探讨补肾方对成骨细胞的作用机制,本研究采用miRNAs芯片技术了解用补肾方含药血清处理大鼠成骨细胞后miRNAs的表达变化,为OP治疗中的补肾方干预策略提供miRNAs调控靶标。
1 材料与方法
1.1 材料
1.1.1 实验动物 8周龄雌性 Sprague-Dawley (SD)清洁级大鼠20只(第二军医大学动物实验中心提供,SCXK(沪)2012-0003),体重200~250 g,按啮齿类动物标准饲料饲养于第二军医大学动物实验中心清洁级鼠房,分笼饲养。
1.1.2 含药血清制备 补肾方剂由熟地黄、菟丝子、牛膝、龟板胶、鹿角胶、山药、山茱萸、枸杞子、淫羊藿和女贞子药物组成,补肾方组中药煎制与灌胃方法依本项目已建立的方法执行[4]。对照组以等剂量注射用0.9%NaCl溶液灌胃。补肾方含药血清经0.2μm滤器过滤,置-80℃冰箱保存备用。
1.2 方法
1.2.1 大鼠成骨细胞培养 1~5日龄SD大鼠乳鼠20只(第二军医大学动物实验中心提供,SCXK(沪) 2012-0003),不计体重、不分雌雄,在A2级生物安全柜内用70%乙醇消毒皮肤表面,断头处死;无菌条件下分离取出颅盖骨,用弯头镊子背面轻刮骨面去除软组织和骨膜,用磷酸盐缓冲液(phosphate-buffered saline,PBS)反复清洗后,将分离出的整个颅盖骨浸入1 mL 0.25%胰酶中37℃消化30min,以去除颅盖骨表面的组织细胞;用PBS清洗2次后,将颅盖骨浸入1 mL 2mg/mL的Ⅰ型胶原酶中,剪碎成粉末状,混匀,37℃消化2 h,期间手动摇匀以消化充分。1 500 r/ min离心10min使细胞沉淀,用PBS洗1次去除Ⅰ型胶原酶,以α-最低必需培养液培养重悬细胞,过100 μm细胞滤网去除骨碎片。将细胞悬液用含10%胎牛血清、100 U/mL青霉素、100 mg/L链霉素的α-最低必需培养液培养于含5%CO2饱和湿度的37℃的培养箱内。24 h后换液,以后每2 d换液1次。8 d后行苏木精-伊红(hematoxylin-eosin,HE)染色。
1.2.2 成骨细胞鉴定
1.2.2.1 碱性磷酸酶细胞化学染色 取24孔板培养的同批次原代细胞,培养10 d,用4%多聚甲醛室温固定10min,蒸馏水清洗2次,用美国Vector Laboratories公司的VECTOR蓝色碱性磷酸酶底物(blue alkaline phosphatase substrate)试剂盒染色,即在5 mL 100mmol/L Tris-HCl(pH 8.2)缓冲液中加80μL试剂1、80μL试剂2和45μL试剂3成为新鲜配制的染色液,每孔加入1mL混匀的染色液,37℃避光染色15 min。蒸馏水清洗5次,24孔板内保留少量水,镜检。
1.2.2.2 Ⅰ型胶原免疫荧光染色 将无菌盖玻片置于6孔板内,接种同批次原代细胞,培养4 d制备成细胞爬片。PBS洗涤后用4%多聚甲醛室温固定10min,PBS洗涤后用含0.5%Triton X-100的PBS透化30min。PBS洗后用美国Thermo公司的Image-iTTMFX信号增强剂封闭30 min。用PBS按1∶500稀释Ⅰ型胶原兔抗大鼠一抗浸没爬片,置4℃过夜,室温复温2 h后PBS洗涤。用PBS按1∶1 000稀释键合了Alexa Fluor 594的羊抗兔二抗(美国Thermo公司)浸没爬片,室温孵育1 h,PBS洗涤干燥后,用含4’,6-二脒基-2-苯基吲哚的抗褪色金牌介质在载玻片上装片,指甲油封片,镜检。
1.2.2.3 茜素红钙沉积染色 取24孔板培养的同批次原代细胞,培养21 d,95%乙醇室温固定 10 min,蒸馏水清洗3次,每孔加入1 mL含1%茜素红的0.05mol/L Tris-HCl(pH 4.2)染液染色3min,蒸馏水清洗5次,24孔板内保留少量水,镜检。
1.2.3 miRNAs芯片分析 成骨细胞分别用补肾方含药血清(补肾方组)或0.9%NaCl溶液灌胃血清(对照组)干预,总RNAs抽提、质检、芯片杂交与数据采集分析参照本项目已建立的方法执行[4]。
miRNAs表达的聚类分析采用每组芯片平均值归一化后的数据,用Cluster 3.0软件的非监督聚类分析方法将补肾方含药血清处理成骨细胞1 d或6 d的样本放在一起聚类分析。
1.2.4 miRNAs表达的验证 从上调或下调4倍以上差异表达的miRNAs中各挑选1个应用实时荧光定量逆转录-聚合酶链反应(reverse transcriptase-polymerase chain reaction,RT-PCR)进行验证(上调的选择rno-miR-205,下调的选择rno-miR-335),U6小核RNAs设为内参基因,反应条件参照本项目已建立的方法执行[4]。rno-miR-205的上游引物为:5′-ACGA TCCTTCATTCCACCGG-3′,下游引物为:5′-GTGCA GGGTCCGAGGT-3′,逆转录引物为:5′-GTCGTATCC AGTGCAGGGTCCGAGGTATTCGCACTGGATACGACA CAGACT-3′。rno-miR-335的上游引物为:5′-ACGATC AAGAGCAATAACGA-3′,下游引物为:5′-GTGCAGGG TCCGAGGT-3′,逆转录引物为:5′-GTCGTATCCAGTG CAGGGTCCGAGGTATTCGCACTGGATACGACACATT TT-3′。U6的上游引物为:5′-GCTTCGGCAGCACATA TACTAAAAT-3′,下游引物为:5′-CGCTTCACGAATT TGCGTGTCAT-3′,逆转录引物为:5′-CGCTTCACGAA TTTGCGTGTCAT-3′。
根据miRNAs芯片分析结果,分别用rno-miR-205和rno-miR-335的逆转录引物和上、下游引物检测2种miRNAs在补肾方或0.9%NaCl溶液灌胃血清处理成骨细胞1 d或6 d总RNAs样品中的转录表达情况。
1.3 统计学处理 应用SAS 4.0软件,计量资料以均值±标准差(¯x±s)表示,2组比较采用配对t检验,P<0.05为差异有统计学意义。
2 结果

图1 大鼠原代成骨细胞性状鉴定
2.1 大鼠原代成骨细胞性状鉴定 大鼠成骨细胞24 h贴壁后呈多形性,有较多突起(图1A)。HE染色显示细胞核内有1~2个核仁(图1B)。碱性磷酸酶染色可见细胞呈现深蓝色(图1C);Ⅰ型胶原免疫荧光法染色可见胞质中呈现红色,为强阳性反应(图1D);茜素红染色可见胞内沉积钙与茜素红反应,得到红染阳性结果,可见矿化结节形成(图1E)。
2.2 miRNAs芯片分析 补肾方含药血清或0.9% NaCl溶液灌胃血清处理成骨细胞1 d和6 d的miRNAs分别杂交3张芯片,图2A显示补肾方含药血清处理成骨细胞1 d的3张芯片(蓝色实心点)之间重复样本数据的均一性较好,与补肾方含药血清处理成骨细胞6 d(红色实心点、均一性好)芯片数据之间差异较大。而0.9%NaCl溶液灌胃血清处理成骨细胞1 d的3张芯片(蓝色空心点、均一性好)与处理6 d (红色空心点、均一性好)之间差异较小。
补肾方含药血清处理成骨细胞1 d和6 d两样本间的相关性分析见图2B,相关系数r为0.986 1 (P<0.000 1),距离X=Y这条直线较远的散点较多,分散程度大。0.9%NaCl溶液灌胃血清处理成骨细胞1 d和6 d两样本间的相关性分析见图2C,相关系数r为0.971 6(P<0.000 1),距离X=Y这条直线较远的散点较少,分散程度小。
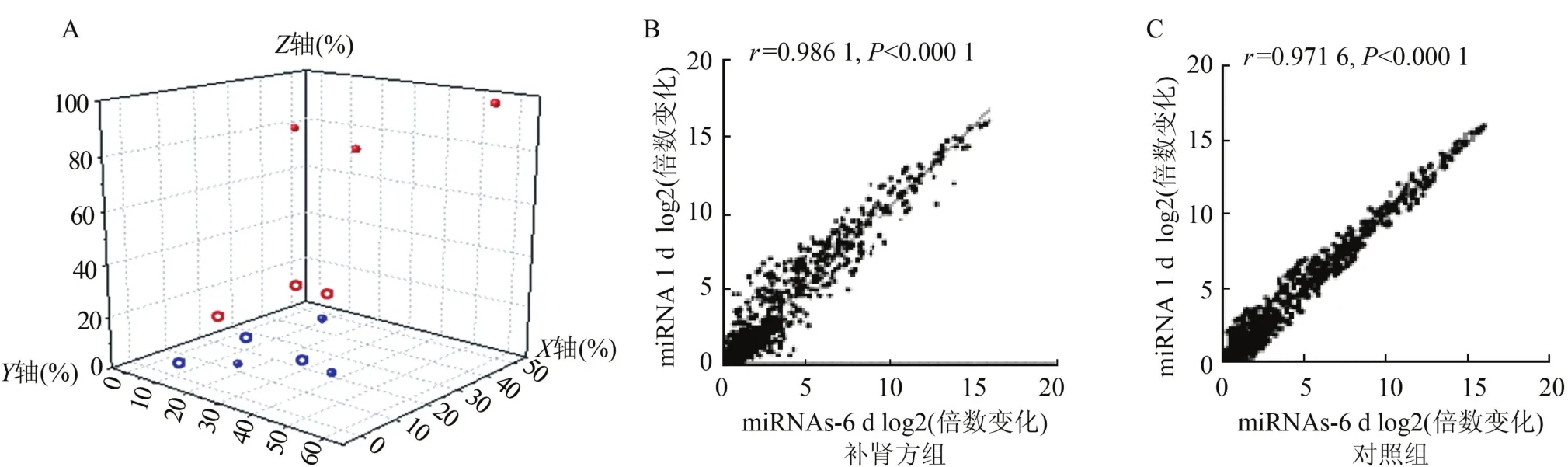
图2 含药血清处理成骨细胞miRNAs表达谱数据分析
聚类分析得到存在差异性表达的miRNAs见图3。

图3 miRNAs芯片数据的聚类分析
根据上调或下调2倍以上、P<0.05的标准,得到52个上调miRNAs(rno-miR-1224、rno-miR-124-1、rno-miR-124-2、rno-miR-124-3、rno-miR-133c、rno-miR-150、rno-miR-181c-5p、rno-miR-183-3p、rno-miR-195-3p、rno-miR-195-5p、rno-miR-200b-3p、rno-miR-204-3p、rnomiR-205、rno-miR-223-3p、rno-miR-224-3p、rno-miR-291a-3p、rno-miR-297、rno-miR-3065-3p、rno-miR-3085、rno-miR-323-5p、rno-miR-328a、rno-miR-338-5p、rno-miR-339、rnomiR-343、rno-miR-347、rno-miR-3473、rno-miR-351-3p、rno-miR-3569、rno-miR-3573-3p、rno-miR-3574、rno-miR-3584-5p、rno-miR-365-5p、rno-miR-378a-3p、rno-miR-378a-5p、rno-miR-378b、rno-miR-465-5p、rno-miR-466d、rnomiR-490-5p、rno-miR-497-5p、rno-miR-544、rno-miR-6215、rno-miR-6315、rno-miR-6318、rno-miR-6328、rno-miR-6332、rno-miR-6334、rno-miR-652-5p、rnomiR-665、rno-miR-678、rno-miR-760-5p、rno-miR-874-3p、rno-miR-92a-2)和177个下调miRNAs,其中上调4倍以上的有7个(表1)、下调4倍以上的有67个(表2)。

表1 大鼠miRNAs芯片表达上调4倍以上的miRNAs
2.3 定量RT-PCR验证 将补肾方组数据与对照组相应数据比较后,图4示rno-miR-205在补肾方含药血清处理成骨细胞6 d中的转录表达是1 d的11.03倍(t=12.90,P=0.001);rno-miR-335在补肾方含药血清处理成骨细胞6 d中的转录表达是1 d的0.028倍(t=370.3,P<0.000 1),与miRNAs芯片差异变化趋势基本吻合。

表2 大鼠miRNAs芯片表达下调4倍以上的miRNAs

图4 定量RT-PCR验证补肾方含药血清处理成骨细胞miRNAs的差异表达
3 讨论
中医药学在防治OP方面历史悠久,同时对OP伴发的慢性疼痛、心悸失眠、抑郁、不良情绪、新陈代谢紊乱等一系列临床综合征的治疗均有一定疗效。补肾填精法是中医治疗OP的基本治则。在中医“川肾藏精,主骨生髓”理论指导下,根据“血瘀”“肾虚”证候,上海同济大学附属杨浦医院老年科在原有专利药“治疗老年OP的纯中药配方及其免煎颗粒剂”[5]基础上采用熟地黄、菟丝子、牛膝、龟板胶、鹿角胶、山药、山茱萸、枸杞子、淫羊藿和女贞子10味药配伍研制成补肾方中药汤剂在改善中老年OP方面取得了较好的疗效。为进一步探讨补肾方对OP治疗的作用机制,本研究用补肾方含药血清干预原代培养的成骨细胞,通过miRNAs芯片分析筛选出差异表达的miRNAs,以期通过预测miRNAs作用的靶基因及其参与的信号通路调节来理解补肾方通过miRNAs调控靶基因的表达进而发挥治病效应。
成骨细胞来源于骨髓间充质干细胞,是骨形成细胞,成熟的成骨细胞会合成分泌大量Ⅰ型胶原、非胶原蛋白、酶和生长因子等骨基质主要成分,骨基质随后逐渐矿化[6]。体外成骨细胞对骨组织的生长发育、骨代谢平衡、骨量平衡和损伤修复起关键作用,是骨组织中机械应力的主要效应细胞[7]。本研究在不剪碎乳鼠颅盖骨的情况下,先用胰酶消化去除骨表面纤维组织及骨髓组织,再于Ⅰ型胶原酶消化液中剪碎消化,简洁快速地获得了大量成骨细胞。通过碱性磷酸酶染色、Ⅰ型胶原免疫染色和钙结节形成实验对获得的原代细胞进行了成骨细胞特性的阳性鉴定。本研究用补肾方或注射用0.9%NaCl溶液以临床等效剂量给予8周龄雌性大鼠灌胃,制备含药大鼠血清,进而用以干预成骨细胞。图2A提示实验设计较为合理,图2B提示补肾方组两样本间mi-RNAs表达差异数量较多,而图2C提示对照组两样本间miRNAs表达差异数量较少。抽提干预后成骨细胞总RNAs,经miRNAs芯片筛选,获得2倍以上表达变化的miRNAs共计229个,其中上调的52个、下调的177个。分别从上调或下调4倍以上的miRNAs中各选1个行实时荧光定量RT-PCR验证,提示芯片数据结果可信。
本研究中的miRNAs芯片中52个2倍以上上调表达,这些上调表达的miRNAs与引言中提到的可触发骨形成的miRNAs不同,可能是本研究所用补肾方所特别激发的。通过搜索已知miRNAs靶基因数据库发现,其中 rno-miR-205、rno-miR-3584-5p可靶向Runx2(成骨细胞的特异转录因子[8]);rno-miR-195-5p、rno-miR-221-5p、rno-miR-328a-5p、rno-miR-378a-3p、rno-miR-497-5p和 rno-miR-3584-5p可靶向 Wnt (可抑制间充质干细胞向脂肪细胞分化、增加碱性磷酸酶表达、促进成骨形成[9]);rno-miR-497-5p可靶向Axin2(骨形成负向调节因子[10]);rno-miR-221-5p可靶向Notch(负向调节成骨分化[11])。由于1种miRNAs可以调控多种基因,1条基因也可以受多种miRNAs的调控,目前预测的miRNAs靶向基因可能发挥的作用还需要进一步实验以验证靶基因的表达情况,阐明miRNAs调控的具体方式。
将成骨细胞与软骨细胞miRNAs差异表达芯片相比较,可见rno-miR-195-5p是2类芯片中均呈现4倍以上上调的miRNAs,rno-miR-133a-3p和rno-miR-206-3p是均呈现4倍以上下调的miRNAs。此外,rnomiR-181c-5p、rno-miR-347、rno-miR-3569、rno-miR-3584-5p、rno-miR-378b、rno-miR-465-5p、rno-miR-6315均呈现2倍以上上调的miRNAs。
rno-miR-195-5p可靶向细胞周期蛋白依赖激酶8[12]、细胞周期素3[13]、血管内皮细胞生长因子[14],其过表达可表现其抑制肿瘤细胞的增殖、侵袭和转移的抑癌功能和降低微血管密度的作用,骨形态形成蛋白2也是其靶基因之一[15]。rno-miR-195-5p是否还可以靶向其他与骨形成相关的靶基因,以及它在调控骨形成中的作用,还有待进一步探索。
下一步工作将对这些具有表达共性的miRNAs逐一开展其正负向干预对靶基因表达的影响研究,以验证补肾方通过干预miRNAs调节靶基因表达发挥治疗效应的可能性。
[1]Tang DZ,Hou W,Zhou Q,et al.Osthole stimulates osteoblast differentiation and bone formation by activation of beta-catenin-BMP signaling[J].JBone Miner Res,2010,25(6):1234-1245.
[2]Park JH,Shin C.MicroRNA-directed cleavage of targets: mechanism and experimental approaches[J].BMB Rep,2014,47(8):417-423.
[3]Zhao X,Xu D,Li Y,et al.MicroRNAs regulate bone metabolism[J].JBone Miner Metab,2014,32(3):221-231.
[4]潘欣,梁兴伦,曾思良,等.补肾方含药血清干预大鼠椎间盘软骨细胞miRNA的差异表达[J].上海中医药杂志,2016,50(1):71-76.
[5]梁兴伦.治疗老年骨质疏松症的纯中药配方及其免煎颗粒剂[P].ZL201010103204X.http://epub.sipo.gov.cn/ gjcx.jsp.
[6]Zhao H.Membrane trafficking in osteoblasts and osteoclasts:new avenues for understanding and treating skeletal diseases[J].Traffic,2012,13(10):1307-1314.
[7]Lama A,Santoro A,Corrado B,et al.Extracorporeal shock waves alone or combined with raloxifene promote bone formation and suppress resorption in ovariectomized rats[J]. PLoSOne,2017,12(2):e0171276.
[8]Lim KE,Park NR,Che X,et al.Core binding factorβof osteoblastsmaintains corticalbonemass via stabilization of Runx2 in mice[J].J Bone Miner Res,2015,30(10): 1943.
[9]Jiang T,Zhou B,Huang L,et al.Andrographolide exerts pro-osteogenic effect by activation of Wnt/β-catenin signaling pathway in vitro[J].Cell Physiol Biochem,2015,6 (6):2327-2339.
[10]McGee-Lawrence ME,Li X,Bledsoe KL,et al.Runx2 protein represses Axin2 expression in osteoblasts and is required for craniosynostosis in Axin2-deficientmice[J].J Biol Chem,2013,88(8):5291-5302.
[11]Yang GC,Xu YH,Chen HX,et al.Acute lymphoblastic leukemia cells inhibit the differentiation of bone mesenchymal stem cells into osteoblasts in vitro by activating Notch signaling[J].Stem Cells Int,2015,2015:162410.
[12]Luo Q,Zhang Z,Dai Z,et al.Tumor-suppressive micro RNA-195-5p regulates cell growth and inhibits cell cycle by targeting cyclin dependent kinase 8 in colon cancer [J].Am JTransl Res,2016,8(5):2088-2096.
[13]Zhang QQ,Xu H,Huang MB,et al.MicroRNA-195 plays a tumor-suppressor role in human glioblastoma cells by targeting signaling pathways involved in cellular proliferation and invasion[J].Neuro Oncol,2012,14(3):278-287.
[14]Sandrim VC,Dias MC,Bovolato AL,et al.Plasma from pre-eclamptic patients induces the expression of the antiangiogenicmiR-195-5p in endothelial cells[J].JCell Mol Med,2016,20(6):1198-1200.
[15]Grünhagen J,Bhushan R,Degenkolbe E,et al.MiR-497~195 cluster microRNAs regulate osteoblast differentiation by targeting BMP signaling[J].JBone Miner Res,2015,30(5):796-808.
Identification of differentially expressed m iRNAs in rat osteoblasts
PAN Xin1,ZENG Siliang2,LIANG Xinglun3,JIChengdong4,ZHOUWenbo5,ZHOUWenrui3,LIChen3,ZHU Minjie3,SHEN Qi3
(1.Central Laboratory,Yangpu Hospital,School of Medicine,Tongji University,Shanghai200090,China;2.Department of Rehabilitation Therapy,Tianhua College,Shanghai Normal University,Shanghai 201815,China;3.Department of Geriatrics,Yangpu Hospital,School of Medicine,Tongji University,Shanghai 200090,China;4.Department of Scientific Research Management,Yangpu Hospital,School of Medicine,Tongji University,Shanghai200090,China;5.Department of General Surgery,Yangpu Hospital,School of Medicine,Tongji University,Shanghai200090,China)
ObjectiveThe purpose of this study is to identify the microRNAs(miRNAs) differential expression profile related to sensitivity for Bushen decoction-medicated serum of ratosteoblast cells bymiRNAs array technique,and screen a set of commonmiRNAs to compare with ealier miRNAs array data of rat intervertebral disc chondrocytes for further study their regulation target genesmechanism.M ethodsThe primary rat osteoblasts were identified by alkaline phosphatase staining,collagen typeⅠimmunofluorescent staining and mineralized nodules staining.The osteoblastswere cultured in serum containing Bushen decoction or normal saline.The total RNAs were isolated and purified and recruited formiRNAs array analysis.The selected putative regulated miRNAs were validated by real-time fluorescent quantitation reverse transcriptase-polymerase chain reaction (RT-PCR).ResultsThe twice-enzyme digestion method was practicable to obtain a large number of purified primary rat osteoblastswith typical osteoblasts characteristics.Alkaline phosphatase stai-ning and collagen typeⅠimmunofluorescent staining andmineralized nodules stainingwere positive. By significance analysis ofmicroarrays(SAM)based on microarray screening,229 different expression ofmiRNAs(52 up-regulated and 177 down-regulated more than twice)were found in serum cultured 6 d.Quantitative RT-PCR further validated that the expression levels of rno-miR-205 over 4-fold up-regulated and rno-miR-335 over 4-fold down-regulated significantly in the cultured 6 d compared to the cultured 1 d.There were 8 common miRNAs up-regulated more than twice both in miRNAs array data of rat osteoblast cells and intervertebral disc chondrocytes and 2 commonmiRNAs down-regulated more than 4-fold.ConclusionA set of specific miRNAs obtained after Bushen decoction containing serum intervention on rat osteoblast cells.Target gene prediction software predict the up-regulated miRNAs mainly by regulating bone development,bone morphogenesis,bone resorption and endochondral bone morphogenesis through the target genes,such as Runx2,Wnt,Notch,and Axin2,et al.
Bushen decoction;Osteoblast;MicroRNAs array;Differential expression;Rat
R342.2;R349.5-332
A
2095-3097(2017)02-0068-06
10.3969/j.issn.2095-3097.2017.02.002
2017-01-21 本文编辑:徐海琴)
国家重点基础研究发展计划(2013CB531601);国家自然科学基金面上项目(30972633,81173312);上海市卫生和计划生育委员会科研项目(201640253);同济大学附属杨浦医院学科带头人攀登计划(YE2201608)
200090上海,同济大学附属杨浦医院中心实验室(潘 欣);201815上海,上海师范大学天华学院康复治疗系(曾思良);200090上海,同济大学附属杨浦医院老年科(梁兴伦,周文锐,李 琛,朱敏洁,沈 琪),科研部(嵇承栋),普外科(周文博)
潘 欣,E-mail:xinpanpx@163.com;梁兴伦,E-mail:liangxinglun@sina.com
