血清胱抑素C、超敏C反应蛋白和β2-微球蛋白水平变化对诊断妊娠高血压的临床意义
2017-04-20乔晓亮
乔晓亮
(郑州市妇幼保健院检验科,河南郑州450000)
血清胱抑素C、超敏C反应蛋白和β2-微球蛋白水平变化对诊断妊娠高血压的临床意义
乔晓亮
(郑州市妇幼保健院检验科,河南郑州450000)
目的探讨血清胱抑素C(CysC)、超敏C反应蛋白(hs-CRP)和β2-微球蛋白(β2-MG)水平变化对妊娠期高血压(HDP)患者早期诊断的临床意义。方法选取80例娠期高血压疾病患者为研究对象,其中轻度妊娠期高血压30例,中度妊娠期高血压25例,重度妊娠期高血压25例,选取同期正常妊娠孕妇40例作为对照组,检测各组血清CysC、hs-CRP和β2-MG水平,并对结果进行分析。结果妊娠期高血压疾病患者血清CysC、hs-CRP和β2-MG均高于对照组,差异具有统计学意义(P<0.05);重度患者血清CysC、hs-CRP和β2-MG均高于中度和轻度患者,中度高于轻度患者,差异均具有统计学意义(P<0.05);Person相关性分析表明,妊娠期高血压患者血清CysC与hs-CRP及β2-MG存在明显正相关(r=0.542,r=0.607,P<0.05).结论妊娠期高血压疾病患者血清CysC、hs-CRP和β2-MG明显升高,是其早期诊断的敏感指标,并随着患者疾病进展程度的加重而增高。
妊娠期高血压;血清胱抑素C;超敏C反应蛋白;β2-微球蛋白
妊娠高血压疾病(Hypertensive disorder complicatingpregnancy,HDP)是一种在妊娠期特发常见并发症之一,严重威胁围产期母婴生命安全,是孕产妇和胎儿的发病率和死亡率升高的重要原因[1],可累及全身多个组织和器官,造成不同程度的缺血性终末器官的损害,引起流产、早产、甚至死胎[2]。因此对HDP早期诊断和治疗具有重要的临床意义。本研究主要探讨CysC、hs-CRP、β2-MG水平变化对妊娠期高血压患者诊断的临床意义。
1 资料与方法
1.1一般资料选取2015年2月至2016年2月至本院妇产科产前检查和分娩的80例HDP患者为研究对象,其中轻度妊娠期高血压30例,中度25例,重度25例,孕妇年龄22~37岁,(平均27.2± 4.9),孕周27~38周,平均(33.5±3.7)周,参选标准根据乐杰主编《妇产科学》第7版中的妊娠高血压疾病诊断确定入组标准[3];同期选择正常妊娠孕妇40例作为对照组,年龄22~37岁,(平均27.2±4.9),孕周27~38周,平均(33.5±3.7)周,所有入选对象均无糖尿病,肾脏疾病、慢性高血压或有症状的传染性疾病,并且各组在年龄、孕周等方面无显著差异,具有可比性(P>0.05)。
1.2方法各组于空腹抽取静脉血3~5ml,采用日立7600全自动生化仪检测各组血清CysC和β2- MG,同时血清hs-CRP采用贝克曼库尔特IMMAGE 800特定蛋白仪进行分析,所有试剂均采用日立和贝克曼公司原装试剂,同时质控在控。
1.3参考范围CysC正常参考区间为0.56~1.20mg/L,β2-MG 1.0~3.0mg/L,hs-CRP:≤3.0mg/ L,测定结果大于正常参考区间上限即为阳性。
1.4统计学方法实验数据以均数±标准差表示,采用SPSS 19.0统计学软件分析。计量资料以均数±标准差(x±s)表示,采用t检验,计数资料采用χ2检验,组间分析采用方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1各组血清CysC、hs-CRP、β2-MG水平变化及分析妊娠期高血压疾病患者血清CysC、hs-CRP和β2-MG均高于对照组,差异具有统计学意义(P<0.05);重度患者血清CysC、hs-CRP和β2-MG均高于中度和轻度患者,中度高于轻度患者,差异均具有统计学意义(P<0.05),见表1。
2.2妊娠期高血压各组血清CysC、hs-CRP、β2-MG相关性分析Person分析表明,妊娠期高血压患者血清CysC与hs-CRP存在明显正相关(r=0.542,P<0.05),血清CysC水平与血清β2-MG水平呈明显正相关(r=0.607,P<0.05)。
3 讨论
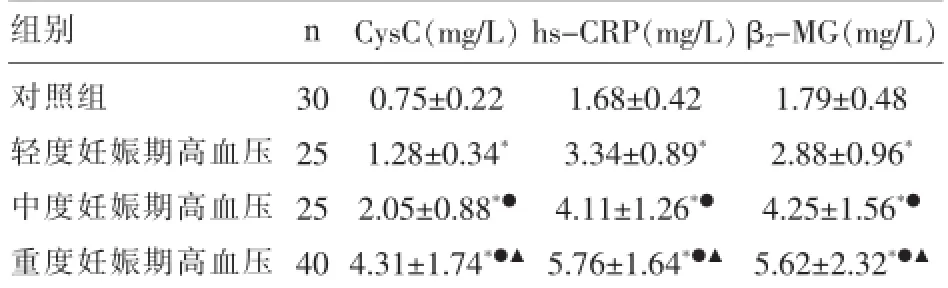
表1 各组血清Cys C、hs-CRP、β2-MG水平变化及分析
妊娠期高血压疾病是一种以妊娠中晚期高血压、水肿、蛋白尿以及全身各系统脏器灌流减少及全身小血管痉挛为主要病理特征的严重疾病[4],可造成肾功能不同程度的改变,严重影响母婴安全。对妊娠期高血压患者早期进行诊断,对疾病的控制和围产期母婴的安全具有重要的临床意义。
迄今为止,妊娠高血压的发病病因及发病机制尚未完全明了,而肾脏损害是妊娠高血压比较常见也是极为危险的病理改变[5]。妊娠期妇女为了满足胎儿的生长发育需求,自身组织和脏器常会受到如缺氧和缺血等因素的影响损伤。妊娠高血压很容易对肾脏造成损伤,可造成肾小动脉痉挛、微血栓栓塞肾小血管,肾脏血液灌注不足,导致肾功能障碍[6],若未及时有效处理,极有可能发展为急性肾功能衰竭的风险。胱抑素C是一种非糖化多肽链蛋白质抑制蛋白,受人种和肌肉含量的影响较小,昼夜无明显变化[7],较之血清肌酐更能反映肾小球滤过率。研究发现,胱抑素C是临床诊断急性肾损伤的良好指标,急性肾损伤的患者胱抑素C升高较肌酐明显提前,可作为急性肾损伤的早期诊断指标,已被广泛应用于危重患者和心脏手术后患者[8]。血清β2-MG水平一般情况下相对稳定,不受年龄、性别、机体肌肉组织等因素的影响[9]。易通过肾小球滤过膜,几乎全部由近端肾小管重吸收,当肾近端小管刷状缘膜蛋白摄取过程受干扰或溶酶体蛋白分解代谢减少时,肾小管重吸收功能降低,血液中β2-MG会迅速升高[10].研究发现,妊娠期高血压疾病患者血清CysC和β2-MG均高于对照组,差异具有统计学意义(P<0.05);重度患者血清CysC和β2-MG均高于中度和轻度患者,中度高于轻度患者,差异均具有统计学意义(P<0.05),并且血清CysC水平与血清β2-MG水平呈明显正相关(r=0.607,P<0.05),表明血清CysC和β2-MG能较早较好的发现妊娠高血压患者肾功能损伤情况,并且随着疾病的加重呈增高趋势,对妊娠高血压早期诊断和疾病的分期具有较高的临床意义。
相关研究表明,在妊娠期高血压疾病中患者的全身炎性反应增强[11]。由于妊娠期高血压疾病患者胎盘床的血管重铸障碍,引发血流灌注不足,局部因缺血缺氧出现氧化应激反应,同时释放出一系列细胞毒性物质和炎性介质,导致大量毒性因子的产生和类脂过氧化物的持续生成,最终引起血管内皮损伤[12],国内外研究热点显示血管内皮损伤学说已被认为是导致妊娠期高血压疾病发病的中心环节[13]。C反应蛋白(CRP)是一种急性时反应蛋白,由肝细胞合成,hs-CRP更敏感,可以作为炎性反应的敏感标志物广泛地参与动脉粥样硬化、血栓形成疾病的介导[14]。已有研究证实CRP与心血管疾病如动脉粥样硬化、冠状动脉疾病乃至心肌梗死的发生、发展和预后有着密切的关系[15]。hs-CRP是反映动脉粥样硬化的炎性指标,也是高血压病的危险因素之一[16]。本研究发现,妊娠期高血压疾病患者血清hs-CRP高于对照组,且在妊娠期高血压各组间比较差异均具有统计学意义(P<0.05),同时妊娠期高血压患者血清CysC与hs-CRP存在明显正相关(r=0.542,P<0.05),表明血清hs-CRP在妊娠高血压进程发挥着重要作用,是其敏感指标。
综上所述,妊娠高血压的发病机制与血清CysC、hs-CRP和β2-MG水平密切相关,并随着患者疾病进展程度的加重而增高,是其诊断的敏感指标,动态监测妊娠高血压患者血清CysC、hs-CRP和β2-MG水平对妊娠高血压疾病的早期诊断和预防以及疾病发展与治疗具有重要的临床意义。
[1]Visser S,Hermes W,Ket JC,et al.Systematic Review and Metaanalysison Non-classic Cardiovascular Biomarkers after Hypertensive PregnancyDisorders[J].Am J Obstet Gynecol,2014,28(2):242-247.
[2]王芳.妊娠期血清胱抑素C的数值变化与妊娠期高血压早期肾损害中的临床价值分析[J].临床与实践,2014,12(25):38-39.
[3]乐杰.妇产科学[M].第7版.北京:人民卫生出版社,2008:92.
[4]陈园园,李红梅.VEGF和vWF与妊娠期高血压疾病发病机制的相关性探讨[J].西南国防医药,2014(8):917-919.
[5]邹前芽,曾晓燕,刘国忠.血清同型半胱氨酸、叶酸、维生素B12联合检测对妊娠高血压综合征的诊断价值[J].实验与检验医学,2014(6):726-727.
[6]Chen CW,Jaffe IZ,Karumanchi SA.Pre-eclampsia.and cardiovascular disease[J].Cardiovasc Res,2014,101(4):579-586.[7]苏玲君,郑芳,廖小莲.血清胱抑素C在妊娠期高血压早期肾损害中的诊断意义[J].北方医药,2015,12(2):114-115.
[8]黄艳,周杜娟,徐雁,等.血清胱抑素C在妊娠期高血压疾病变化中的临床意义和应用[J].临床和实验医学杂志,2014,13(15):1274-1276.
[9]沈红.血清β2微球蛋白、胱抑素C、C反应蛋白在早期糖尿病肾病检测中的临床意义[J].实验与检验医学,2014(5):586-587.
[10]宋清玲.血清β2-微球蛋白在妊娠高血压综合征早期肾功能诊断中的意义[J].检验医学与临床,2014,11(5):609-610.
[11]Gruca-Stryjak K,Cofta S,Wysocka E,et al.Is there a relationship between pregnancy induced hypertension and obstructive sleep apnea case report[J].Pneumonol Alergol Pol,2014,82(2):156-162.
[12]Liu LY,Yang T,Ji J,et al.Integrating multiple'omics'analyses identifies serological protein biomarkers for preeclampsia[J].BMC Med,2013,11(2):236.
[13]Negi R,Pande D,Karki K,et al.Association of oxidative DNA damage,protein oxidation and antioxidant function with oxidative stress inducedcellular injury in pre-eclamptic/eclamptic mothers during fetalcirculation[J].Chem Biol Interact,2014,208(1):77-83.
[14]Tabatabaian F,Dougherty K,Di Fulvio M,et al.Mammalian target of rapamycin(mTOR)and S6 kinase down-regulate phospholipase D2 basal expression and function[J].Biol Chem,2010,285(25):18991-19001.
[15]沈艳杰.血清CRP在冠状动脉粥样硬化性心脏病中诊断价值的研究[J].中国地方病防治杂志,2014(s2):130-131.
[16]Wang L,Liu ZQ,Huo YQ,et al.Change of hs-CRP,sVCAM-1,NTproBNP levels in patients with pregnancy-induced hypertension after therapy with magnesium sulfate and nifudipine[J].Asian Pac J TropMed,2013,6(11):897-901.
R714.24+6,R446.11+2
A
1674-1129(2017)02-0241-02
10.3969/j.issn.1674-1129.2017.02.033
2016-10-17;
2016-12-12)
