[反]-β-法尼烯(EβF)合成酶基因在玉米中的转化与筛选
2017-04-19KH3D邢小龙常纪苹付忠军胡德升胡彦民
[KH-*3D]邢小龙,常纪苹,付忠军,胡德升,胡彦民*
(1.河南农业大学农学院/河南粮食作物协同创新中心,河南郑州450002;2.重庆市农业科学院,重庆401329)
[反]-β-法尼烯(EβF)合成酶基因在玉米中的转化与筛选
[KH-*3D]邢小龙1,常纪苹1,付忠军2,胡德升1,胡彦民1*
(1.河南农业大学农学院/河南粮食作物协同创新中心,河南郑州450002;2.重庆市农业科学院,重庆401329)
为获得转基因抗虫玉米,将[反]-β-法尼烯(EβF)合成酶基因导入玉米,并进行鉴定和筛选。在[反]-β-法尼烯(EβF)合成酶基因的两端分别添加Nco I和Bam H I酶切位点,并进行人工合成。将EβF合成酶基因与植物表达载体pFGC5941连接,经双酶切和测序鉴定。结果表明:重组表达载体pFGC5941-EβF构建成功;载体pFGC5941-EβF转化农杆菌EHA105后用玉米芽尖侵染法将EβF合成酶基因导入玉米自交系郑58中,对转化植株进行除草剂抗性筛选以及EβF合成酶基因和bar基因的PCR鉴定后,共得到18株转基因阳性植株。
[反]-β-法尼烯(EβF)合成酶基因;玉米;表达载体构建;转基因植株
[反]-β-法尼烯(EβF)合成酶基因是植物体内催化法尼基焦磷酸(FPP)合成EβF的关键酶基因。EβF作为大多数蚜虫报警信息素的主要甚至唯一成分,是一种重要的倍半萜烯类化合物[1-3],当蚜虫受到天攻击时,其体内会产生EβF,以使其他蚜虫逃离,从而停止对作物的危害。EβF对蚜虫有强烈的驱避作用,并能吸引蚜虫天敌,从而有较好的抗蚜效果。Beale等[4]将欧洲薄荷EβF合成酶基因转入拟南芥,转基因植株对蚜虫产生警戒反应并吸引蚜虫寄生性天敌蚜茧蜂。Foster等[5]研究发现,产生抗药性的蚜虫对EβF反应变得迟钝,故利用EβF充分吸引蚜虫天敌可有效控制抗药性蚜虫。
目前该基因已先后从欧洲薄荷,香橙,花旗松,黄花蒿中得到分离和鉴定[6-9]。近年来研究人员又将EβF合成酶基因成功导入拟南芥,烟草,水稻[10-12]等作物中,培育了多种转基因抗虫植株。笔者借鉴前人经验,以EβF合成酶基因构建重组表达载体pFGC5941-EβF并转入玉米自交系郑58,得到转化植株,然后进行鉴定和筛选,为获得抗虫玉米材料奠定基础。
1 材料与方法
1.1 供试材料
受体材料:郑58,玉米优良自交系;菌株:大肠杆菌DH5α,根癌农杆菌EHA105,由本实验室保存;[反]-β-法尼烯(EβF)合成酶基因由苏州金唯智生物科技有限公司合成;基因测序由北京奥科鼎盛生物科技有限公司完成。
1.2 植物表达载体的构建
在[反]-β-法尼烯(EβF)合成酶基因(1653 bp)两端分别引入Nco I和Bam H I酶切位点,委托苏州金唯智生物科技有限公司合成,得到两端带酶切位点的目的基因,并用Nco I和Bam H I对其进行双酶切。将植物表达载体pFGC5941用Nco I和Bam H I双酶切后回收载体骨架,表达载体骨架与目的基因按摩尔数之比1∶5的比例混合,然后加入2 μl 10×T4DNA Ligase buffer和1μl T4DNA连接酶,补足灭菌水至终反应体积20 μl,22℃连接30 min。将连接产物转化大肠杆菌DH5α感受态细胞、双酶切和测序鉴定,以确定成功构建重组表达载体pFGC5941-EβF。
1.3 转基因植株的转化
培养大肠杆菌阳性克隆子,提取阳性大肠杆菌的质粒DNA,并用液氮冻融法转化农杆菌,然后对其进行菌落PCR鉴定,培养阳性农杆菌,通过农杆菌侵染法转化郑58种子。
1.4 转基因植株的PCR检测
取转化后的玉米植株叶片,采用CTAB法提取玉米基因组DNA。根据[反]-β-法尼烯(EβF)合成酶基因序列设计PCR引物。EβF合成酶基因的上下游引物为EβF-F1,ccatggctacaaacggcgtc;EβF-R1,ggatcctcaaaagactatggcatcaacaaag扩增产物片段大小为1661 bp。PCR反应体系为25 μl 2×PCR buffer,1 μl dNTPs,0.2 μl DNA模板,上下游引物各2 μl,1 μl DNA Polymerase,加灭菌水至50 μl,PCR扩增程序为95℃预变性3 min,95℃变性15 s,58℃退火15 s,72℃延伸90 s,进行35个循环最后72℃彻底延伸5 min。扩增产物用1.2%琼脂糖凝胶电泳检测。
1.5 转基因植株的除草剂抗性检测
将PCR检测阳性的幼苗移栽至大田,自交授粉收获种子。将收获的玉米种子播种在营养钵内,放置人工气候室内培养,待转基因幼苗长至3叶期时,喷洒0.2%的PPT溶液进行除草剂筛选,每天1次,连续喷洒2,5 d后观察结果。
2 结果与分析
2.1 重组表达载体pFGC5941-EβF的构建
用Nco I和Bam H I对质粒pFGC5941进行双酶切,切去的片段大小为1388 bp,琼脂糖凝胶电泳检测,产生2条带,大小与预期一致。切胶回收长度为10 017 bp的载体骨架。将目的基因与切胶回收得到的载体骨架用T4连接酶进行连接(图1)。
2.2 重组表达载体鉴定
2.2.1 双酶切鉴定重组表达载体pFGC5941-EβF经双酶切后产生10 017 bp的大片段和1661 bp的目的小片段。
双酶切鉴定结果表明,目的基因EβF合成酶基因已成功连接到pFGC5941载体上,构建的表达载体pFGC5941-EβF正确(图2)。
2.2.2 测序鉴定重组表达载体构建后,转化大肠杆菌,提取质粒,再对目的基因进行测序,经与目的基因进行比对,序列完全一致,测序结果见图3。
2.3 转基因植株获得
经农杆菌介导的玉米芽尖遗传转化、转化后植株的PCR检测,共得到22株拟转基因植株(图4)。
2.4 转化植株除草剂抗性分析
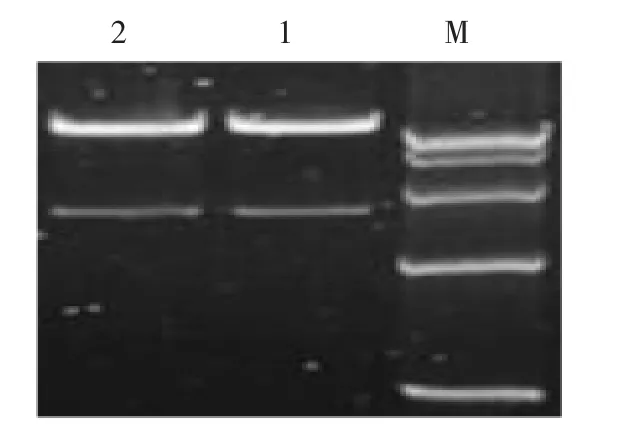
图1 Nco I和BamH I双酶切电泳图Fig.1Electrophoretogram of products digested by double enzymes
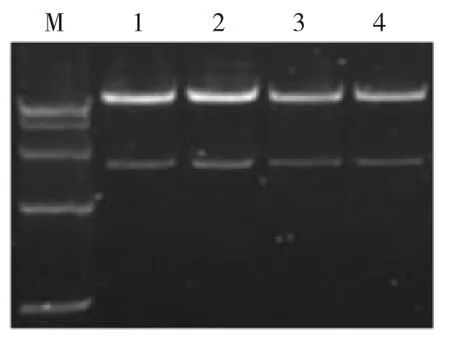
图2 重组表达载体pFGC5941-EβF的双酶切鉴定Fig.2Identification of the recombinant expression vector pFGC5941-EβF by double enzyme digestion
22株拟转基因植株自交授粉结实后,对其后代分别进行除草剂抗性筛选,幼苗长至3叶期时,喷洒0.2%的PPT溶液,每天1次,连续喷洒2 d,5 d后观察结果。结果显示,22株转化玉米植株中18株表现出除草剂抗性,可初步确定这18株为转基因阳性植株(图5)。

图3 EβF合成酶基因的测序Fig.3Sequence of EβF synthase gene
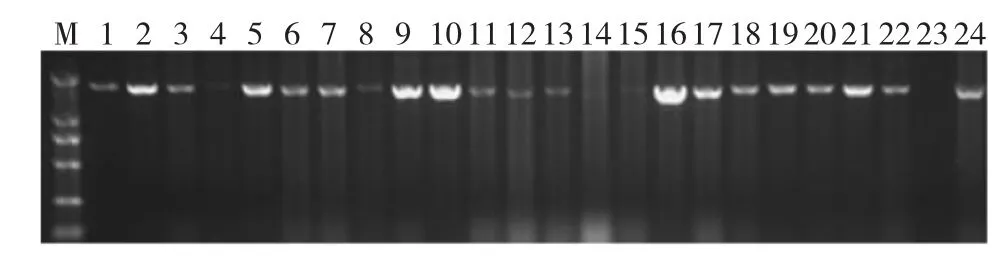
图4 EβF合成酶基因PCR检测Fig.4EβF synthase gene PCR detection of putative transformant

图5 T1代植株除草剂筛选Fig.5T1 plantlets herbicide-resistant test
2.5 转基因阳性植株PCR检测
根据Bar基因序列设计PCR引物,上游引物为Bar-F1;gcaccatcgtcaaccactacat下游引物为Bar-R1,tgtgcctccagggacttca扩增产物片段大小为286 bp。琼脂糖凝胶电泳检测结果显示,阳性对照及除草剂抗性植株均能扩增出目的基因片段,而阴性对照不能扩增出目的条带。Bar引物扩增片段与预期大小286 bp相符。PCR检测进一步确定了除草剂抗性的18株植株为转基因阳性植株,表明抗虫基因EβF合成酶基因已整合到玉米基因组中(图6)。
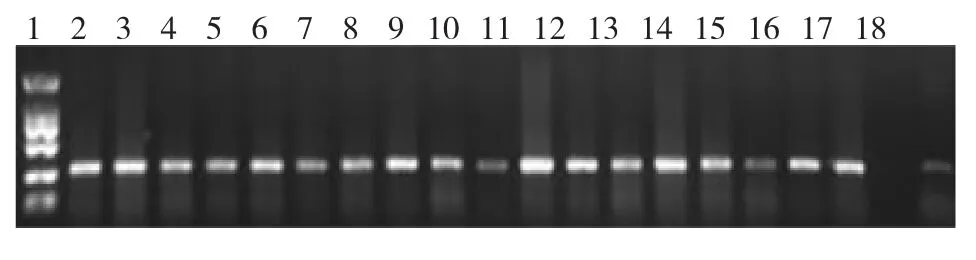
图6 Bar基因PCR检测Fig.6Bar gene PCR detection of putative transformant
3 结论与讨论
本研究将[反]-β-法尼烯(EβF)合成酶基因与植物表达载体pFGC5941连接,成功构建pFGC5941-EβF重组表达载体,采用液氮冻融法转化农杆菌EHA105,然后用农杆菌侵染玉米芽尖将EβF合成酶基因转入玉米自交系郑58,并对转化植株进行PCR检测和除草剂抗性筛选,共获得18株转基因阳性植株。
英国洛桑研究所2005年从欧洲薄荷中克隆到[反]-β-法尼烯(EβF)合成酶基因,该基因有1653个核苷酸组成,编码550个氨基酸[6]。由于[反]-β-法尼烯(EβF)合成酶基因对蚜虫有明显的驱避作用[4,10,13],该基因越来越多地被应用到基因工程中。本研究选用的35S启动子是一种强启动子,可提高转基因玉米[反]-β-法尼烯(EβF)的表达水平,提高其抗虫性,被广泛应用于植物基因转化中。为了得到更加纯合的转基因植株,需要对转基因植株的后代进行进一步的分子检测如Southern blotting和Western blotting等,经过连续多代自交筛选,可得到纯合的转基因植株。另外,EβF合成酶基因还可以与Bt基因或其他抗虫基因构建双价或多价抗虫植物表达载体,拓宽抗虫谱,培育出具有高效广谱抗虫性的转基因玉米。
[1]Bowers W S,Nault L R,Webb R E,et al.Aphid alarm pheromone:I-solation,identification,synthesis[J].Science,1972,177:1121-1122.
[2]Wientjens W H,Lakwijk A C,Van D M.Alarm pheromone of grain aphids[J].Experientia,1973,29:658-660.
[3]Francis F,Martin T,Lognay G,et al.Role of(E)-β-farnesene in systematic aphid prey location by Episyrphus balteatus larvae(Diptera:Syrphidae)[J].European Journal of Entomology,2005,102: 431-436.
[4]Beale M H,Birkett M A,Bruce T J,et al.Aphid alarm pheromone produced by transgenic plants affects aphid and parasitoid behavior[J].Proceedings of the National Academy of Sciences of the USA,2006,103:10509-10513.
[5]Foster S P,Denholm I,Thompson R,et al.Reduced response of insecticide-resistant aphids and attraction of parasitoids to aphid alarm pheromone:a potential fitness trade-off[J].Bulletin of Entomological Research,2005,59:1-10.
[6]Prosser I M,Adams R J,Beale M H,et al.Cloning and functional characterisation of a cismuuroladiene synthase from black peppermint (Mentha×piperita)and direct evidence for a chemotype unable to synthesise farnesene[J].Phytochemistry,2006,67:1564-1571.
[7]Maruyama T,Ito M,Honda G.Molecular cloning,functional expression and characterization of(E)-β-farnesene synthase from Citrus junos[J].Biological&Pharmaceutical Bulletin,2001,24:1171-1175.
[8]Huber D P,Philippe R N,Godard K A,et al.Characterization of four terpene synthase cDNAs from methyl jasmonateinduced Douglas-fir,Pseudotsuga menziesii[J].Phytochemistry,2005,66:1427-1439.
[9]Park S J,Huang Y,Ayoubi P.Identification of expression profiles of sorghum genes in response to greenbug phloem-feeding using Cdna subtraction and microarray analysis[J].Planta,2005,223:932-947.
[10]Kappers I F,Aharoni A,van Herpen T W,et al.Genetic engineering of terpenoid metabolism attracts bodyguards to Arabidopsis[J].Science,2005,309(5743):2070-2072.
[11]Yu X,Zhang Y,Ma Y,et al.Expression of an(E)-β-farnesene synthase gene from Asian peppermint in tobacco affected aphid infestation[J].Crop Journal,2013,1(1):50-60.
[12]Liang G,Xi T Z,Fei Z,et al.Expression of a Peppermint(E)-β-Farnesene Synthase Gene in Rice Has Significant Repelling Effect on Bird Cherry-Oat Aphid(Rhopalosiphum padi)[J].Plant Mol Biol Rep,2015.
[13]Crock J,Wildung M,Croteau R.Isolation and bacterial expression of a sesquiterpene synthase cDNA clone from peppermint(Mentha x piperita L.)that produces the aphid alarm pheromone(E)-β-farnesene[J].Proceedings of the National Academy of Sciences,USA,1997,94:12833-12838.
(责任编辑 陈虹)
Transformation of(E)-β-farnesene Synthase Gene into Maize and Preliminary Screening
XING Xiao-long1,CHANG Ji-ping1,FU Zhong-jun2,HU De-sheng1,HU Yan-min1*
(1.College of Agronomy,Henan Agricultural University/Collaborative Innovation Center of Henan Grain Crops,Henan Zhengzhou 450002,China;2.Chongqing Academy of Agricultural Sciences,Chongqing 401329,China)
To obtain insect-resistant transgenic maize,(E)-β-farnesene synthase gene was transferred into maize,which was identified and screened.The Nco I and Bam H I enzyme cutting sites were separately added at both ends of the(E)-β-farnesene synthase gene.This sequence was artificially synthesized.The desired gene was ligated into vector pFGC5941 by double enzyme digestion and DNA ligase to construct ecombinant expression vector pFGC5941-EβF,which were sequenced and identified by double enzyme digestion.The result showed that the vector pFGC5941-EβF was successfully constructed.Then pFGC5941-EβF was transformed into Agrobacterium tumefaciens EHA105 that infected shoot apical growing point of maize Zheng58.The transgenic maize plants were identified by herbicide-resistant and PCR amplification for bar and EβF synthase genes,and a total of 18 positive transgenic maize plants were obtained.
(E)-β-farnesene synthase gene;Maize;Construction of expression vector;Transgenic plants
S513.038
A
1001-4829(2017)1-0001-04
10.16213/j.cnki.scjas.2017.1.001
2016-01-10
国家自然科学基金项目(31071431)
邢小龙(1989-),男,河南舞阳人,从事玉米生物技术育种研究,E-mail:xingxiaolong2013@163.com,*为通讯作者:胡彦民,E-mail:huyanmin007@163.com。
