制浆中段废水处理优势菌的鉴定及其对COD去除效果的研究
2017-04-19党亚攀兰善红
党亚攀 兰善红
(1.华南理工大学环境与能源学院,工业聚集区污染控制与生态修复教育部重点实验室,广东广州,510006;2. 东莞理工学院生态环境与建筑工程学院,广东东莞,523808)
·废水处理优势菌·
制浆中段废水处理优势菌的鉴定及其对COD去除效果的研究
党亚攀1兰善红2,*
(1.华南理工大学环境与能源学院,工业聚集区污染控制与生态修复教育部重点实验室,广东广州,510006;2. 东莞理工学院生态环境与建筑工程学院,广东东莞,523808)
本实验从制浆中段废水的活性污泥中分离纯化得到1株优势菌,采用MIDI Sherlock®全自动微生物鉴定系统鉴定为缺陷短波单胞菌。研究pH值和温度对该优势菌生长曲线和对制浆中段废水的处理效果发现,该缺陷型短波单胞菌在pH值5、30℃时的生长状况最好,CODCr的去除率最高达38.5%,在pH值为6~8范围内对CODCr也有较好的去除效果,去除率可达30%以上。将该优势菌投加到好氧活性污泥系统中,制浆中段废水的CODCr去除率可提高15%以上。
优势菌;制浆中段废水;鉴定;生长
制浆中段废水中由于毒性物质较多,降解优势菌在污泥中难富集,导致微生物对废水的处理效果差。目前对生化处理废水的强化技术在不断地研究中,如在好氧活性污泥系统中添加增强微生物生长代谢的物质[1],或直接在污泥系统中投加针对某类污染物降解的优势菌[2]。
目前对优势菌增强废水处理的研究已取得较好的成果。Sun等人[3]将所筛选出的优势菌应用于上流式厌氧污泥床与序批式污泥反应器相结合的系统中,使污水的COD、总氮、氨氮等的去除率均达到95%以上。Yang等人[4]从矿山排水中进行菌种的分离鉴定,以丰富对微生物群落的认识,同时分析其中的优势菌,考察优势菌能否在现有成效的基础上提高矿厂废水的处理效果。Li等人[5]以合成PTA(对苯二甲酸)废水为对象,在不同温度下微生物对该废水的处理效果进行研究,实验发现D-变形菌在所研究细菌群中,高温时是厌氧处理的主力军,其他温度等条件下优势菌各不相同,优势菌的存在使特定污染物的去除量更高。孙友友等人[6]将所筛选出的多个纯种菌株进行混合,来组成复合菌群,发现由于优势菌的引入,尤其是它们在共同作用时,可以使造纸废水的处理效果有很大提高。同样有研究证明,与普通活性污泥工艺相比较,好氧活性污泥通过经筛选分离获得的优势菌强化后,对制浆中段废水的处理效果明显增强,废水的色度以及CODCr都有明显降低[7- 8]。
本课题组在实验室中通过驯化获得一株能够降解制浆中段废水的优势菌,对该优势菌进行鉴定,并对其生长代谢进行研究,以期为制浆中段废水的强化生化处理提供良好的优势菌种。
1 材料与方法
1.1 废水来源及水质
山东某造纸厂制浆中段废水,采用硫酸盐法制浆;废水絮凝后CODCr浓度为600 mg/L左右,pH值为7.0左右。以絮凝后的制浆中段废水作为实验废水。
1.2 分析方法
采用精密型pH试纸对溶液pH值进行测定;CODCr浓度采用便携式水质分析仪测定(DR2700,HACH,美国);采用MIDI Sherlock®全自动微生物鉴定系统对分离纯化的纯菌落进行鉴定,该仪器由美国MIDI公司生产,配套设备为安捷伦气相色谱GC6850,该系统的菌库包括TSBA6、CLIN6、BHIBLA3、ACTIN1。
1.3 实验方法
(1)优势菌种的筛选及纯化:将经制浆中段废水驯化后污泥上清液接种于牛肉膏蛋白胨培养基采用四区划线法进行菌种分离,在生化培养箱中于30℃培养24 h,选取其中的几个不同的典型菌落进一步在固体培养基上进行分离纯化,直至菌落为单一菌种繁殖而成为止。
(2)pH值对优势菌生长的影响实验:将灭菌的制浆中段废水按m(COD)∶m(N)∶m(P)=100∶5∶1加入N、P营养元素,分别加入5个已经灭菌的锥形瓶中,每个锥形瓶中加200 mL废水,用精密pH试纸分别调节pH值为5、6、7、8、9;挑取斜面培养基菌落2~3环,配制为50 mL的均匀菌液,每个锥形瓶中各自加入2 mL菌液,用灭菌棉花塞住锥形瓶,在30℃环境中震荡,测定不同时间的OD600,得出优势菌在不同pH值下的生长曲线。
(3)pH值对优势菌处理制浆中段废水的影响:将灭菌的制浆中段废水(m(COD)∶m(N)∶m(P)=200∶5∶1)分别加入至5个锥形瓶中,每个锥形瓶废水加入量为200 mL,并加入0.01 g优势菌种(湿),pH值分别调节为5、6、7、8、9。在30℃下进行曝气,以24 h为一个周期,运行10个周期后,监测进出水CODCr浓度,计算CODCr去除率。
(4)温度对优势菌处理制浆中段废水影响:pH值影响实验的基础上确定的合适pH值条件下,选取10℃(代表低温)、30℃(代表中温)和45℃(高温微生物生长的下限)3个温度,实验方法同1.3(3),计算不同温度下的CODCr去除率。
2 结果及讨论
2.1 优势菌的筛选与鉴定
经分离纯化获得一株优势菌,其菌落如图1所示。该菌落为米白色,呈草帽状,湿润透明,呈隆起状态,边缘粗糙且不整齐。

图1 牛肉膏蛋白胨培养基上的菌落
从牛肉膏蛋白胨培养基上挑取菌落,经过涂片固定、初染、媒染、脱色及复染等染色程序,观察其革兰氏染色反应,染色结果为菌体呈现红色,判定为革兰氏阴性菌。提取微生物脂肪酸,进行鉴定[9]。鉴定结果如图2和表1所示。
菌落中所提取的脂肪酸在系统的TSBA6中比对上3种菌,相似度最高的为Brevundimonas-diminuta,
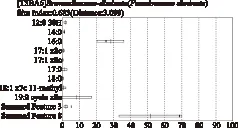
图2 脂肪酸匹配图
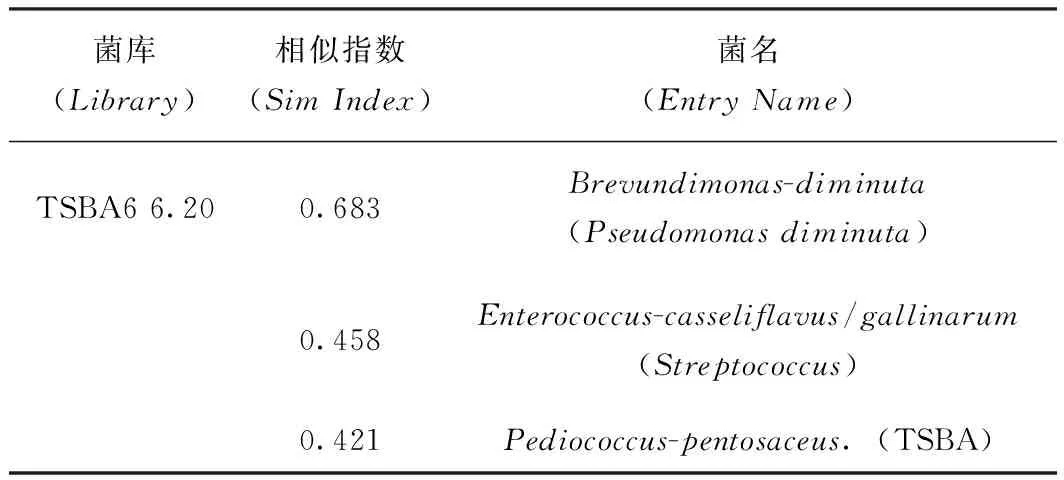
菌库(Library)相似指数(SimIndex)菌名(EntryName)TSBA66.200.683Brevundimonas-diminuta(Pseudomonasdiminuta)0.458Enterococcus-casseliflavus/gallinarum(Streptococcus)0.421Pediococcus-pentosaceus.(TSBA)
相似指数为0.683,大于0.5,鉴定结果可用。结合革兰氏染色反应,优势菌的鉴定结果为缺陷短波单胞菌。
根据伯杰氏细菌鉴定手册[10],缺陷短波单胞菌Brevundimonas-diminuta(Pseudomonasdiminuta)(BD)革兰氏阴性菌,染色反应为红色,这与以上革兰氏染色实验结果一致,细菌个体短小,从形状来看属于杆菌类。从外观来看,整个菌落像是一个草帽,但菌落的边缘并不平整,菌落的中间会有一个向上凸起的弧度,菌落呈现出淡淡的灰白色。这与实验中培养的菌落的观察一致。这种细菌是一种较为严格的好氧菌,它在30℃时的生长代谢速度最快,在37℃的环境中也能生长,有些菌株甚至可以在41℃条件下生长,但是在4℃时则不会生长。
2.2 优势菌生长及其对废水处理的研究
2.2.1 pH值对缺陷短波单胞菌生长的影响
除了营养物质,微生物的生命活动及生长与pH值也存在着极大的关系,不同的微生物生长所要求的pH值不同。30℃时缺陷短波单胞菌在不同pH值下的生长曲线如图3(a)所示。
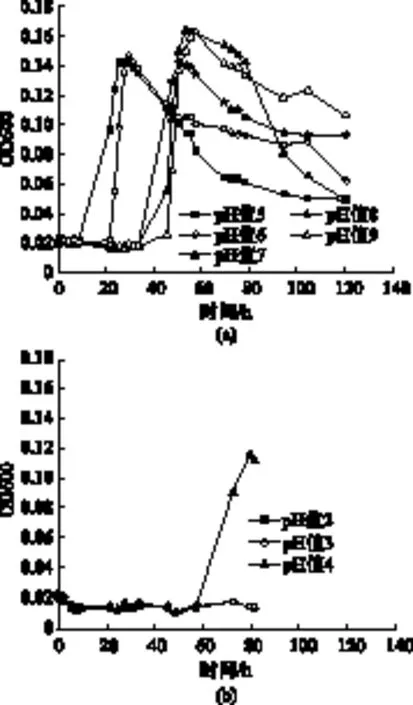
图3 不同pH值下缺陷短波单胞菌生长曲线
通过图3(a)的生长曲线可以看出,对于缺陷短波单胞菌来说,30℃条件下,略微偏酸性的环境更加适合其生长。在pH值5的条件下,缺陷短波单胞菌经过大约7 h的停滞期,开始大量生长,进入对数期,在经过26 h左右细胞数目达到最大值,此后经过一定时间的稳定之后,细菌数量开始缓慢下降,细菌生长进入衰亡期。pH值6时,停滞期相对较长,大约在22 h左右才开始进入对数生长期,但之后生长速度较为迅速,在30 h左右细菌总量已经达到最大值,此后经过一定的稳定时间,细菌生长开始进入衰亡期,菌体总量缓慢下降。在pH值7、pH值8环境中的停滞期时间大致相同,大约34 h左右,此后细菌的生长开始进入对数生长期,大约在54~55 h左右,细菌生长总量达到最大值,此后菌体生长开始进入停滞期,细菌总量缓慢下降。在pH值9的环境下,停滞期达到40 h左右,在第46 h时,缺陷短波单胞菌才开始大量生长,并在56 h左右菌体总量达到最大值,与pH值7、pH值8环境下达到最大值的时间大致相同,此后开始进入细菌总量缓慢下降的衰亡期。
因为该菌在pH值5的条件下生长状况良好,于是猜测它在pH值小于5的条件下可能也有生长,因此考察pH值小于5时的生长情况,结果如图3(b)所示。
由图3(b)缺陷短波单胞菌生长曲线看出,在pH值4的环境下,缺陷短波单胞菌在经过大约58 h的停滞期后才开始进入对数生长期,观察生长曲线也可以看出,pH值4条件下的对数期生长速度相对于pH值5、pH值6、pH值7、pH值8和pH值9条件下的对数期的生长速度更为缓慢,而且达到菌体最大量所需要的时间更久。pH值2和pH值3的环境中,在测定生长曲线的80 h内,细菌总量几乎没有变化,可以推断缺陷短波单胞菌在pH值较低的条件下特别是pH值小于4时生长极为缓慢,或者根本不会生长。生长曲线测定结束时测定每组pH值发现初始设定pH值为5、6、7、8、9的5个锥形瓶溶液的pH值都接近5,初始设定pH值为2、3、4的锥形瓶中溶液的pH值几乎没有变化,缺陷短波单胞菌可以在生长代谢的过程中产生一定量的酸性物质,导致溶液酸化[9],而初始pH值为7~9时经历较长的延滞期后的生长,有可能是pH值已经降低。而对pH值的监测,也证实了这一结果。因此缺陷短波单胞菌合适的生长pH值为5左右。
2.2.2 pH值对缺陷短波单胞菌处理制浆中段废水的影响
不同pH值条件下,缺陷短波单胞菌对制浆中段废水CODCr的去除效果如图4所示。
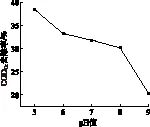
图4 pH值对CODCr去除率的影响
通过图4可以看出,缺陷短波单胞菌在30℃、pH值5~9对制浆中段废水都有一定处理效果,CODCr去除率基本都在20%以上。在pH值5时的处理效果最好,CODCr去除率可达38.5%。pH值6~8时的CODCr去除效果相差不大,但是要略差于pH值5条件下的CODCr去除效果。这3个pH值条件下的最高CODCr去除率分别可以达到33.3%、31.8%、30.2%。pH值9条件下,CODCr去除率最低,为20.3%。由于缺陷短波单胞菌的产酸性,在pH值为6~9时,整个运行周期内,废水大分子有机物水解为有机酸,使系统中微环境pH值降低,这种行为不仅为自身生长繁殖提供了有利条件,而且增强对制浆中段废水CODCr的降解效果。
研究表明,缺陷短波单胞菌在pH值为5~8,对多环芳烃具有较好的降解效果[11],这与制浆中段废水中的木素类有机物相似,该研究中适合处理废水的pH值与本研究得到的结果相似。
综上所述,缺陷短波单胞菌在较广泛的初始pH值范围内对制浆中段废水CODCr都有一定的去除效果,这种单一菌株在pH值5~8对制浆中段废水均有较好的处理效果,在pH值9环境中也有一定处理效果。
2.2.3 温度对缺陷短波单胞菌处理制浆中段废水的影响
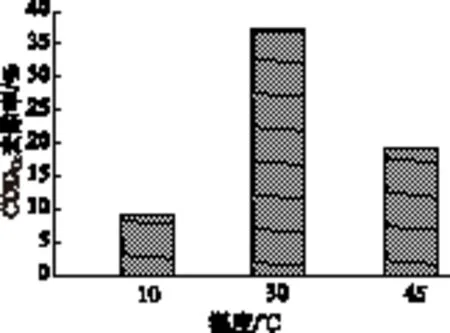
图5 温度对CODCr去除率的影响
在pH值为5时,温度对缺陷短波单胞菌对制浆中段废水CODCr的去除效果如图5所示。
从图5可以看出,缺陷短波单胞菌在30℃时对废水的处理效果最好,CODCr去除率达37.1%,在10℃和45℃时,对CODCr也有一定去除,但去除率不太高,10℃为9.11%,45℃为19.9%,这是因为温度过低或者过高影响了微生物体内的酶的活性,导致相同时间去除的CODCr的量减少。因此,缺陷短波单胞菌的最适温度应在30℃左右,这与伯杰氏鉴定手册中所述的缺陷短波单胞菌的生长温度一致。而在高温时的降解效果明显高于低温,在伯杰氏鉴定手册中描述缺陷短波单胞菌能在高达41℃条件下正常生长代谢,而在45℃下尽管抑制微生物生长代谢,但偏离41℃不太大,因此CODCr去除率也不太低。
2.3 缺陷短波单胞菌强化好氧活性污泥处理制浆中段废水的研究
将缺陷短波单胞菌制成菌粉,加入经制浆中段废水驯化的好氧活性污泥系统中,加入量为0.1 g/L,考察优势菌对好氧活性污泥处理制浆中段废水的强化作用,并以不加优势菌的好氧活性污泥系统作为对照,结果如图6所示。
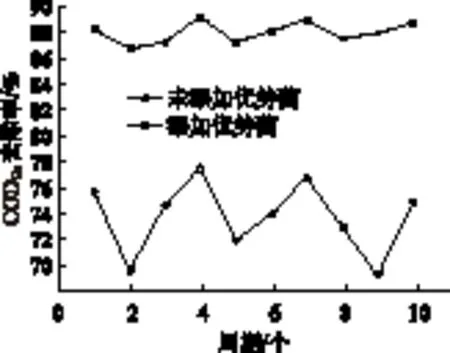
图6 优势菌对好氧活性污泥处理制浆中段 废水的强化效果
由图6可以看出,缺陷短波单胞菌的加入可以提高好氧活性污泥降解制浆中段废水的效果,CODCr去除率提高15%以上。在运行的10个周期内,作为对照的好氧活性污泥系统CODCr去除率波动幅度较大,添加优势菌后,CODCr去除率在86.9%~89.2%之间,波动幅度很小。表明缺陷短波单胞菌不仅可以强化好氧活性污泥处理制浆中段废水,而且可以起到稳定出水水质的作用。
3 结 论
(1)从实验室经制浆中段废水的活性污泥中分离纯化获得1株优势菌,通过MIDI Sherlock®全自动微生物鉴定系统鉴定为缺陷短波单胞菌。
(2)缺陷短波单胞菌生长的最适pH值为5,在该条件下,对制浆中段废水的处理效果最好,CODCr的去除率最高可达38.5%。在温度30℃时,该优势菌对制浆中段废水处理效果最好,温度偏高或偏低,处理效果下降,但高温效果优于低温效果。
(3)缺陷短波单胞菌可强化好氧活性污泥处理制浆中段废水的效果,且具有稳定出水水质的作用。
[1] LAN Hui-xia, GENG Shi-wen, LI Hui-jie, et al. Domestication of Aerobic Activated Sludge for Treatment of Pulping Middle-stage Effluent in the Presence of Fe3+[J]. China Pulp & Paper, 2015, 34(10): 8. 蓝惠霞, 耿士文, 李慧洁, 等. Fe3+存在下制浆中段废水好氧活性污泥的驯化[J]. 中国造纸, 2015, 34(10): 8.
[2] CHENG Jia-qi, CHEN Yuan-cai, CHEN Hong-lei, et al. Bioaugmentation of Aerobic Granular Sludge with the Preponderant Bacteria Flora for Degradation of Pulping Effluent[J]. China Pulp & Paper, 2011, 30(7): 33. 成佳琪, 陈元彩, 陈洪雷, 等. 优势降解菌群强化好氧颗粒污泥处理制浆废水[J]. 中国造纸, 2011, 30(7): 33.
[3] Sun H W, Zhao H N, Bai B X. Advanced removal of organic and nitrogen from ammonium-rich landfill leachate using an anaerobic-aerobic system[J]. Chinese Journal of Chemical Engineering, 2015, 229(6): 1.
[4] Yang Y, Li Y, Sun Q Y. Archaeal and bacterial communities in acid mine drainage from metal-rich abandoned tailing ponds, Tongling, China[J]. Bioresource Technology, 2014, 24(2): 3332.
[5] Li X K, Ma K L, Meng L W. Performance and microbial community profiles in an anaerobic reactor treating with simulated PTA wastewater: From mesophilic to thermophilic temperature[J]. Water Research, 2014, 6(5): 57.
[6] SUN You-you, CHEN Yuan-cai, CHEN Hong-lei. Treatment of Pulp and Paper Effluent by the Immobilization of Screened Dominant Bacterial Strains[J]. China Pulp & Paper, 2011, 30(8): 39. 孙友友, 陈元彩, 陈洪雷. 固定化优势降解菌群处理制浆造纸废水[J]. 中国造纸, 2011, 30(8): 39.
[7] Chen Hong-lei, Zhan Huai-yu, Chen Yuan-cai, et al. Construction of dominant bacteria group to improve the treatment effect of aerobic sludge on Pulping Wastewater[J]. Paper Science & Technology, 2012, 31(2): 83. 陈洪雷, 詹怀宇, 陈元彩, 等. 构建优势菌群提高好氧污泥对制浆废水的处理效果[J]. 造纸科学与技术, 2012, 31(2): 83.
[8] Wang Hai-lei, Li Zong-yi, Yu Guang-li, et al. Papermaking wastewater treatment by bioaugmentation technology[J]. Technology of Water Treatment, 2005, 131(10): 42. 王海磊, 李宗义, 于广丽, 等. 利用生物强化技术处理造纸废水[J]. 水处理技术, 2005, 131(10): 42.
[9] Fykse E M, Tjarnhage T, Humppi T. et al. Identification of airborne bacteria by 16S rDNA sequencing, MALDI-TOF MS and the MIDI microbial identification system[J]. Aerobiologia,2015,31(3):271.
[10] Buchanan R E, Gibbons N E. Bergey’s Manual of Determinative Bacteriology [M]. Shanghai: Science Press, 1984. 布坎南R E,吉本斯N E. 伯杰氏细菌鉴定手册[M]. 上海: 科学出版社, 1984.

(责任编辑:马 忻)
Identification, Growth and COD Removal Efficiency of a Preponderant Bacterium for Degradation of Pulping Effluent
DANG Ya-pan1LAN Shan-hong2,*
(1.SchoolofEnvironmentandEnergy,TheKeyLabofPollutionControlandEcosystem,RestorationinIndustryClustersofMinistryofEducation,SouthChinaUniversityofTechnology,Guangzhou,GuangdongProvince, 510006;2.SchoolofEnvironmentandCivilEngineering,DongguanUniversityofTechnology,Dongguan,GuangdongProvince, 523808)
(*E-mail: llsshhh@163.com)
In this paper, a purified strain was isolated from activated sludge of pulping effluent, which was identified asBrevundimonasdiminutaby MIDI Sherlock®automatic Microbial Identification System. Effect of pH and temperature on the growth curve of the preponderant bacterium the degradation efficiency of pulping effluent were studied. The experimental results showed that the removal efficiency of COD was the best when pH was 5 at the temperature of 30℃. COD removal efficiency reached 38.5%. The removal efficiency also reached a significant level when pH was 6~8, reached up to 30%. The treatment efficiency of pulping effluent by the aerobic activated sludge system increased by more than 10% in the presence ofBrevundimonasdiminuta.
preponderant bacteria; pulping effluent; identification; growth
党亚攀先生,在读硕士研究生;主要从事水处理技术研究工作。
2016- 12- 19(修改稿)
广东省教育厅自然科学项目(2015KTSCX140);2016年大学生创新创业训练计划省级项目(201611819053)。
X793
A
10.11980/j.issn.0254- 508X.2017.03.007
*通信作者:兰善红,教授;研究方向:水处理技术以及絮凝吸附材料合成等。
