HPLC同时测定山豆根中7种生物碱及3种黄酮的含量
2017-04-18韩馥蔓王莉鑫陈影陈两绵冯伟红王
韩馥蔓+王莉鑫+陈影+陈两绵+冯伟红+王锦玉+刘德文+游云+仝燕
[摘要] 建立HPLC同时测定山豆根中7种生物碱(金雀花碱、氧化苦参碱、氧化槐果碱、N-甲基金雀花碱、槐醇、苦参碱和槐果碱)及3种黄酮(三叶豆紫檀苷、芒柄花素和马卡因)含量的方法。采用Welch XtimateTMC18(4.6 mm × 250 mm,5 μm)色谱柱;流动相为乙腈(A)-0.01 mol·L-1醋酸铵(氨水调pH 8.0)溶液(B)进行梯度洗脱:0~20 min,4%~14% A;20~30 min,14%~25% A;30~45 min,25%~40% A;45~65 min,40%~55% A;65~75 min,55% A;流速1.0 mL·min-1,柱温30 ℃,检测波长225 nm。方法学验证结果显示,10种成分的分离度良好,且在各自浓度范围内呈现出良好的线性关系,r≥0.999 7,平均回收率在98.60 %~102.6 %,RSD为0.60%~3.7%(n=6),该方法简便、准确,重复性良好。含量测定结果显示,7种生物碱和3种黄酮成分在不同样品中的含量具有显著性差异。由此表明,不同批次的山豆根药材,其内在质量存在较大差异。该法可用于山豆根药材的多成分同步测定,同时可以为山豆根的全面质量评价和质量控制提供科学依据。
[关键词] 山豆根;高效液相色谱法;含量测定;生物碱;黄酮
[Abstract] In this study,an HPLC method was developed for simultaneous determination of seven alkaloids (cytosine,oxymatrine,N-oxysophocarpine,N-methylcytisine,sophoranol,matrine,and sophocarpine) and three flavonoids (trifolirhizin,fermononetin,and maackiain) from different samples of Sophorae Tonkinensis Radix et Rhizoma. Samples were analyzed on a Welch XtimateTMC18 column (4. 6 mm× 250 mm,5 μm) eluted with the mobile phase of acetonitrile (A) and 0.01 mol·L-1 ammonium acetate solution (pH 8.0) (B) in a linear gradient mode as follows: 0-20 min,4%-14% A;20-30 min,14%-25% A;30-45 min,25%-40% A;45-65 min,40%-55% A;65-75 min,55% A. The flow rate of the mobile phase,the column temperature,and the PDA detector wavelength were set at 1.0 mL·min-1,30 ℃,and 225 nm,respectively. For the method validation,these ten compounds showed good separation and satisfactory linearity (r≥0.999 7) within the concentration ranges tested. The mean recoveries were in the range of 98.60% to 102.6% with the RSD (n=6) between 0.60% and 3.7%. This method was proved to be simple,accurate and repeatable. The quantitative results showed that there were significant differences in the contents of seven alkaloids and three flavonoids among the different samples. This result revealed that the quality of Sophorae Tonkinensis Radix et Rhizoma varied widely. This method could be used for the simultaneous determination of the multi-ingredients from Sophorae Tonkinensis Radix et Rhizoma,which might provide scientific evidences to evaluate/control the quality of Sophorae Tonkinensis Radix et Rhizoma,comprehensively.
[Key words] Sophorae Tonkinensis Radix et Rhizoma;HPLC;quantitative analysis;alkaloid;flavonoid
doi:10.4268/cjcmm20162423
山豆根為豆科植物越南槐Sophora tonkinensis Gagnep. 的干燥根和根茎,主产于广西、贵州、江西、云南等地,味苦,性寒,具有清热解毒,消肿利咽的功效,主治火毒蕴结,乳蛾喉痹,咽喉肿痛,齿龈肿痛,口舌生疮[1]。山豆根中主要含有生物碱、黄酮及多糖类成分[2]。现代药理学研究表明,山豆根中所含生物碱类成分具有多重功效,如苦参碱和氧化苦参碱等具有抗肿瘤、抗炎、抗病毒、抗心律失常、降血压和解热镇痛等药理活性[3];槐花醇、槐果碱和氧化槐果碱等具有抗乙肝病毒活性[4],槐果碱还具有镇静、镇痛及对抗室性心律失常等作用[5]。山豆根中黄酮类成分具有诱导肿瘤细胞凋亡[6],抑制胃酸分泌,治疗胃溃疡等作用[7],其中三叶豆紫檀苷和马卡因可抑制白血病HL-60细胞[8],芒柄花素具有抑制过敏性炎症和抗宫颈癌等作用[9-10]。因此,山豆根的整体药效是山豆根中多种有效成分共同作用的宏观反映,山豆根的内在质量由多种有效成分的含量高低共同决定。目前,对于山豆根的质量评价和质量控制,主要以生物碱类成分苦参碱和氧化苦参碱的含量作为评价指标[11-14],对于同时测定多种黄酮和生物碱类成分含量的研究报道较为少见。本研究建立了HPLC同步测定7种生物碱(金雀花碱、槐醇、槐果碱、苦参碱、氧化槐果碱、氧化苦参碱、N-甲基金雀花碱)和3种黄酮(三叶豆紫檀苷、芒柄花素及马卡因)含量的分析方法,并对山豆根药材的质量进行了分析与评价,可为山豆根药材的全面质量控制提供科学依据。
1 材料
Waters Alliance 2695高效液相色谱仪(美国Waters公司);BT 125D型1/10万电子天平(赛多利斯科学仪器有限公司);BSA 2224S-CW型1/1万电子天平(赛多利斯科学仪器有限公司);JA1003型1/1000电子天平(上海良平仪器有限公司);B2510E-DTH型超声波清洗仪(美国Bransonic公司);DET-50型号高速万能粉碎机(温岭市大德中药机械有限公司)。
氧化苦参碱(批号PSO187-0020,纯度>98.5%)、苦参碱(批号PSO986-0025,纯度>99.0%)和芒柄花素(批号PSO215-0025,纯度>98.0%)购自成都普斯生物科技有限公司;金雀花碱(批号J-008-160311,纯度>98.0%)、N-甲基金雀花碱(批号J-008-160311,纯度>98.0%)、槐果碱(批号H-031-140729,纯度≥98.0%)、三叶豆紫檀苷(批号S-061-150924,纯度>98.0%)和马卡因(批号M-030-150731,纯度>98.0%)购自成都瑞芬思生物科技有限公司;槐醇(批号CFS201601,纯度≥98.0%)购自武汉天植化学生物科技有限公司;氧化槐果碱(批号Z1856B3547,纯度≥98.0%)购自广州隽沐生物科技有限公司。甲醇和乙腈为色谱纯(赛默飞世尔科技有限公司),醋酸铵、浓氨水和二氯甲烷均为分析纯(国药集团化学试剂有限公司),水为娃哈哈纯净水。
实验用山豆根药材8批,于2016年收集,其中江西产山豆根1批(JX-1),贵州产山豆根1批(GZ-1),广西产山豆根6批(GX-1,GX-2,GX-3,GX-4,GX-5和GX-6),经中国中医科学院中药研究所何希荣老师鉴定为山豆根S. tonkinensis 的干燥根和根茎。
2 方法和结果
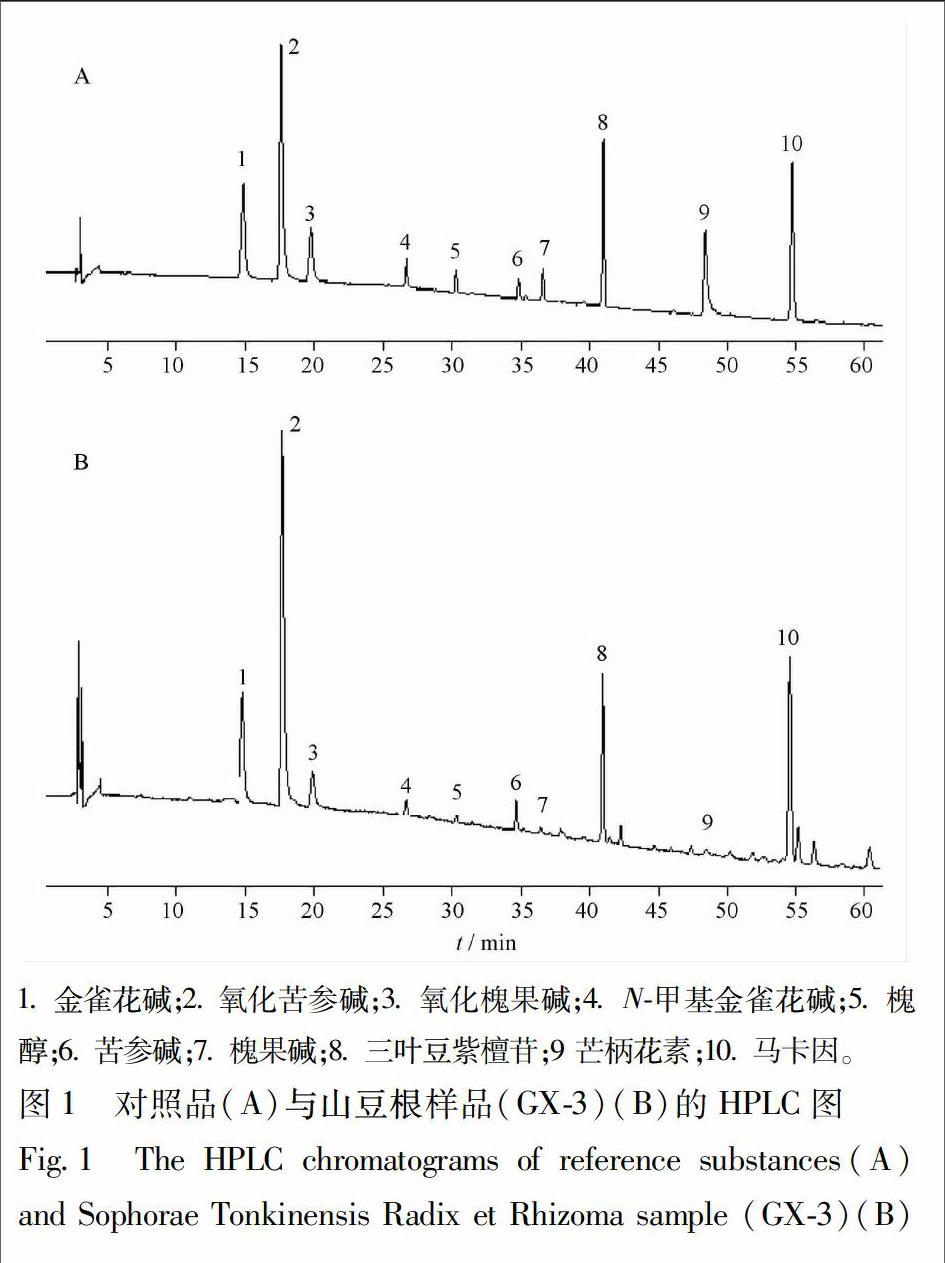
2.1 色谱条件 采用Welch Xtimate TM C18(4.6 mm × 250 mm,5 μm)色谱柱;流动相为乙腈(A)- 0.01 mol·L-1醋酸铵(氨水调pH 8.0)溶液(B)进行梯度洗脱,梯度洗脱程序:0~20 min,4%~14% A;20~30 min,14%~25% A;30~45 min,25%~40% A;45~65 min,40%~55% A;65~75 min,55% A;流速1.0 mL·min-1,柱温30 ℃,检测波长225 nm。在上述色谱条件下,样品中金雀花碱、氧化苦参碱、氧化槐果碱、N-甲基金雀花碱、槐醇、苦参碱、槐果碱、三叶豆紫檀苷、芒柄花素和马卡因色谱峰的保留时间与对照品保持一致,10种成分的色谱峰能达到较好的分离,且纯度检查符合要求,样品中其它成分对待测成分的测定无干扰。对照品及典型的山豆根样品的HPLC图见图1。
2.2 对照品储备溶液的制备 分别取各对照品适量,精密称定,用甲醇配制成含40.3 mg·L-1金雀花碱、 427.2 mg·L-1氧化苦参碱、106.7 mg·L-1氧化槐果碱、 27.2 mg·L-1 N-甲基金雀花碱、 28.4 mg·L-1槐醇、51.9 mg·L-1苦参碱、23.3 mg·L-1槐果碱、58.5 mg·L-1三叶豆紫檀苷、18.1 mg·L-1芒柄花素和52.8 mg·L-1马卡因的混合对照储备溶液。
2.3 供试品溶液的制备 取药材粉末(过50目筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入二氯甲烷-40%氨水(25∶1)的混合溶液25 mL,密塞,称定质量,超声处理(功率250 W,频率40 kHz)20 min,放冷,称重,用混合溶液补足减失的质量,摇匀,滤过;精密量取续滤液10 mL,水浴挥干,残渣加入甲醇适量使溶解,转移至10 mL量瓶中,加甲醇至刻度,摇匀,过0.45 μm微孔滤膜,取续滤液,即得。
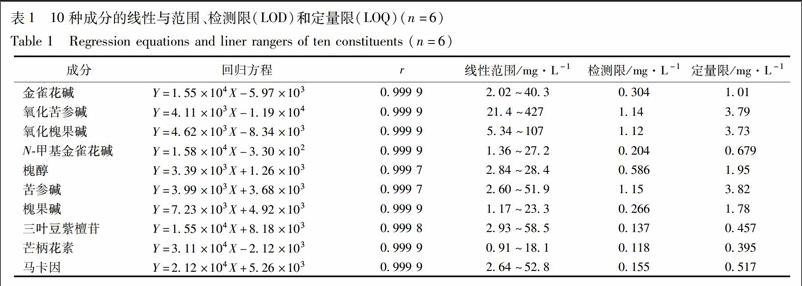
2.4 线性与范围、检测限(LOD)和定量限(LOQ) 分别精密吸取2.2项下混合对照品储备溶液0.5,1.0,2.0,4.0,6.0,8.0,10 mL,置10 mL量瓶中,甲醇定容至刻度,摇匀,配制成系列浓度的对照品溶液。取各个浓度的混合对照品溶液各10 μL注入液相色谱仪,按2.1项下色谱条件测定峰面积。以峰面积为纵坐标(Y),对照品浓度(mg·L-1)为横坐标(X),绘制标准曲线,计算回归方程及相关系数(r);同法逐级稀释,分别以S/N=3和S/N=10的进样浓度确定检测限(LOD)和定量限(LOQ),结果见表1。结果表明,各待测物在各自浓度范围内线性关系良好,检测限为0.118~1.15 mg·L-1,定量限为0.395~3.82 mg·L-1。
2.5 精密度考察 取同一中等浓度的混合对照品溶液,按2.1项下色谱条件连续进样6次,测定峰面积,计算峰面积的RSD。结果显示,金雀花碱、氧化苦参碱、氧化槐果碱、N-甲基金雀花碱、槐醇、苦参碱、槐果碱、三叶豆紫檀苷、芒柄花素和马卡因峰面积的RSD分别为1.8%,0.65%,1.9%,0.71%,2.3%,1.7%,1.8%,1.3%,1.9%,0.94%,表明仪器的精密度良好。
2.6 稳定性考察 取同一份供试品溶液,分别于配制后0,2,4,6,8,12 h进样,测定峰面積,计算峰面积的RSD。结果显示,金雀花碱、氧化苦参碱、氧化槐果碱、N-甲基金雀花碱、槐醇、苦参碱、槐果碱、三叶豆紫檀苷、芒柄花素及马卡因峰面积的RSD分别为2.9%,2.2%,2.7%,2.7%,1.9%,2.7%,2.6%,1.8%,2.9%,2.4%,表明供试品溶液在12 h内稳定性良好。
2.7 重复性考察 取同一批次的山豆根样品(GX-3)约0.5 g,共6份,按照2.3项下方法制备供试品溶液,精密吸取供试品溶液10 μL进样,测定峰面积,计算含量。结果显示,金雀花碱、氧化苦参碱、氧化槐果碱、N-甲基金雀花碱、槐醇、苦参碱、槐果碱、三叶豆紫檀苷、芒柄花素和马卡因含量的RSD分别为1.8%,2.9%,1.6%,1.2%,2.1%,2.4%,1.5%,1.6%,2.4%,2.9%,表明重复性良好。
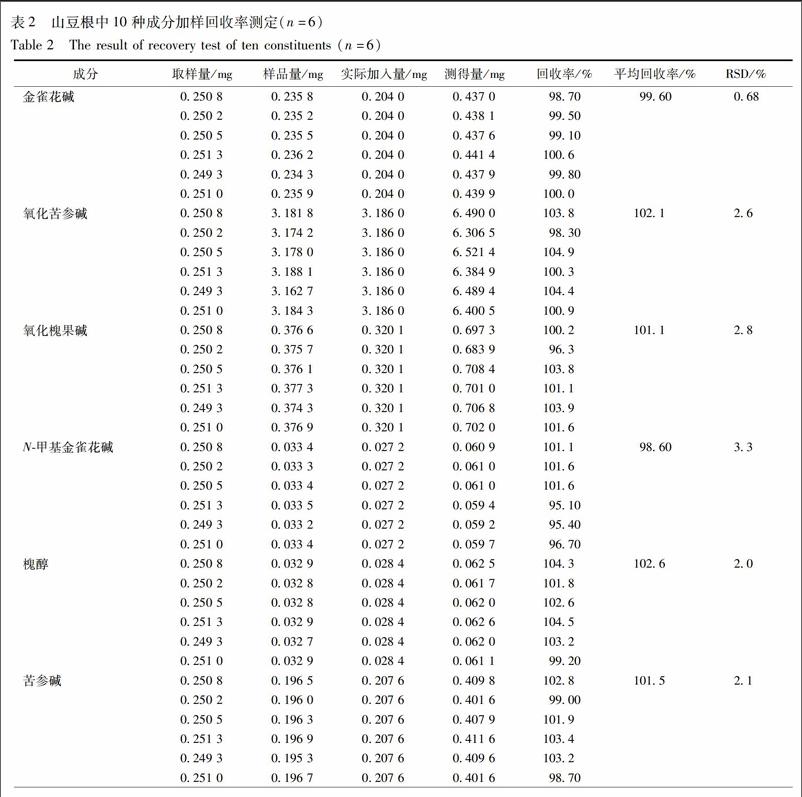
2.8 加样回收率考察 取已知含量的同一批次的山豆根样品(GX-3)约0.25 g,共 6 份,分别加入对照品適量,按照2.3项下方法制备供试品溶液,按照2.1项下的色谱条件进行含量测定,计算10种成分的平均回收率及RSD,结果见表2。10种待测成分的平均回收率在98.60%~102.6%,RSD均小于4.0%,表明方法的准确度良好。
2.9 样品的含量测定 取各山豆根样品粉末,按照2.3项下方法制备供试品溶液,每个样品平行2份,并按照2.1项下的色谱条件进行测定,计算各山豆根样品中10种成分的含量,含量测定结果见表3。
3 讨论
本研究建立了HPLC测定山豆根中金雀花碱、槐醇、槐果碱、苦参碱、氧化槐果碱、氧化苦参碱、N-甲基金雀花碱等7种生物碱及三叶豆紫檀苷、芒柄花素、马卡因等3种黄酮含量的方法,该方法简便,准确,重复性良好。采用该法,对不同批次的山豆根样品进行了测定。
3.1 供试品溶液制备方法的考察 实验考察了水浴回流法和超声法2种提取方法对待测成分的提取效果,结果表明2种提取方法的提取效率无显著性差异,考虑到实验的简便易行,最终选择超声提取法;比较了甲醇-氨水、三氯甲烷-氨水、三氯甲烷-甲醇-氨水、二氯甲烷-氨水4种混合溶液的提取效率,结果表明含有甲醇的混合溶液的提取效率较低且杂质干扰严重,三氯甲烷-氨水和二氯甲烷-氨水混合溶液的提取效率最高且二者无显著性差异,故选择了毒性较小的二氯甲烷-氨水混合溶液作为提取溶剂。此外,实验考察了超声时间(20,30,40 min)和氨水浓度(40%,50%,100%)对提取效率的影响,最终选择了以二氯甲烷-40%氨水(25∶1)为提取溶剂,超声提取20 min作为供试品的提取条件。
3.2 色谱柱,流动相及检测波长的选择 实验考察了Welch Ultimate XB-NH2柱,Welch Ultimate XB-C18柱,Welch XtimateTM-C18柱和Topsil-C18柱等4种色谱柱对各待测成分的分离效能,结果表明使用Welch XtimateTM-C18柱可以获得较为平稳的基线,且各待测成分的峰形较好,故选择该柱作为分离柱。比较了流动相为乙腈-水、乙腈-0.2%磷酸水溶液和乙腈-0.01 mol·L-1醋酸铵水溶液系统的分离效能,结果表明,以乙腈-0.01 mol·L-1醋酸铵水溶液为流动相,其色谱图的基线较为平稳,各色谱峰的拖尾因子在0.95~1.05;通过优化梯度洗脱条件,10种待测成分能达到较好的分离且纯度检查符合要求,故选择乙腈-0.01 mol·L-1醋酸铵水溶液作为流动相的梯度洗脱系统。采用二极管阵列检测器,于190~400 nm波长对10种待测成分进行全波长扫描,结果表明10种成分在225 nm处均有较大吸收,且色谱图的基线较为平稳,故选择225 nm作为检测波长。
3.3 测定结果分析 本实验对不同产地不同批次的山豆根药材中10种成分的含量进行了测定,由含量测定结果可知,8批药材中苦参碱和氧化苦参碱的总量在7.15~13.5 mg·g-1,符合2015年版《中国药典》一部对于山豆根药材中苦参碱和氧化苦参碱的总含量要求(苦参碱和氧化苦参碱的总量≥0.7%),表明以上8批山豆根药材均符合中国药典的质量要求。8批药材中,7种生物碱类成分的质量分数之和为10.5~16.3 mg·g-1,3种黄酮类成分的质量分数之和为1.06~2.32 mg·g-1,10种成分的质量分数之和为12.2~18.7 mg·g-1,不同批次的山豆根药材中生物碱和黄酮类成分的质量分数之和具有较大差异。GX-3样品中苦参碱的质量分数为12.7 mg·g-1,氧化苦参碱的质量分数为0.784 mg·g-1,而GZ-1样品中苦参碱的质量分数为1.99 mg·g-1,氧化苦参碱的质量分数为5.89 mg·g-1,山豆根中氧化苦参碱与苦参碱的含量呈现出此消彼长的关系。此外,表3的含量测定数据显示,GX-3样品中氧化槐果碱的含量是GX-1样品中的17.4倍,GX-6样品中N-甲基金雀花碱的含量是JX-1样品中的3.37倍,GX-4样品中槐醇的含量是GX-2样品中的12.5倍,GX-4样品中槐果碱的含量是JX-1样品中的18.1倍,GX-3样品中三叶豆紫檀苷的含量是JX-1样品中的5.64倍,GX-4样品中芒柄花素的含量是GX-1样品中的5.48倍,JX-1样品中三叶豆紫檀苷的含量是GX-1样品中的2.78倍。以上结果表明,10种成分在不同批次的山豆根药材中的含量差异显著,其内在质量差异较为明显,故对山豆根中的多种成分进行同步测定可以更加全面的反映山豆根的内在质量。
山豆根为有毒中药,据现有文献报道[2,5],山豆根中生物碱类成分既是有效成分亦是潜在的毒性成分,尤其以苦参碱和金雀花碱的毒性较强。如何建立山豆根中各种生物碱的含量与其药效及毒性的内在相关性,有待进一步研究。此外,山豆根中的生物碱类成分并非山豆根的专属性成分,比如苦参为无毒中药,但所含生物碱类成分却与山豆根十分相似。那么,山豆根中的其他类成分,比如黄酮类成分,是否与山豆根的毒性具有相关性,研究报道甚少,亦有待研究。
[参考文献]
[1] 中国药典.一部[S]. 2015:27.
[2] 王君明,崔瑛. 山豆根化学成分、药理作用及毒性研究进展[J]. 中国实验方剂学杂志,2011,14(4):229.
[3] 张凤玲,唐永,张景梅. 苦参碱、氧化苦参碱的药理作用及其制剂的研究进展[J].河南中医学院學报,2004,19(112):84.
[4] 丁佩兰.山豆根和苦参化学成分的比较研究[D].上海:复旦大学,2004.
[5] 郑丽娜,孙虎,谢元璋,等. 山豆根化学成分与功效、毒性相互关系的研究进展[J]. 食品与药品,2011,13(5):205.
[6] Kajimoto S,Takanashi N,Kaimoto T,et al. Sophoranone,extracted from a traditional Chinese medicine Shandougen,induces apoptosis in human leukemia U937 cells via formation of reactive oxygen species and opening of mitochondrial permeability transition pores [J]. Int J Cancer,2002,99(6):879.
[7] He C M,Cheng Z H,Chen D F. Qualitative and quantitative analysis of flavonoids in Sophora tonkinensis by LC/MS and HPLC [J]. Chin J Nat Medicines,2013,11(6): 690.
[8] Aratanechemuge Y,Hibasami H,Katsuzaki H,et al. Induction of apoptosis by maackiain and trifolirhizin (maackiain glycoside) isolated from sanzukon (Sophora subprostrate Chen et T. Chen) in human promyelotic leukemia HL-60 cells [J].Oncol Rep,2004,12 (6):1183.
[9] 王燕,陶羽,王晓钰,等. 芒柄花素抑制小鼠Th2型变应性接触性皮炎的机制分析[J]. 中国实验方剂学杂志,2016,22(10):88.
[10] Jin Y M,Xu T M,Zhao Y H,et al. In vitro and in vivo anti-cancer activity of formononetin on human cervical cancer cell line HeLa [J]. Tumor Biol,2014,35 (3):2279.
[11] 郝学志,刘臣,王新彦. HPLC法测定山豆根中苦参碱及氧化苦参碱的含量[J]. 黑龙江中医药,2002(3): 56.
[12] 马长华,曹天海. HPLC法测定山豆根中苦参碱和氧化苦参碱的含量[J]. 药物分析杂志,2000,20(6): 408.
[13] 李南,邓红,张蜀. UPLC法快速测定山豆根中氧化苦参碱和苦参碱的含量[J]. 今日药学,2012,22(6):347.
[14] 丁佩兰,郁韵秋,王钢力. RP-HPLC法评价山豆根药材质量[J]. 复旦学报,2004,31(2): 208.
[责任编辑 丁广治]
