分光光度法标定酵母超滤液浓度及其在脑膜炎球菌培养基优化过程中的应用
2017-04-17毕研伟肖红剑丁晨闫玲梅寸韡
毕研伟,肖红剑,丁晨,闫玲梅,寸韡
1.中国医学科学院&北京协和医学院 医学生物学研究所,云南 昆明 650118;2.云南省重大传染病疫苗研发重点实验室,云南 昆明 650118
分光光度法标定酵母超滤液浓度及其在脑膜炎球菌培养基优化过程中的应用
毕研伟1,2,肖红剑1,2,丁晨1,2,闫玲梅1,2,寸韡1,2
1.中国医学科学院&北京协和医学院 医学生物学研究所,云南 昆明 650118;2.云南省重大传染病疫苗研发重点实验室,云南 昆明 650118
目的:建立检测酵母超滤液浓度的方法,并探索适合A、C群脑膜炎球菌生长的无动物源性培养基中酵母超滤液的浓度。方法:通过全波长扫描及不同波长吸光度值的比较确定检测酵母提取物浓度的最佳波长;用3000 Da超滤膜超滤酵母提取物溶液,制备酵母超滤液并检测其性质;观察脑膜炎球菌在含不同批次酵母超滤液的半综合培养基中的生长情况,验证不同批次标化的酵母超滤液的稳定性;配制含不同浓度酵母超滤液的半综合液体培养基,观察A、C群脑膜炎球菌的生长情况。结果:通过全波长扫描及不同波长吸光度值的比较,确定了检测酵母提取物浓度的最佳波长为405 nm;采用3000 Da超滤膜超滤后的酵母超滤液不与CTAB产生沉淀,通过检测其D405nm值,可以确定酵母超滤液的浓度;从生长情况考虑,A、C群脑膜炎球菌半综合培养基中最优酵母超滤液浓度分别为4、2 mg/L。结论:建立了制备酵母超滤液及分光光度法标定酵母超滤液浓度的方法,确定了培养A、C群脑膜炎球菌半综合培养基中最优酵母超滤液浓度。
酵母提取物;分光光度法;酵母超滤液;脑膜炎球菌
流行性脑脊髓膜炎(简称流脑)是由脑膜炎球菌(Neisseria meningitides)引起的急性呼吸道传染病[1]。随着脑膜炎球菌多糖疫苗及多糖结合疫苗的广泛使用,流脑的发病率大为降低[2]。作为疫苗生产的脑膜炎球菌,对培养条件要求较高。目前国内流脑疫苗的生产过程中,菌种在培养过程中常使用含羊血培养基复苏菌种,发酵过程中采用含酸水解酪蛋白的液体培养基来提高多糖产量,这些均是动物源性材料。动物源性材料不但成分复杂不利于产品批次之间的质量稳定,而且一些新型的和未知的人畜共患病也可能因为漏检,成为潜在的疫苗污染物,因此避免使用动物源性材料进行疫苗生产是提高疫苗安全性的一个重要环节。在前期的研究中,我们采用无动物原性材料的培养基生产流脑疫苗,培养基的主要成分包括无机盐、氨基酸、葡萄糖和酵母提取物。在研究中发现酵母提取物为脑膜炎球菌的生长提供了丰富的氮源和营养因子,是脑膜炎球菌生长的限制因子。酵母提取物是将酵母通过质壁分离后,利用自身水解酶系完全自溶,再去除细胞壁和不溶性分子后的产品,其中含有多肽、氨基酸、核苷酸、B族维生素、微量元素及未完全分解的大分子蛋白、纤维葡聚糖和核酸等[3]。
目前,脑膜炎球菌多糖疫苗生产过程中大多采用Gotschlich法[4]来沉淀荚膜多糖,即使用十六烷基三甲基溴化铵(hexadecyltrimethylammonium bromide,CTAB)沉淀发酵液上清获得高分子量脑膜炎球菌荚膜多糖。CTAB是一种阳离子去污剂,具有从低离子强度溶液中沉淀大分子蛋白、核酸与酸性多聚糖的特性。WHO规程及现行《中华人民共和国药典》第三部[5]中均规定生产培养基中不能含有与CTAB产生沉淀的物质。实验中发现酵母提取物溶液中的大分子葡聚糖会与CTAB产生沉淀。因此,生产中既要去除能与CTAB产生沉淀的大分子,又要最大限度地保留酵母提取物的小分子营养物质。在本研究中,我们采用超滤法去除能与CTAB产生沉淀的大分子物质,同时保留了能维持脑膜炎球菌生长的营养因子。超滤必然会造成酵母提取物的浓度发生改变,而且每次超滤液回收率受多种因素的干扰,这极大地影响到下游发酵过程的批间稳定性。为了保证酵母超滤液浓度的稳定,也可以重新去除溶剂,再次称量干粉质量,但工艺繁琐。本研究中,我们采用全波长扫描法对酵母超滤液吸收波长进行初步研究,并对几个波长进行浓度验证,在固定波长下检测酵母超滤液浓度,保证了培养基中酵母超滤液浓度的含量均一,从而控制了疫苗生产的稳定性。
由于不同群脑膜炎球菌的性质不同,如何根据每个菌群的特点优化培养基,提高菌体和多糖发酵产率,对脑膜炎疫苗的生产非常重要[6]。酵母超滤液含有多肽、氨基酸、核苷酸、B族维生素、微量元素等丰富的营养物质,可为A、C群脑膜炎球菌的生长提供丰富的氮源和营养因子。我们根据A、C群脑膜炎球菌多糖疫苗的特性,检测了不同酵母超滤液浓度对A、C群脑膜炎球菌生长情况及产糖量的影响,进一步确定了A、C群脑膜炎球菌半综合培养基中最佳酵母提取物的含量。
1 材料与方法
1.1 材料
A、C群脑膜炎球菌由中国食品药品检定研究院提供,其中A群脑膜炎球菌保藏编号为29201,C群脑膜炎球菌保藏编号为29205;CTAB购自Sigma公司;酵母提取物购自BD公司;全波长紫外分光光度计为Perkin Elmer Uv/Vis spec⁃trometer lambda 35;3000 Da超滤膜购自Millipore公司;超滤仪为PALL Filtron。
1.2 配制半综合液体培养基的试剂与CTAB反应
向配制半综合液体培养基的无机盐溶液、氨基酸溶液、酵母提取物溶液中分别加入1%CTAB至终浓度为0.01%,观察是否有沉淀产生。
1.3 酵母提取物全波长扫描
配制浓度为0.1 g/L的酵母提取物溶液,用1 cm的石英比色杯,以双蒸水为对照,用紫外分光光度计进行全波长扫描,扫描波长为200~800 nm,扫描速度为240 nm/min,步长为1 nm,观察酵母提取物溶液的吸收峰。
1.4 不同波长不同浓度的酵母提取物吸收值测定
根据全波长扫描图谱,选择4个不同波长对不同酵母提取物的浓度进行检测:将酵母提取物配制成不同的浓度,在不同波长下检测各浓度的吸收值。以酵母提取物溶液的系列浓度(C)对吸光度(A)做直线回归,并绘制标准曲线。
1.5 酵母超滤液的制备及其性质检测
将酵母提取物配制成200 g/L,用3000 Da超滤膜超滤后,用分光光度计检测D405nm值,确定酵母超滤液的浓度。向酵母超滤液中加入CTAB至浓度为1%,观察产生沉淀的情况;用超滤后的酵母超滤液和未超滤的酵母提取物配制半综合液体培养基,接种A、C群脑膜炎球菌,观察超滤后酵母超滤液对A、C群脑膜炎球菌生长的影响。
1.6 A、C群脑膜炎球菌培养
将A、C群脑膜炎球菌接种于含不同浓度酵母超滤液的半综合培养基中,至初始D600nm值为0.06,37℃、160 r/min培养9 h,每小时取样测D600nm值,观察A、C群脑膜炎球菌的生长。
1.7 酵母超滤液稳定性验证
取3批按前述方法制备的酵母超滤液,按1.6的方法培养A、C群脑膜炎球菌,观察A、C群脑膜炎球菌的生长。
2 结果
2.1 不同试剂与CTAB的反应
向配制半综合液体培养基的无机盐溶液、氨基酸溶液、酵母提取物溶液中分别加入1%CTAB至终浓度为0.01%后,观察发现只有酵母提取物溶液会与CTAB产生沉淀。由于脑膜炎球菌多糖疫苗生产过程中使用CTAB沉淀细菌荚膜多糖,因此,需要对酵母提取物溶液进行优化去除能产生沉淀的物质。
2.2 酵母提取物全波长扫描确定最佳吸收峰波长
通过对酵母提取物溶液进行全波长扫描,发现波长小于500 nm时有明显的吸收峰,波长大于500 nm时吸收值显著降低(图1)。
2.3 通过不同波长不同浓度的酵母提取物吸收值的比较确定最佳检测波长
由于酵母提取物是混合物,在一定的波长范围内均有明显的吸收峰。为了能有效均一地确定酵母超滤液的浓度,选择4个不同的波长,即405、450、490、520 nm,将酵母提取物配制成浓度为2.5、5.0、10、20、40、80、160 mg/mL的溶液,检测不同浓度的吸收值是否呈线性。结果表明,在所选的4个波长处各浓度均呈很好的线性关系,但是由于波长越大其斜率越小,不同浓度的吸收值差别越小,即检测灵敏度越低。因此,本研究选用的检测波长为405 nm(图2)。
2.4 用3000 Da超滤膜超滤酵母提取物并确定其浓度

图1 酵母提取物溶液全波长扫描图谱
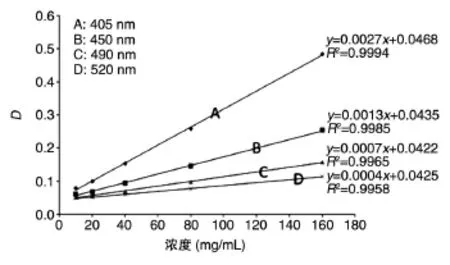
图2 不同浓度酵母提取物溶液在不同波长处的吸光度
用3000 Da超滤膜超滤后,向回流液中加入CTAB溶液至终浓度为1%,不会产生沉淀。用此超滤液配制半综合培养基,培养A、C群脑膜炎球菌,同样适合脑膜炎球菌的生长。表明用此方法获得的超滤液保留了脑膜炎球菌的生长所需要的营养成分,而且已去除了能与CTAB反应的大分子物质。
2.5 A、C群脑膜炎球菌生长的最佳酵母超滤液浓度确定
配制含不同浓度酵母超滤液(培养A群脑膜炎球菌的半综合培养基中酵母超滤液的浓度分别为1.2、2.4、3.6、4.8、6 g/L,培养C群脑膜炎球菌的半综合培养基中酵母超滤液的浓度分别为1、2、3、4、5、6 g/L),培养结果表明(图3),当酵母超滤液浓度为1.2 g/L时,A群脑膜炎球菌在第6 h到达平台期,且D600nm值最低,随着酵母超滤液浓度的不断增加,A群脑膜炎球菌生长速率和达到平台期的菌量也会增加,但酵母超滤液浓度从3.6到6 g/L培养9 h,达到平台期时D600nm值差别不明显,因此,从节约生产成本和生长情况两方面考虑,A群脑膜炎球菌培养时培养基中酵母超滤液的最佳浓度为4 g/L。对C群脑膜炎球菌而言,酵母超滤液浓度从2到6 g/L培养9 h,达到平台期时D600nm值差别不明显,因此,C群脑膜炎球菌培养时培养基中酵母超滤液的最佳浓度为2 g/L。
2.6 酵母超滤液稳定性验证
取3批酵母超滤液(批号为201501、201502、201503),在405 nm处测定其浓度,配制成浓度分别为4和2 g/L的半综合培养基,培养A、C群脑膜炎球菌。结果(图4)显示,A、C群脑膜炎球菌在3批酵母超滤液配制的半综合培养基中的生长情况相同,达到平台期的时间及D600nm值基本一致。因此,用分光光度法标定酵母超滤液浓度的方法稳定性良好,从而保证了脑膜炎球菌疫苗各批次之间的稳定性。

图3 A、C群脑膜炎球菌在含不同酵母超滤液的半综合培养基中的生长

图4 A、C群脑膜炎球菌在含不同批次酵母超滤液培养基中的生长
3 讨论
近年来,社会公众对疫苗质量安全的关注度逐年提高,加速新方法的研发,确保疫苗更加安全已成为疫苗产业的发展趋势。在脑膜炎球菌多糖疫苗生产过程中,我们采用无动物源性的半综合培养基扩增培养脑膜炎球菌。在此培养基中酵母提取物是惟一成分尚未完全明确的营养物质,是脑膜炎球菌生长的限制因子,但酵母提取物中的葡聚糖会与CTAB反应产生沉淀,不能直接应用到生产中。虽然已有市售的超滤型酵母提取物,但价格昂贵,且不同厂家采用不同分子量的超滤膜制备超滤液,限制了其在工业生产中的应用。许多研究者采用超滤、柱层析及乙醇沉淀等方法对酵母提取物的不同组分进行分析,发现酵母提取物中的活性成分主要是相对分子质量小于1000的小分子物质[7-8]。本着既能去除与CTAB反应的大分子物质,又能最大限度地保留酵母提取物中的活性成分的原则,本研究中我们采用3000 Da的超滤膜对酵母提取物溶液进行超滤,超滤后的酵母超滤浓缩液同样适合脑膜炎球菌的生长,同时还有效去除了能与CTAB产生沉淀的大分子物质,满足了脑膜炎球菌多糖疫苗的生产需求。
目前,酵母提取物作为一种非动物源性的营养物质被广泛用于细菌、真菌、哺乳动物和昆虫细胞的培养过程中[9-10],但酵母提取物中的具体成分并未完全明晰。我们在研究中还发现每批酵母提取物之间成分差异较大,直接影响了脑膜炎球菌的产糖量。因此,建立一种简单快速的检测酵母超滤液中生物活性分子浓度的方法至关重要。本研究采用了分光光度法检测酵母超滤液的浓度。全波长扫描图谱显示,酵母提取物在波长小于500 nm时有很强的吸收峰,由于波长越短杂质对吸收峰的干扰越大,为了减少干扰,我们选择可见光区4个波长对酵母提取物溶液浓度进行检测,随着波长的增加,相同样品的吸收值却不断减小,为了增加检测的灵敏度,选择在405 nm处检测酵母超滤液的浓度,并对每批酵母超滤液浓度进行标化。培养基的均一性对脑膜炎球菌的生长及产糖量非常重要,直接影响脑膜炎球菌疫苗的生产质量及各批次之间的稳定性。为了验证分光光度法标化的酵母超滤液的稳定性及方法的可靠性,我们采用3批标化的酵母超滤液培养脑膜炎球菌,结果生长情况相同,这表明用分光光度法标定酵母超滤液浓度的方法稳定性良好。
由于不同群的脑膜炎球菌的性质不同,如何优化培养基,提高菌体和多糖发酵产率,对脑膜炎疫苗的生产非常重要。通过对不同酵母超滤液浓度的研究,从A、C群脑膜炎球菌生长情况来分析,确定了培养A、C群脑膜炎球菌的酵母超滤液的最佳浓度。对不同型别脑膜炎球菌无动物源性培养基的建立,将为现有疫苗质量的提高奠定一定的基础。
[1]Weichselbaum A.Ueber die aetiologie der akuten men⁃ingitis cerebro-spinal[J].Fortschr Med,1887,(5):573-583.
[2]时宇,王建华.脑膜炎球菌疫苗研究现状和展望[J].现代中西医结合杂志,2009,18(16):1958-1961.
[3]Zhang J Y,Reddy J,Buckland B,et al.Toward con⁃sistent and productive complex media for industrial fer⁃mentations:Studies on yeast extract for a recombinant yeast fermentation process[J].Biotechnol Bioeng,2003, 82(6):640-652.
[4]Gotschlich E C,Liu T Y,Artenstein M S.Human im⁃munity to the meningococcus.3.Preparation and im⁃munochemical properties of the group A,group B, and group C meningococcal polysaccharides[J].J Exp Med,1969,129(6):1349-1365.
[5]中国药典委员会.《中华人民共和国药典》第三部[S]. 2015.
[6]赵铠,章以浩,李和民.医学生物制品学[M].2版.北京:人民卫生出版社,2007:511-534.
[7]Mendonça R Z,Oliveira E C,Pereira C A,et al.Ef⁃fect of bioactive peptides isolated from yeastolate,lact⁃albumin and NZCase in the insect cell growth[J].Bio⁃process Biosyst Eng,2007,30:157-164.
[8]Shen C F,Kiyota T,Jardin B,et al.Characterization of yeastolate fractions that promote insect cell growth and recombinant protein production[J].Cytotechnology, 2007,54:25-34.
[9]Sung Y H,Lim S W,Chung J Y,et al.Yeast hydro⁃lysate as a low-cost additive to serum-free medium for the production of human thrombopoietin in suspen⁃sion cultures of Chinese hamster ovary cells[J].Appl Microbiol Biot,2004,63:527-536.
[10]Kim D Y,Lee J C,Chang H N,et al.Development of serum-free media for a recombinant CHO cell line producing recombinant antibody[J].Enzyme Microb Tech,2006,39:426-433.
Optimization of Fermentation Medium for Neisseria menin⁃gitidis with Quantified Ultrafiltered Yeast Extract Solution by Spectrophotometry
BI Yan-Wei1,2,XIAO Hong-Jian1,2,DING Chen1,2,YAN Ling-Mei1,2,CUN Wei1,2*
1.Institute of Medical Biology,Chinese Academy of Medical Sciences&Peking Union Medical College,Kunming 650118;2.Yunnan Key Laboratory of Vaccine Research and Development of Severe Infectious Disease,Kunming 650118;China
Objective:To develop a method for determination of ultrafiltered yeast extract(UYE)content,and find the UYE in animal-free medium suitable for group A and group C Neisseria meningitidis.Methods:The opti⁃mum absorbance wavelength of yeast extract solution was determined by comparing different wavelength absorbance values out of full wavelength scanning.Yeast extracts(YE)were fractionated by ultrafiltration(UF)with 3000 Da molecular weight cutoff membranes to prepare UYE,and then the properties of UYE were tested,the stability of different batches of UYE was validated by observing the growth of N.meningitidis in the semi-synthetic mediumcontaining different batches of UYE.The growth of A group and C group N.meningitidis was observed in the pre⁃pared semi-synthetic liquid medium containing different concentrations of UYE.Results:The optimum detection wavelength for YE concentration was 405 nm.There was no precipitant when CTAB was added into the UYE. The UYE could be determined at 405 nm.The best concentration of UYE was 4 g/L for group A N.meningitidis, and 2 g/L for group C N.meningitidis.Conclusion:We have developed the UYE preparation and UYE quantifica⁃tion spectrophotometry method,and also determined the best concentration of UYE in the semi-synthetic medium for group A and group C N.meningitidis.
yeast extract;spectrophotometric method;ultrafiltered yeast extract;Neisseria meningitidis
Q502
A
1009-0002(2017)02-0118-05
10.3969/j.issn.1009-0002.2017.02.010
2016-10-31
北京协和医学院“协和青年基金”(3332015148)
毕研伟(1980-),女,助理研究员
寸韡,(E-mail)Cunwei@foxmail.com
*Corresponding anthor,E-mail:Cunwei@foxmail.com
