速效氮对叶色突变体谷子苗期光合生理的影响
2017-04-14杨宗鹏聂磊云胡晓雪
袁 蕊,杨宗鹏,聂磊云,胡晓雪,李 萍
(1.山西农业大学农学院,山西太谷030801;2.乡宁县农业局,山西乡宁042100;3.山西省农业科学院果树研究所,山西太谷030800)
速效氮对叶色突变体谷子苗期光合生理的影响
袁 蕊1,杨宗鹏2,聂磊云2,胡晓雪1,李 萍1
(1.山西农业大学农学院,山西太谷030801;2.乡宁县农业局,山西乡宁042100;3.山西省农业科学院果树研究所,山西太谷030800)
叶色突变体具有易于辨识的表型,在理论研究和实际应用方面都具有重要价值。对EMS诱变的晋谷21号突变体库中筛选获得叶色突变体进行叶面喷施速效氮肥试验。结果表明,速效氮使叶色突变体谷子的净光合速率(Pn)增加了78.58%、水分利用率(WUE)增加了57.34%,但气孔导度(Gs)、蒸腾速率(Tr)、胞间CO2浓度(Ci)均没有显著变化;叶色突变体谷子叶片光系统II最大的(潜在)光化学量子效率(Fv/Fm)、叶片光系统II有效光化学量子效率(Fv′/Fm′)、光系统II实际光化学量子效率(ΦPSI)I和电子传递速率(ETR)分别比对照增加了33.06%,28.89%,15.88%,15.88%,光化学淬灭系数(qP)和非光化学淬灭系数(qN)无显著变化;速效氮能增加叶色突变体谷子叶绿素a、叶绿素b以及叶绿素a+b的含量,但类胡萝卜素施肥处理与对照间差异不明显。总之,速效氮能够提高叶色突变体谷子的光合作用,改善叶色突变带来的不利影响,从而促进生长。
速效氮;叶色突变体谷子;苗期;光合生理;叶绿素荧光参数
谷子(Setaria italica)是我国最古老的旱作粮食作物之一,为华夏民族几千年来的传统主食,含有丰富的氨基酸、维生素类及钙铁等微量元素,且其氨基酸含量高于其他禾谷类作物[1]。晋谷21号,原名晋汾7号,是山西省农业科学院经济作物研究所利用钴60γ射线辐射晋汾52号干种子选育而成。晋谷21号诱变育成后,20多年来一直被公认为顶级米质品种,以晋谷21号为原料生产加工出的小米,熬成的小米粥味道香浓且适口品质好,不仅含有丰富的氨基酸和微量元素,还具有抗癌、防衰老的作用,曾5次获全国农业博览会优质谷米金奖[2-3]。虽然山西有一大批中晚熟品种在抗病性、抗旱性、抗倒伏性、产量水平等方面较晋谷21号有显著优势,但因其品质不及晋谷21号而未得到大面积推广,晋谷21号在生产上仍占主导地位[4-5]。
EMS(甲基磺酸乙酯)作为一种有效的化学诱变剂,具有成本低、操作简单、诱变率高等特点,已被广泛应用在玉米[6]、水稻[7]、小麦[8]等农作物的诱变育种工作中。利用EMS诱导谷子突变,可创造全新的遗传类型,丰富谷子种质资源。深入研究突变体谷子的生理,有利于提高谷子生长潜力,增加谷子产量。因此,利用EMS诱变晋谷21号,构建谷子突变体库,以充分利用优异品质基因资源,加速谷子品质育种进程,也可为谷子的研究奠定基础[9-10]。
谷子叶色突变体,其主要特点是叶色表型发生变化,影响叶绿素的合成,改变叶绿素含量,使叶色出现黄化、白化、色浅、条纹等不同症状[11-13]。植物光合作用主要在植物叶片中进行,研究证明,叶色突变体能一定程度上决定光合效率[14]。元素氮对作物生长起着非常重要的作用,是植物进行光合作用起决定性的叶绿素组成部分。
本试验就速效氮对经EMS诱变的晋谷21号叶色突变体进行光合生理研究,以期能为丰富谷子育种材料及探索叶色突变体的突变机制奠定基础。
1 材料和方法
1.1 试验地概况
试验在山西农业大学进行,该地位于山西省晋中市太谷县(37.42°N,112.58°E)。供试用土壤为沙、土、基质(体积比为1∶10∶10),有机质含量2.37%,全N含量1.12 g/kg,速效N含量45.28 mg/kg,速效P含量25.65 mg/kg,速效K含量280.5 mg/kg,混匀。
1.2 试验材料
从山西农业大学晋谷21号EMS突变体试验田中,观察发现有植株从苗期开始表现出叶色黄化现象。谷子成熟时,单独收获叶色黄化的植株,晾干后,对这些叶色黄化的植株进行脱粒,将种粒装于牛皮纸袋中备用。
1.3 试验设计
谷子播种于长×宽×高为25 cm×25 cm×30 cm花盆中,且底部有排水孔,装土25 cm深,将种子均匀地播撒在花盆中,然后覆土2 cm左右,共6盆。出苗后,叶片达到3~4片时,分别进行H2O处理(每盆喷施200 mL的蒸馏水,CK)和速效氮肥处理(每盆喷施200 mL的氮肥,2 g速效氮溶于200 mL蒸馏水中),每个处理3次重复。每15 d施肥一次。
1.4 测定内容及方法
1.4.1 光合作用的测定 在播种后第28天,叶片达到8~9片时,每盆分别选取有代表性的叶色突变体谷子6株,测定完全展开的幼嫩功能叶。用便携式光合气体分析系统(Li 6400,Li-Cor Inc,Lincoln NE,USA)进行测定,设置红蓝光源,光强1 400 μmol/(m2·s),叶室温度25℃。记录净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr),计算水分利用效率(WUE,WUE=Pn/Tr),测定时间为9:00—12:00[15]。1.4.2 叶绿素荧光参数的测定 播种后第28天,叶片达到8~9片时,每盆分别选取有代表性的叶色突变体谷子6株,测定完全展开的幼嫩功能叶。将便携式光合气体分析系统(Li 6400,Li-Cor Inc,Lincoln NE,USA)换为叶绿素荧光叶室,光强1 400 μmol/(m2·s),叶室温度25℃。先测量光反应,然后用锡纸把叶片包裹至少20 min,再进行暗反应的测定。记录叶绿素初始荧光(F0)、最大荧光(Fm),光下最小荧光(F0′)和光下最大荧光(Fm′)、稳态荧光(Fs),并计算出光系统II最大的(潜在)光化学量子效率(Fv/Fm)、光系统II有效光化学量子效率(Fv′/Fm′)、叶片光系统II实际光化学量子效率(ΦPSII)、光化学淬灭系数(qP)、非光化学淬灭系数(qN)、电子传递速率(ETR)等叶绿素荧光参数,测定时间为9:00—12:00[16]。
1.4.3 光合色素含量的测定 播种12 d后,谷子叶片达到3~4片时,开始第1次喷施速效氮,以后每15 d喷施一次。叶片喷施速效氮后约7 d取材,连续取材6次,每盆分别选取有代表性的叶色突变体谷子6株,取完全展开的幼嫩功能叶,测定旗叶色素含量,取平均值,方法参照文献[17]进行。
1.5 数据处理
数据的整理和图表的绘制均采用Excel;显著性检验采用SPSS软件,其中P<0.05水平的视为显著,P<0.01水平的视为极显著。
2 结果与分析
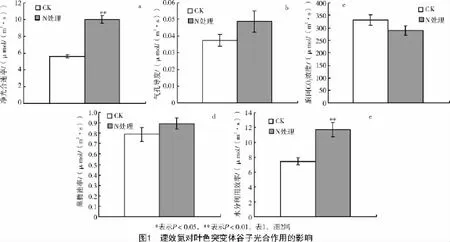
2.1 速效氮对叶色突变体谷子光合作用的影响
由图1可知,速效氮使叶色突变体谷子净光合速率(Pn)和水分利用率(WUE)分别比CK增加了78.58%(图1-a)和57.34%(图1-e);胞间CO2浓度(Ci)(图1-c)、气孔导度(Gs)(图1-b)、蒸腾速率(Tr)(图1-d)均没有明显变化。
2.2 速效氮对叶色突变体谷子叶绿素荧光动力参数的影响
从表1可以看出,叶色突变体谷子叶片光系统II最大的(潜在)光化学量子效率(Fv/Fm)和叶片光系统II有效光化学量子效率(Fv′/Fm′)分别比对照极显著增加了33.06%和28.89%;光系统II实际光化学量子效率(ΦPSII)和电子传递速率(ETR)均比对照显著增加了15.88%;光化学淬灭系数(qP)和非光化学淬灭系数(qN)无显著变化。

表1 速效氮对叶色突变体谷子叶绿素荧光动力参数的影响
2.3 速效氮对叶色突变体谷子光和色素的影响

从图2可以看出,速效氮能增加叶色突变体谷子叶绿素a、叶绿素b以及叶绿素a+b的含量,其中,叶绿素a含量在第47天极显著增加了76.13%(图2-a);叶绿素b含量在第33天显著增加了42.08%(图2-b);叶绿素a+b总含量在第47天极显著增加了64.60%(图2-c);类胡萝卜素含量无明显变化(图2-d)。
3 讨论
氮素是叶绿素的组成成分,叶绿素a、叶绿素b都是含氮化合物。绿色植物进行光合作用,使光能转变为化学能都是借助于叶绿素的作用。氮也是植物体内维生素和能量系统的组成部分,是影响植物正常生长发育的重要营养因子[18]。许多研究表明,叶片的氮含量与光合能力呈正相关性[19-20]。本研究结果表明,速效氮使叶色突变体谷子净光合速率(Pn)、水分利用率(WUE)、气孔导度(Gs)、蒸腾速率(Tr)均有不同程度的增加,但胞间CO2浓度(Ci)减少,说明增施氮肥可以提高谷子旗叶对胞间CO2的同化能力,因此,合理喷施速效氮能提高叶色突变体的光合能力。
叶绿素荧光动力学是以植物体内存在的叶绿素荧光作为检测对象来观测植物体的生理状况,其中,光系统II的最大量子产量(Fv/Fm)反映了植物潜在的最大光合能力,Fv′/Fm′是指光下开放状态的PSII反应中心的激发能捕获效率,光系统II的实际量子产量(ΦPSII)是表示植物光合能力的一个重要指标,电子传递效率(ETR)是与光照强度密切相关,光化学淬灭系数(qP)和非光化学淬灭系数(qN)是植物叶绿体能量耗散的途径之一[21-23]。叶色突变体谷子幼苗叶片各荧光参数对施氮处理反应明显,其中,叶片Fv/Fm,Fv'/Fm',ΦPSII,ETR,qP和qN均随施氮量的增加而升高,表明速效氮能提高叶色突变体谷子幼苗光化学效率,促进光合电子传递,提高光合利用效率。叶绿素是最重要的光合色素之一,能反映植物光合能力[24]。速效氮能增加叶色突变体谷子幼苗叶片叶绿素含量,叶片吸光强度和叶肉细胞光合活性增强,最终使净光合速率增加。
综上所述,速效氮能提高叶色突变体谷子幼苗叶片的气体交换系数及叶绿素荧光参数等,增强叶色突变体谷子幼苗期的光合作用和生产力,促进植株生长,可为叶色突变体谷子苗期管理提供参考。
[1]史更生,史关燕,史乾,等.晋谷21号优良品质的分析与研究[J].杂粮作物,2001,21(4):18-19.
[2]习现民.中国谷子产业与产业技术体系[M].北京:中国农业科学技术出版社,2011:52-58.
[3]王玉文,王彦龙,田岗,等.对我省谷子品质改良的思考[J].山西农业科学,2004,32(1):13-17.
[4]田岗,王玉文,李会霞,等.山西省谷子产业现状及发展对策[J].山西农业科学,2013,41(3):299-300.
[5]樊修武,池宝亮,张冬梅,等.谷子杂交种灌浆期光合性能研究[J].山西农业科学,2011,39(3):227-229.
[6]石海春,谭义川,夏伟,等.19份玉米EMS诱变系的遗传差异评价[J].华北农学报,2016,31(1):110-116.
[7]王峰,徐飚,杨正林.EMS诱变水稻矮生资源的鉴定评价[J].核农学报,2011,25(2):197-201.
[8]张维宏,安哲,范学锋,等.EMS诱导小麦TcLr19感叶锈病突变体的筛选[J].华北农学报,2016,31(4):88-93.
[9]刘美桃.晋谷21 EMS突变体库的构建与特征分析[D].太谷:山西农业大学,2014.
[10]郭建秋,雷全奎,杨小兰,等.植物突变体库的构建及突变体检测研究进展[J].河南农业科学,2010(10):150-155.
[11]HIROKI S,KENSUKE K,YUZURU T,et al.The virescent-2 mutation inhibits translation of plastid transcripts for the plastid genetic system at an early stage of chloroplast differentiation[J]. Plant cell physiology,2004,45(8):958-996.
[12]IHNATOWICZ A,PESARESI P.Mutants for photosystem I subunit D of Arabidopsis thaliana:effects on photosynthesis,photosystem I stability and expression of nuclear genes for chloroplast functions [J].Plant Journal,2004,37(6):839-852.
[13]NAGATA N,TANAKA R,SATOTH S,et al.Identification of a vinyl reductase gene for chlorophyll synthesis in Arabidopsis thaiiana and implications for the evolution of Pro chlorococus species[J].Plant cell,2005,17(1):233-240.
[14]曹莉,王辉,孙道杰,等.小麦黄化突变体光合作用及叶绿素荧光特性研究[J].西北植物学报,2006,26(10):2083-2087.
[15]郝兴宇,李萍,林而达,等.大气CO2浓度升高对谷子生长发育与光合生理的影响[J].核农学报,2010,24(3):589-593.
[16]王晨光,郝兴宇,李红英,等.CO2浓度升高对大豆光合作用和叶绿素荧光的影响[J].核农学报,2015,29(8):1583-1588.
[17]LICHTENTHALER H K.Chlorophylls and carotenoids:Pigments of photosynthetic inembranes[J].Methods Enzymol,2014,148:350-382.
[18]栗娜娜,郭世荣.氮素营养对青花菜叶片光合特性的影响[J].内蒙古农业大学学报(自然科学版),2007,28(3):140-144.
[19]郭二辉,胡颖,田朝阳,等.土壤氮素与水分对植物光合生理生态的影响研究[J].安徽农业科学,2008,36(26):11211-11213.
[20]NICODEMUS MA,SALIFUF K,JACOBS D F.Growth,nutrition,and photosynthetic response of black walnut to varying nitrogen sources and rates[J].Journal of Plant Nutrition,2008,31(11):1917-1936.
[21]张朝轩,杨天仪,吴淑杭.微生物肥料对土壤生态及葡萄叶片叶绿素荧光特性的影响[J].天津农业科学,2011,17(1):92-95.
[22]马新,李明,朱耀军,等.干旱胁迫下文冠果光合指标的变化研究[J].河南农业科学,2017,46(1):122-126.
[23]朱延姝,于丽姣,樊金娟,等.玉米幼苗叶片叶绿素荧光参数变化规律研究[J].河南农业科学,2011,40(6):26-38,42.
[24]云建英,杨甲定,赵哈林.干旱和高温对植物光合作用的影响机制研究进展[J].西北植物学报,2006,26(3):641-648.
Effects of Available Nitrogen on Photosynthetic Physiological of Leaf Color Mutant Millet during Seedling Stage
YUANRui1,YANGZongpeng2,NIE Leiyun2,HUXiaoxue1,LI Ping1
(1.College ofAgronomy,Shanxi Agricultural University,Taigu 030801,China;2.Xiangning County Agricultural Bureau,Xiangning 042100,China;3.Institute ofPomology,Shanxi Academy ofAgricultural Sciences,Taigu 030800,China)
The leaf color mutant has a phenotype which is easy to identify,and it has important value in both theoretical research and practical application.In this experiment,the leafcolor mutant was selected from the mutant library ofthe Jingu 21 mutant which was induced by EMS mutation.The results showed that available nitrogen in creased the net photosynthetic rate(Pn)and water use efficiency(WUE)ofleafcolor mutant millet by 78.58%,57.34%,respectively.Stomatal conductance(Gs),transpiration rate(Tr)and intercellular CO2concentration(Ci)were no significant changes.Photosystem II(potential)maximum photochemical efficiency(Fv/Fm),leaf photosystem II photochemical efficiency ofquantum efficiency(Fv'/Fm'),the actual photochemical quantum efficiency ofphotosystem II(ΦPSII),and electron transport rate(ETR)of leaf color mutant millet leaves increased by 33.06%,28.89%,15.88%,15.88%, respectively.Photochemical quenching coefficient(qP)and non photochemical quenching coefficient(qN)showed no significant changes.Available nitrogen could increase chlorophyll a,chlorophyll b and chlorophyll a+b content of leaf color mutant millet,but the carotenoids no significant changes.In short,available nitrogen can improve the photosynthesis of leaf color mutant millet,improve the adverse effects ofleafcolor mutation,and promote the growth.
available nitrogen;leaf color mutant millet;seedling stage;photosynthetic physiology;the chlorophyll fluorescence parameters
S515
A
1002-2481(2017)03-0346-04
10.3969/j.issn.1002-2481.2017.03.07
2016-11-10
国家重点基础发展计划项目(2012CB955904);国家科技支撑计划项目(2013BAD11B03-8);山西省科技攻关项目(20150311006-2);国家自然科学基金项目(31601212,31501276);山西农业大学博士引进人才项目(2013YT05)
袁 蕊(1989-),女,山东菏泽人,在读硕士,研究方向:植物生理生态。李 萍为通信作者。
