甘薯苗床镰刀菌病害分子检测及分析
2017-04-14张成玲赵永强谢逸萍孙厚俊杨冬静
张成玲,赵永强,谢逸萍,孙厚俊,杨冬静,徐 振
(江苏徐淮地区徐州农业科学研究所/农业部 甘薯生物学与遗传育种重点实验室,江苏 徐州 221131)
甘薯苗床镰刀菌病害分子检测及分析
张成玲,赵永强,谢逸萍*,孙厚俊,杨冬静,徐 振
(江苏徐淮地区徐州农业科学研究所/农业部 甘薯生物学与遗传育种重点实验室,江苏 徐州 221131)
从江苏、河南、河北等地育苗床上采集发病薯苗,利用组织分离法分离病原菌,通过形态学和分子生物学方法鉴定致病镰刀菌种类。共分离获得21株病原菌株,它们均产生两种孢子,大型孢子镰刀型,具3~5个分隔,小型孢子椭圆形或卵形,单胞或双胞。这些病原菌株的rDNA-ITS片段大小为544~568 bp,核苷酸一致率为46.56%~100%。系统进化树将供试病原菌分为3个组:组1为茄病镰刀菌组,包括本研究的9个分离物;组2为尖孢镰刀菌组,包括本研究的11个分离物;组3只包括2个分离物,即LN828191和本研究的分离物HNTY4。
甘薯;苗床;镰刀菌;分子检测
甘薯是重要的粮食、饲料、工业原料和能源作物,也是国际上认可的美容、防癌首选作物[1-3]。甘薯育苗是甘薯生产上的关键环节,培育无病健康苗是提高甘薯产量和品质的关键。但是甘薯苗床病害的发生阻碍了甘薯育苗工作的开展,目前甘薯苗床期真菌类病害主要有黑斑病、软腐病、镰刀菌病害(根腐病、蔓割病等)[4-5]。
镰刀菌病害是植物上一类重要的病害,寄主范围广,可侵染瓜类、豆类、棉花、马铃薯、柑橘等植物[6-8],造成植物茎部、根部和果实腐烂,严重影响作物的产量和品质。该类病原菌在甘薯苗床上为害甘薯幼苗后,造成薯苗维管束变色、腐烂,薯苗生长缓慢、死亡等。本研究通过形态学及分子生物学手段,明确了甘薯育苗床上病原镰刀菌种类,可为该病害的防治提供理论依据。
1 材料与方法
1.1 样品采集
2015年从江苏、河南、河北等地甘薯育苗床上采集薯苗末端呈现黑色或褐色腐烂病斑、根部维管束变黑或呈现纤维状、地上植株比正常植株矮小等症状的甘薯苗样品(图1)。
1.2 病菌分离及纯化
按常规组织分离法[9],采用PDA培养基平板在25 ℃条件下进行病原菌的分离和培养,挑取单孢进行纯化。将纯化的病菌编号后,根据柯赫氏法则,利用孢子悬浮液接种甘薯品种胜利百号的幼苗,进行验证。
1.3 病原菌形态特征的观察及rDNA-ITS的扩增
将纯化的病原菌接种到PDA培养基平板上,在25 ℃下进行黑暗培养,观察菌落及孢子形态[10];培养5 d后利用十字交叉法测量菌落的直径。
将病原菌接种于马铃薯葡萄糖液体培养基中,在25 ℃、125 r/min条件下振荡培养3~4 d,过滤收集菌丝体用于DNA的提取。利用DNA提取试剂盒[Takara,宝生物生工(大连)有限公司]提取菌丝总DNA。利用真菌核糖体基因转录间隔区(ITS)通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对病原菌的rDNA-ITS区进行PCR扩增[11]。 扩增条件为:94 ℃预变性4 min;94 ℃变性45 s,56 ℃退火50 s,72 ℃延伸50 s,共30个循环;最终72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测后,由生工生物工程(上海)有限公司进行测序。
1.4 序列分析
利用SDT(http://web.cbio.uct.ac.za/~brejnev/)及DNAMAN软件进行序列比对,获得序列一致率。对测序结果在GenBank数据库(www. ncbi.nlm. nih. gov)中进行BLAST比对分析。并下载相关序列,利用MEGA 6.0软件(http://www.megasoftware.net)中的最大简约法(Maximum likelihood, ML)和邻接法(Neighbour-joining, NJ)对所获得的序列构建系统进化树[12],并进行分组分析。
2 结果与分析
2.1 不同镰刀菌株的形态特征
从显现症状的甘薯幼苗上分离病原菌并经过柯赫氏法则验证后,共获得21个菌株。在PDA培养基上培养5 d后观察菌丝体的颜色及菌落直径,菌丝生长正面多呈白色至淡黄色或后期变深呈粉红色或灰色,大部分菌株的菌丝体反面为淡黄色或白色,即产生很少的色素,但HNTY1的颜色较深,为黑色。不同菌株的菌丝在PDA培养基上生长速度相差较大,生长最快的为HB6-1,培养5 d后的菌落直径达到70 mm;而XU4-1在培养5 d后的菌落直径仅为44 mm。在培养7 d后观察产生的孢子,发现21个菌株均产生两种不同类型的孢子:大型分生孢子为镰刀型,具3~5个分隔;小型分生孢子为椭圆形或圆形,有的分离物无分隔,为单胞,部分分离物为单胞或双胞(表1)。
2.2 不同镰刀菌株的分子鉴定
采用真菌通用引物ITS1/ITS4对病原菌株进行rDNA-ITS的PCR扩增,电泳检测得到大小约550 bp的片段;经连接、专化、测序分析得出,21个病原菌株ITS序列片段的长度分别为544、558、559、566及568 bp。利用SDT软件对核苷酸一致率分析表明,21个病原菌株核苷酸的一致率在46.56%~100%之间。其中HNTY4与其他分离物间的一致率最低,在46.56%~50.81%之间;而其他病原菌株间的一致率均在82.53%以上。在NCBI上进行比对及根据形态学鉴定,21个病原菌株中有12株是尖孢镰刀菌,且尖孢镰刀菌大小均为544 bp,核苷酸一致率在49.65%~100%之间,其中HNTY4与其他分离物间的一致率最低(49.65%~50.81%),而其他分离物间的一致率在99.26%以上(图2a)。9株是茄病镰刀菌,尽管其核苷酸大小不一致,但其核苷酸一致率较高,为96.81%~100%(图2b)。
将获得的病原菌的rDNA-ITS序列与GenBank中相关真菌菌株的ITS序列构建系统进化树。结果显示:系统进化树分为3个组,组1为茄病镰刀菌组,包含本研究的9个分离物,其中6个是河南分离物,2个是徐州分离物,1个为河北分离物;组2为尖孢镰刀菌组,包括本研究的11个分离物,其中5个是河南分离物,6个是徐州分离物,2个是河北分离物;组3只有两个分离物,分别是LN828191和河南分离物HNTY4(图3)。
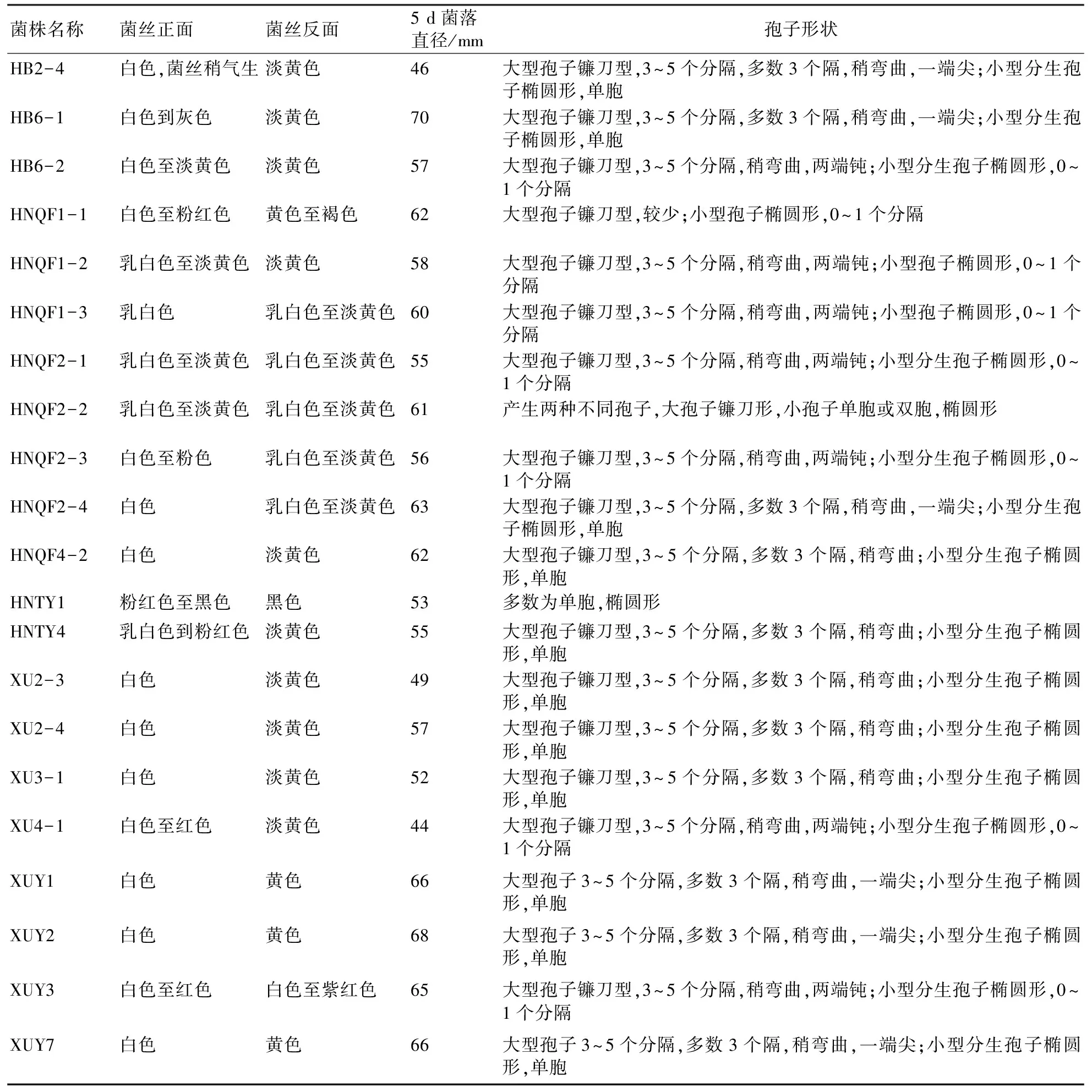
表1 不同镰刀菌株的生长特性观察结果

a:12株尖孢镰刀菌(F. oxysporum)。b:9株茄病镰刀菌(F. solani)。
3 讨论
镰刀菌是植物上一种重要的病原菌,一般引起植物枯萎、根腐、茎腐等病害[13-15]。尖孢镰刀菌和茄病镰刀菌是甘薯上两种重要的病原菌,引起甘薯根腐、干腐、蔓割、溃疡等病害。甘薯育苗床上该类病原菌来源一般是种薯薯块带菌或苗床土壤带菌,在甘薯薯苗生长期侵染薯苗基部,造成弱苗、死苗。在发病的苗床,不及时清理的发病薯块将成为下一年的侵染来源。尽管甘薯苗床病害发生严重,但未引起足够的重视,且缺乏对该类病害的深入系统研究,相关的参考资料很少。

在系统进化树中只列出大于60%的bootstrap值。
镰刀菌的种类繁多,鉴定工作复杂,传统的镰刀菌分类鉴定主要以形态特征和生理生化指标作为主要依据,但镰刀菌对环境具有极强的适应性,随环境条件变化,其形态也会产生变化[16]。真菌的rDNA-ITS区具有丰富变异的特点,常常将这一可变区作为真菌菌种和分离物鉴定的可靠依据之一[17]。因此本研究结合传统的植物病原形态鉴定方法和分子生物学技术对甘薯育苗床21个镰刀病原菌株进行了鉴定,经形态观察,这些病原菌株均产生两种类型的孢子,即大型镰刀状孢子及小型单胞或双胞分生孢子。用PCR扩增其ITS序列,经比对,这些病原菌为9株茄病镰刀菌和12株尖孢镰刀菌;其中尖孢镰刀菌出现在2个组中,HNTY4单独位于1组,其余11株位于另外1组。HNTY4与其他分离物间的一致率很低,今后可通过进一步鉴定其变种或小种的分类地位,及鉴定其对不同甘薯品种致病性的强弱,来明确其与其他分离物的区别。
[1] 马代夫,刘庆昌.中国甘薯育种与产业化[M].北京:中国农业大学出版社,2005.
[2] Loebenstein G, Thottappilly G. The sweet potato [M]. New York: Springer Science Business Media B V, 2009: 9-103.
[3] 孙健,周波,钮福祥,等.甘薯多糖国内外研究进展[J].江西农业学报,2016(8):90-93.
[4] 中国农业科学院植物保护研究所.中国农作物病虫害(第三版)[M].北京:中国农业出版社,2015:846-862.
[5] 李鹏,马代夫,李强,等.甘薯根腐病的研究现状和展望[J].江苏农业科学,2009(1):114-116.
[6] Leslie J F, Summerell B A. TheFusariumlaboratory manual [M]. Iowa: Blackwell Publishing Professional, 2006: 121-278.
[7] Cianchetta A N, Davis R M.Fusariumwilt of cotton: management strategies [J]. Crop Protection, 2015, 73: 40-44.
[8] 李金花,王蒂,柴兆祥,等.甘肃省马铃薯镰刀菌干腐病优势病原的分离鉴定[J].植物病理学报,2011,41(5):456-463.
[9] 方中达.植病研究方法[M].北京:中国农业大学出版社,1998.
[10] Lee S B, Taylor J W. Isolation of DNA from fungal mycelia and single spores [M]// Innis M A, Gelfand D H, Sninsky J J, et al. The PCR protocols: a guide to methods and applications. New York: New York Academic Press, 1990: 282-314.
[11] White T J, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics [C]//Innis M A, Gelfand D H, Sninsky J J, et al. A guide to methods and application [M]. New York: Academic Press, 1990: 315-322.
[12] Tamura K, Dudley J, Nei M, et al. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0 [J]. Molecular Biology and Evolution, 2007, 24(8): 1596-1599.
[13] Sanogo S, Zhang J. Resistance sources, resistance screening techniques and disease management forFusariumwilt in cotton [J]. Euphytica, 2016, 207(2): 255-271.
[14] 高晓敏,王琚钢,马立国,等.尖孢镰刀菌致病机理和化感作用研究进展[J].微生物学通报,2014,41(10):2143-2148.
[15] Martyn R D.Fusariumwilt of watermelon: 120 years of research [J]. Horticultural Reviews, 2014, 42: 349-442.
[16] 张向民.镰刀菌属分类学研究历史与现状[J].菌物研究,2005,3(2):59-62.
[17] 刘春来,文景芝,杨明秀,等.rDNA-ITS在植物病原真菌分子检测中的应用[J].东北农业大学学报,2007,38(1):101-106.
(责任编辑:黄荣华)
Molecular Detection and Analysis ofFusariumDiseases of Sweet Potato Seedlings in Seedbed
ZHANG Cheng-ling, ZHAO Yong-qiang, XIE Yi-ping*, SUN Hou-jun, YANG Dong-jing, XU Zhen
(Xuzhou Institute of Agricultural Sciences in Xuhuai Area of Jiangsu / Key Laboratory of Biology and Genetic Improvement of Sweet Potato, Ministry of Agriculture, Xuzhou 221131, China)
The diseased sweet potato seedlings in seedbed were collected from Jiangsu, Henan and Hebei provinces, the pathogens were isolated by using tissue separation method, and the pathogenicFusariumspecies were identified through using morphological and molecular biological methods. A total of 21 pathogenic strains were separated and identified, and they all produced two types of conidium: the macroconidium was falcate with 3~5 septa; the microconidium was oval with 0~1 septum. The fragment size of rDNA internal transcribed space (rDNA-ITS) in these pathogenic strains was 544~568 bp, and the nucleotide concordance rate among them was 46.56%~100%. These pathogenic strains were divided into 3 groups in phylogenetic trees: group 1 included 9 isolates in this study, which were identified asF.solani; group 2 included 11 isolates in this study, which were identified asF.oxysporum; group 3 included only 2 isolates, namely HNTY4 (F.oxysporum) in this study and LN828191.
Sweet potato; Seedbed;Fusarium; Molecular detection
2016-11-24
江苏省自然科学基金项目(BK20140230);国家甘薯产业技术体系甘薯病虫害岗位专家项目(CARS-11-B-09);江苏省农 业科技自主创新探索性项目[CX(13)5080]。
张成玲(1983─),女,山东沂源人,副研究员,博士,主要从事甘薯病虫害研究。*通讯作者:谢逸萍。
S435.313
A
1001-8581(2017)04-0058-05
