痰瘀同治方药对高脂血症小鼠脂质代谢的调节作用及机制研究
2017-04-14李奇恒苏继源贺治青吴宗贵
李奇恒,苏继源,丁 茹,贺治青,梁 春,吴宗贵
·基础医学论著/研究·
痰瘀同治方药对高脂血症小鼠脂质代谢的调节作用及机制研究
李奇恒,苏继源,丁 茹,贺治青,梁 春,吴宗贵
目的 观察复方中药对高脂血症模型小鼠脂质代谢的调控作用及机制。方法 选取60只雄性C57小鼠,随机分为3组:高脂饮食组、高脂+复方中药组、高脂+他汀组,单纯高脂饮食喂养制备模型。模型制备成功后连续灌药12周后,观察各组间小鼠血浆胆固醇、胆汁酸及相关基因表达的变化。结果 与高脂饮食组小鼠相比,复方中药治疗组小鼠血浆总胆固醇水平显著降低(P<0.05),但有关肝脏HMG-GA还原酶(HMGR)水平则无统计学意义(P>0.05),同时伴有末端回肠顶端钠依赖性胆汁酸转运体(ASBT)基因表达水平显著下降(P<0.05),与高脂模型及阿托伐他汀治疗组小鼠相比,复方中药组小鼠肝脏胆盐输出泵(BSEP)基因的表达有显著上升(P<0.05)。结论 复方中药可显著降低高脂血症小鼠的血浆胆固醇,增加粪便中次级胆汁酸的浓度,其可能机制是通过抑制肠细胞ASBT基因表达以及上调肝脏BSEP基因综合作用的结果。
高胆固醇血症;痰瘀同治方;胆汁酸肠肝循环;胆盐输出泵
动脉粥样硬化(AS)作为全球性流行的高发病率、高致残率和高死亡率的疾病严重危害人类健康。究其原因高胆固醇血症是致动脉粥样硬化斑块发生进展的重要危险因素之一。多个随机对照研究证实他汀、PCSK9抑制剂、胆酸螯合剂等降低血胆固醇水平的药物,可显著降低动脉粥样硬化相关疾病的发生率。
胆汁酸在脂质代谢中起重要作用,其可促进食物中脂肪和脂溶性维生素在肠道的吸收。胆固醇在肝内转化为胆汁酸。肝内胆汁酸主要通过胆盐输出泵(bile salt export pump,BSEP)泵入胆囊内储存。当食物进入肠道后其释放进入肠道促进脂质和脂溶性维生素的消化吸收[1]。在末端回肠初级胆汁酸通过厌氧菌转化为次级胆汁酸。在肠道内约5%的次级胆汁酸随粪便排出,这是人体最重要的消除胆固醇的方式[2]。而其余95%的胆汁酸通过末端回肠上的顶端钠依赖性胆汁酸转运体(apicalsodium-dependent BA uptake transporter,ASBT)主重吸收通过门静脉重新回流至肝脏。次级胆汁酸相较初级胆汁酸具有更高的毒性,这可能与其较高的疏水性密切相关[3],例如脱氧氧胆酸和石胆酸,系列研究揭示其在结直肠癌、肝癌、胆固醇性胆石症中具有促进作用[4-7]。
中医亦对动脉粥样硬化进行了深入的研究。中医研究发现血瘀在斑块破裂后并发血栓时表现最为显著,而在AS发生以及斑块形成早期以富含脂质软斑块为主要病理特征时,则以痰浊为重。据此,从“从痰论治”的角度,提出“痰瘀同治”的治法原则,对“治瘀”和“治痰”两者兼顾,将治疗时间窗从“活血化瘀”提前到“痰瘀同治”。以汉代张仲景所著《金匮要略》一书中著名方剂栝楼薤白白酒汤为基础,结合现代西医学对动脉粥样硬化认识和治疗的新进展,对配方进行优化,形成了新型“痰瘀同治”方药(以下简称复方中药)。本研究观察复方中药调节高脂血症小鼠胆固醇的作用,并初步探索其作用机制。
1 材料与方法
1.1 一般材料
1.1.1 动物与试剂 SPF级雄性C57小鼠60只,8周龄,20 g左右。复方中药胶囊:由上海长征医院制剂室提供,每粒含药粉0.35 g;阿托伐他汀钙片(立普妥,辉瑞公司);特殊高脂饲料(常州开源动物饲料有限公司,D12109C,致高血脂小鼠特殊饲料);L-苯丙氨酸购自Sigma公司;石胆酸、熊脱氧胆酸、脱氧胆酸标准品均购自Sigma公司。
1.1.2 分组、造模及给药 60只小鼠随机分为3组:高脂饮食组、高脂+复方中药组以及高脂+他汀组。适应喂养2周后采用给予特殊高脂诱导高血脂,高脂喂养两月经隐静脉采血测定血浆总胆固醇(TC),剔除血脂正常小鼠。药物干预组小鼠经口灌胃给药,连续12周,每日一次。各组给药剂量分别为:阿托伐他汀10 mg/(kg·d)和复方中药0.27 kg/(kg·d),高脂饮食组用等体积生理盐水灌胃。末次给药24 h后处死小鼠,留取血浆、粪便、末端回肠、肝脏等组织。
1.2 血浆胆固醇的测定 实验终点颈动脉采集全血,离心分离血浆,采用酶法检测盒检测不同组小鼠TC水平。
1.3 UPLC-MS/MS测定胆汁酸
1.3.1 UPLC-MS/MS条件 色谱条件:流动相:0.1%甲酸水(A)-乙腈(B);洗脱梯度:0~4 min 5%~70%B;4~8 min 70%B;8~9 min 70%~98%B;9~10 min 98%B流速 0.4 mL/min;进样量 3 μL;柱温 25℃;质谱条件为:气帘气 30℃;碰撞气 8℃;电喷雾电压 4 500 V;温度55℃;离子源辅助气1为55 ℃;离子源辅助气2为55 ℃。
1.3.2 样品处理 取粪便样本10 mg,加入1 mL含内标100 ng/mL的甲醇溶液超声溶解10 min,离心(13 000 r/min,4 ℃)10 min,取上清液得到含内标浓度100 ng/mL样品溶液。
1.4 Real-Time PCR
1.4.1 RNA提取及CDNA的反转 所有组织(肝、肠)的RNA的提取按照TaKaRa试剂盒说明书提供的提取RNA。根据PrimeScript®RT Master Mix 试剂盒的说明,配制10 μL反应体系。逆转录全程需在冰板上操作。
1.4.2 Real Time qPCR反应 根据SYBR®PremixEx TaqTM 试剂盒说明,配制10 μL 反应体系。反应条件:预变性95℃,3 min;反应阶段95℃,15 s,60℃,45 s,循环数40;溶解阶段60℃,5 s,95℃,0.5℃/5 s。引物序列:以下引物序列由上海捷瑞生物工程有限公司合成。详见表1。

表1 定量引物序列

2 结 果
2.1 复方中药降低高脂血症小鼠血浆总胆固醇水平分析 复方中药及阿托伐他汀治疗组血浆总胆固醇水平较高脂饮食组均有显著降低(P<0.05),但药物干预两组间总胆固醇水平无统计学意义(P>0.05)。详见图1。
阿托伐他汀组肝脏HMG-CoA还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMGR) 基因表达水平较高脂饮食组及复方中药组均有显著降低(P<0.05),但复方中药治疗组与高脂饮食组肝脏HMGR水平无统计学意义(P>0.05)。详见图2。复方中药降脂的作用机制与他汀不同,可能存在其他机制。

与高脂模型组比较,*P<0.05。

与高脂模型组相比,*P<0.05;与复方中药治疗组小鼠比较,#P<0.05。
2.2 复方中药对高脂血症小鼠粪便胆汁酸谱的影响 高脂+复方中药组粪便次级胆汁酸(石胆酸、脱氧胆酸、熊脱氧胆酸)浓度较高脂饮食组及高脂+阿托伐他汀治疗组均显著上升(P<0.05)。高脂饮食组和高脂+阿托伐他汀组粪便次级胆汁酸浓度无统计学意义(P>0.05)。详见表 2。
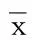

组别n粪便次级胆汁酸浓度(ng/g)高脂饮食组103616.65±791.861)高脂+复方中药组107924.46±815.39高脂+阿托伐他汀组104796.02±742.871) 与高脂+复方中药组相比,1)P<0.05。
2.3 复方中药改变高脂血症小鼠胆汁酸肠肝循环相关基因的表达 高脂+复方中药组末端回肠的ASBT基因表达水平较高脂饮食组及高脂+阿托伐他汀组均有显著下降(P<0.05)。详见图3A。高脂+复方中药组肝脏Bsep基因的表达水平较高脂饮食组及阿托伐他汀组均有显著上升(P<0.05)。详见图3B。高脂饮食组和高脂+阿托伐他汀治疗组ASBT和Bsep的基因表达无统计学意义(P>0.05)。详见图3。

与高脂+复方中药组比较,*P<0.05。
3 讨 论
高脂血症是动脉粥样硬化和相关疾病发展的重要危险因素[8]。高胆固醇水平的升高,公认为在一系列的慢性疾病(包括动脉粥样硬化、神经退行性病变、糖尿病等)的发生和发展中起决定性作用[9]。多个研究显示服用降低胆固醇的药物,可显著降低动脉粥样硬化相关疾病的发生率。他汀是应用最广的降低胆固醇的药物,其主要通过抑制胆固醇合成的限速酶HMG-CoA还原酶来降低血胆固醇,但其疗效在不同个体之间有一定差异,临床中也常见病人对其不耐受的现象。近年来多个新型降胆固醇药物的面世,研究表明辅助他汀进一步降低了血胆固醇水平,使患动脉粥样硬化及其相关疾病的风险进一步降低。本实验比较不同干预下血浆胆固醇证明复方中药具有显著降低血浆胆固醇的作用。复方中药对肝脏HMG-CoA还原酶的基因表达无显著影响,提示其降低胆固醇的作用机制不同于他汀。
在正常个体中,90%的初级胆汁酸包括:胆酸(cholic acid,CA)和鹅脱氧胆酸(chenodeoxycholicacid,CDCA)通过经典通路合成。胆固醇通过胆固醇7固醇羟化酶转化为胆汁酸,胆固醇7固醇羟化酶是CA和CDCA合成的限速酶。大部分的胆汁酸一旦合成就立即在肝内同甘氨酸和牛磺酸结合。结合胆汁酸主要通过胆盐输出泵将胆汁酸从肝脏输送至胆囊内。膳食,特别是那些含有脂肪的食物,刺激肠细胞分泌胆囊收缩素,促进胆汁酸分泌到十二指肠。大于95%的胆汁酸通过ASBT被肠细胞重吸收。大约5%的胆汁酸在肠道通过肠道菌群酶转化为次级胆汁酸,主要有脱氧胆酸(deoxycholic acid,DCA)、石胆酸(litocholicacid,LCA)、牛磺脱氧胆酸(taurodeoxycholic acid,TDCA)、熊脱氧胆酸(ursodeoxycholic acid,UDCA)等。这些胆汁酸主要随粪便排出体外,为人体最重要的消除胆固醇的方式。
中医学认为,高脂血症与脾肾关系密切,因脾为后天之本,气血生化之源,精液输布之枢纽,根据“脾主运化”的机制,高脂血症的形成与脾的关系紧密。《证治汇补》言:“脾虚不运清浊,停留精液而痰生。”而肾主一身之阳气,为气化之源,五脏之根,肾主精液的存储、分布、利用及精液、精、血之间的转化起主导作用。清代医家赵延儒在《赵李合璧·杂症门》中云:“夫痰者水也,其本在肾,其标在脾……故脾、肾一虚,其痰必多。”由此可见脾肾是影响脂浊成化之关键,脾不健运和肾气不足是引起高脂血症的主要病机。高脂血症导致人体脏腑组织功能失调,其致病因素并不是血脂本身,而是由血脂引起的病理产物痰浊、瘀血所为[10]。痰生成的内因是脏腑功能失调,从遗传角度讲中医体质状况如“肥人多痰”也是重要因素[11]。高脂血症以及高血糖等AS 致病因素可称之“血中之痰浊”。而肠道中的过多的脂质、胆汁酸等可称之为“腑中之痰浊”,在AS的发生发展中亦起重要作用。我们从“从痰论治”的角度,提出“痰瘀同治”的治法原则,对“治瘀”和“治痰”两者兼顾。由此,我们以汉代张仲景所著《金匮要略》一书中著名方剂栝楼薤白白酒汤为基础,结合现代西医学对动脉粥样硬化认识和治疗的新进展,在古方中加入三七、红曲等多味中药材,形成了新型方药,前期研究他汀药物调节血脂的同时引起肝内脂质沉积,而复方中药在调节血脂的同时无此现象,由此,推测复方中药不是通过抑制胆固醇合成而是通过抑制吸收及促进其分解代谢而控制血脂,根据中医“实则下之”、“瘀则通之”的理论,对属标实、瘀滞的AS,考虑复方中药作用机制可能亦包括对肠道的作用,对瘀于肠道中的“痰浊”下之通之,即抑制肠道中脂质的吸收,促进脂质代谢产物胆汁酸的排泄。
本研究表明,复方中药可显著降低高脂血症小鼠的血浆总胆固醇,增加粪便中胆汁酸的含量,其可能是通过抑制肠细胞ASBT基因的表达,促进肝脏BSEP基因的表达综合作用的结果。但胆汁酸肝肠循环及胆固醇代谢较为复杂,仍需进一步研究探究复方中药改善高胆固醇血症的相关机制。
[1] Zhang Y,Klaassen CD.Effects of feeding bile acids and a bile acid sequestrant on hepatic bile acid composition in mice[J].J Lipid Res,2010,51(11):3230-3242.
[2] Li Y,Jadhav K,Zhang Y.Bile acid receptors in non-alcoholic fatty liver disease[J].Biochem Pharmacol,2013,86(11):1517-1524.
[3] Song P,Zhang Y,Klaassen CD.Dose-response of five bile acids on serum and liver bile acid concentrations and hepatotoxicty in mice[J].Toxicol Sci,2011,123(2):359-367.
[4] Powolny A,Xu J,Loo G.Deoxycholate induces DNA damage and apoptosis in human colon epithelial cells expressing either mutant or wild-type p53[J].Int J Biochem Cell Biol,2001,33(2):193-203.
[5] Ridlon JM,Kang DJ,Hylemon PB.Bile salt biotransformations by human intestinal bacteria[J].J Lipid Res,2006,47(2):241-259.
[6] McGarr SE,Ridlon JM,Hylemon PB.Diet,anaerobic bacterial metabolism,and colon cancer: a review of the literature[J].J Clin Gastroenterol,2005,39(2):98-109.
[7] Bajor A,Gillberg PG,Abrahamsson H.Bile acids: short and long term effects in the intestine[J].Scand J Gastroenterol,2010,45(6):645-664.
[8] Mannu GS,Zaman MJ,Gupta A,et al.Evidence of lifestyle modification in the management of hypercholesterolemia[J].Curr Cardiol Rev,2013,9(1):2-14.
[9] Poli G,Biasi F,Leonarduzzi G.Oxysterols in the pathogenesis of major chronic diseases[J].Redox Biol,2013,1:125-130.
[10] 钱小奇.试论高脂血症的病因病机[J].天津中医,2002,19(6):50-52.
[11] 宋剑南.中医药防治动脉粥弱硬化研究进展[J].中国中医基础医学杂志,2009,9(11):71-74.
(本文编辑王雅洁)
Effects of Tanyu Tongzhi Prescription on Lipid Metabolism in Hyperlipidemic Mice and Its Mechanisms
Li Qiheng, Su Jiyuan, Ding Ru, He Zhiqing, Liang Chun, Wu Zonggui
Shanghai Changzheng Hospital, Second Military Medical University, Shanghai 200003,China
Wu Zonggui
Objective To investigate the effects and mechanism of Tanyu Tongzhi prescription (TTP) on lipid metabolism in hyperlipidemic mice.Methods Sixty male C57 mice were randomly divided into three groups:HFD group (group A) fed with high fat diet, HFD plus TTP group (group B) given with high fat diet and TTP, HFD plus statin (group C) group fed with high fat and statin.After 12 weeks of administration, the changes of plasma cholesterol, bile acid and related genes expression were observed.Results Compared with group A,the levels of plasma total cholesterol and the expressions of gut apicalsodium-dependent BA uptake transporter (ASBT) gene were significantly decreased in group B (P<0.05).Compared with group A and group C, the expressions of bile salt export pump (BSEP) gene in liver were significantly increased in group B (P<0.05).Conclusion TTP could reduce plasma cholesterol and increase fecal secondary bile acid, which might be attributed to gut ASBT expression inhibition and liver BSEP expression up-regulation.
hyperlipidemia;Tanyu Tongzhi prescription;bile acid enterohepatic circulation
国家自然科学基金资助项目(No.81130065、91539118、81473445);上海市科委中医引导性项目(No.15401931500)
上海长征医院(上海200003)
吴宗贵,E-mail:wu_zonggui@yeah.net
R589.2 R256.2
A
10.3969/j.issn.1672-1349.2017.06.008
1672-1349(2017)06-0663-04
2017-02-10)
引用信息:李奇恒,苏继源,丁茹,等.痰瘀同治方药对高脂血症小鼠脂质代谢的调节作用及机制研究[J].中西医结合心脑血管病杂志,2017,15(6):663-666.
