PAC改性粘土处理蓝藻水华对水环境的影响*
2017-04-12杨小杰韩士群
周 庆,杨小杰,韩士群
(江苏省农业科学院农业资源与环境研究所,南京 210014)
PAC改性粘土处理蓝藻水华对水环境的影响*
周 庆,杨小杰,韩士群**
(江苏省农业科学院农业资源与环境研究所,南京 210014)
利用改性粘土治理蓝藻水华堆积的湖泊近岸区域以及发生水华的养殖水体成为应急治理蓝藻的重要措施,然而负载有毒藻体的改性粘土沉积水体可能引发的安全性风险尚缺乏研究. 选取PAC改性粘土作为研究对象,通过模拟实验,研究改性粘土处理蓝藻水华后沉积水体对负载的藻细胞结构、水体营养盐与藻毒素的释放与削减以及对其他水体功能性细菌(硝化、反硝化细菌)的影响. 结果表明,PAC改性粘土的施用对低水华水体蓝藻细胞的去除率为96.04%±0.99%,高水华水体与低水华水体施用的去除率之间差异不显著,PAC改性粘土的施用能够在较长的时间内有效地控制水体中的蓝藻浓度. 透射电镜结果表明,PAC改性粘土沉降蓝藻第4 d后,蓝藻细胞膜出现了一定程度的不完整,细胞内规则的类囊体片层结构出现了实质性损伤. 随着粘土负载蓝藻细胞的损伤,水体中的总可溶性氮浓度迅速上升,但总可溶性磷浓度仍可在较长一段时间内维持在较低水平. PAC改性粘土施用后,水体的总细菌数与空白对照组趋于一致,但硝化、反硝化细菌数却呈显著下降趋势. PAC改性粘土施用下的藻毒素释放风险主要集中在高水华水体. 高水华水体中,PAC改性粘土施用导致藻毒素MC-LR和MC-RR加速释放,其最高峰值分别达到空白对照组的1.69±0.09和2.04±0.09倍,但水体MC-LR浓度达到安全限(<1 μg/L)的时间明显比空白对照组早8 d. 此外,PAC改性粘土的施用并没有导致水体中Al3+和Cl-浓度超标.
PAC改性粘土;蓝藻水华;营养盐释放;藻毒素释放;硝化、反硝化细菌
我国自1980s以来,由于经济的急速发展和环境保护的相对滞后,许多湖泊、河流、水库进入了富营养化、甚至严重富营养化状态. 其中,60%的湖泊和水库受到有毒蓝藻水华频繁暴发的困扰[1]. 而产毒铜绿微囊藻是我国最常见的一种水华蓝藻[2],其释放的微囊藻毒素(MCs)对水环境安全和人畜健康构成了严重的威胁[3]. 2007年太湖梅梁湾微囊藻水华引发的无锡南泉水厂水质恶化事件,在国内学者们的分析建议下,相关部门最终重视了对重点湖区蓝藻水华的应急治理. 对蓝藻水华堆积的近岸区域,采用改性粘土进行喷洒,使水面蓝藻沉降到底泥,成为蓝藻水华应急治理的重要措施之一[4]. 而长期积累形成的“藻型生境条件”很难在短期内得到根本改变[5],蓝藻水华还将会在相当长的一段时间内持续发生,并且从自然水体延伸到了养殖水体.
使用廉价的粘土凝聚除藻被国内外学者认为是最有希望治理藻类污染的方法[6]. 但自然粘土用量过大,容易改变底栖动物的群落结构与多样性[7-8]. 不仅如此,很多粘土在海水中应用有效果,在淡水中却没有[9]. 许多学者通过对粘土的壳聚糖改性[10]、十六烷基三甲基溴化铵(CTAB)改性[11]和聚合氯化铝(PAC)改性[12]等,有效提升了粘土在淡水中除藻的效率,显著降低了投加量. Lewis等[13]研究认为改性过的粘土与有害藻类相比不会对底栖生物形成更多的压力. 曹西华等[14]利用改性粘土去除养殖水体的甲藻水华,发现对养殖对虾幼体的存活没有明显影响.
但是近年来有学者逐渐发现壳聚糖、CTAB、PAC这类改性剂能够对沉降的有毒蓝藻细胞产生不同程度的伤害效应[11,15],那么通过改性粘土应急沉降蓝藻后,负载藻体的粘土沉积在水体对水体营养盐、藻毒素再释放的影响如何,改性粘土的施用是否会影响其他功能微生物以及影响藻毒素的降解,进而干扰水体的自净功能,这些问题尚缺乏研究.
本研究选取目前使用最广泛、成本较低廉的PAC改性粘土作为研究对象,探讨改性粘土处理蓝藻水华后在水体对负载的藻细胞结构、水体营养盐、藻毒素释放与削减以及对其他水体功能性细菌(硝化、反硝化细菌)的影响,对负载产毒蓝藻的改性粘土沉积水体的风险进行初步的研究,为其在蓝藻水华应急治理与养殖水体除藻中的应用提供一定的理论基础.
1 材料与方法
1.1 实验材料
1.1.1 藻种 产毒铜绿微囊藻(Microcystisaeruginosa,FACHB-912)购于中国科学院武汉水生生物研究所淡水藻种库,采用1/10改良Hoagland’s培养基(pH 7.0). 1/10改良Hoagland’s培养基经121℃灭菌20 min.
1.1.2 PAC改性粘土 将分别预处理后的凹凸棒土(AT)与PAC以5∶1(W/W)混合,盐基度调至70%,经复合反应和熟化反应后干燥制得成品[12].
1.2 实验方法
取江苏省农业科学院2#塘水(总氮(TN)浓度为7.88±0.26 mg/L, 总磷(TP)浓度为0.14±0.03 mg/L,叶绿素a(Chl.a)浓度为22.32±1.31 μg/L,水体中的浮游藻类以栅藻、十字藻、弓形藻等绿藻为主),经滤纸(最大孔径20 μm)过滤后,备用. 分别设置无水华塘水(仅为过滤塘水)、低水华塘水(铜绿微囊藻纯培养物与过滤塘水混合后,藻细胞密度为6.99×105cells/ml)、高水华塘水(铜绿微囊藻纯培养物与过滤塘水混合后,藻细胞密度为3.83×106cells/ml),每种塘水均通过添加硝酸铵和磷酸二氢钾将TN、TP浓度分别调至约25和4 mg/L左右. 对于每一种塘水,不添加PAC改性粘土的为空白对照组;添加PAC改性粘土的为处理组,投加量为200 mg/L,反应体系为10 L,搅拌参数为450 转/min下搅拌1 min、150 转/min下搅拌10 min、静置30 min. 此后每天低速(50 转/min)扰动1 h,使改性粘土沉积期内水体仍有一定的扰动. 每个处理设置3个平行. 水体扰动后静置30 min再取样,定期测定无水华塘水、低水华塘水、高水华塘水中水体Chl.a浓度、营养盐等指标;低水华塘水、高水华塘水中水体MCs指标;无水华塘水中的总细菌数、硝化与反硝化细菌数;以及高水华塘水沉淀粘土中的铜绿微囊藻细胞结构状况.

图1 不同水华程度下PAC改性粘土的施用对水体叶绿素a(a)、DTP(b)和DTN(c)浓度的影响
1.3 测定方法
总可溶性氮浓度(TDN)采用碱性过硫酸钾消解紫外分光光度法测定[16],总可溶性磷浓度(TDP)采用钼锑抗分光光度法测定测定[16],铝离子浓度(Al3+)采用铬天青S分光光度法测定[17],氯离子浓度(Cl-)采用硝酸银滴定法测定[18].
Chl.a浓度采用热乙醇法测定[19]. 总细菌计数采用牛肉膏蛋白胨培养基-平板计数法[20],硝化细菌和反硝化细菌计数采用MPN计数法[21].
沉淀粘土中的铜绿微囊藻细胞外部形态的分析通过扫描电镜(ESEM Philips XL-30)进行,内部结构状况的分析通过透射电镜(TEM Philips CM100)进行.
水体中可溶性MC-LR和MC-RR的测定参照国标方法(GB 20466-2006-T),采集的培养液经膜过滤 (Whatman GF/C,0.45 μm孔径),滤液再经C18固相萃取小柱(Waters,Sep-Pak©Vac 3cc)分离富集后,其甲醇洗脱液通过悬转蒸干,再重悬于50%的甲醇(色谱纯),最后经高效液相色谱仪(Agilent 1200)测定. 色谱条件为250 mm×0.46 mm的C18反相柱,柱温40℃,流动相为甲醇与磷酸盐缓冲溶液(pH 3.0)按体积比57∶43混合,流速1 ml/min,紫外可见检测器波长为238 nm.
1.4 统计分析
采用SPSS 13.0软件包进行统计分析,Pearson相关系数用于分析各指标间的相关性,处理间差异分析采用ANOVA,P<0.05表示显著性差异,P<0.01 表示极显著性差异.
2 结果与分析
2.1 PAC改性粘土施用对水体浮游藻细胞浓度的影响
PAC改性粘土施用当天对无水华塘水浮游藻细胞的去除率为3.64%±5.15%,对低水华塘水蓝藻细胞的去除率为96.04%±0.99%,对高水华塘水蓝藻细胞的去除率为97.01%±1.15%,低水华与高水华塘水之间的去除率差异不显著. PAC改性粘土施用后第2 d,低水华塘水与高水华塘水中的蓝藻细胞均呈显著上升趋势,第4 d时高水华塘水中的蓝藻细胞数量显著高于低水华塘水. 但与空白对照组相比,PAC改性粘土处理后低水华塘水与高水华塘水中的藻细胞即使出现逃离絮体、恢复生长的现象,其水体中的蓝藻细胞的最高浓度仍显著低于空白对照组(图1a). 可见,PAC改性粘土能够在较长的时间内有效地控制水体中的蓝藻细胞浓度.
2.2 PAC改性粘土施用对水体氮、磷营养盐再释放的影响
空白对照组中的蓝藻在生长过程中可以极大地摄取水体中的DTP,但随着水华蓝藻的衰亡,水体中的DTP浓度又呈现迅速上升趋势(图1b). 通过Pearson相关性分析,发现空白对照组中水体Chl.a浓度与DTP浓度呈极显著负相关(低水华塘水对照组中Pearson’sr=-0.792、P<0.01;高水华塘水对照组中Pearson’sr=-0.917、P<0.01). PAC改性粘土的施用干扰了水体DTP浓度与水体Chl.a浓度之间的相关性,使水体DTP和藻细胞密度在较长一段时间内均维持在相对较低水平.
空白对照组中的蓝藻在生长过程中同样摄取了水体中的DTN. 随着水华蓝藻的衰亡,第16 d水体中的DTN浓度逐渐呈迅速上升趋势. 然而,PAC改性粘土施用第4 d,DTN浓度就迅速上升,显著快于空白对照组(图1c). 但此时,处理水体中的浮游蓝藻仍未出现衰亡趋势,推测PAC改性粘土沉降的大量蓝藻细胞可能出现了死亡.
空白对照组中的无水华塘水DTN浓度呈现逐渐下降趋势,而PAC改性粘土施用无水华塘水20 d后,其水体DTN浓度与初始值并未产生显著差异. 这可能是因为PAC改性粘土的施用限制了无水华水体浮游藻类的生长,同时也可能对水体硝化、反硝化细菌产生了一定的负面影响.
2.3 PAC改性粘土沉降蓝藻对藻细胞结构的影响
从扫描电镜观察可看出,PAC改性粘土对铜绿微囊藻细胞具有强大的电荷中和与絮凝网扑作用(图2a). 蓝藻细胞在沉降8 d后,其细胞表观结构并未出现严重的损坏. 但从透射电镜观察可看出,正常的铜绿微囊藻细胞的细胞膜与细胞壁紧密结合,藻细胞无核膜,大量片层类囊体分布在周边区,大致与细胞壁侧壁平行排列,而PAC改性粘土沉降蓝藻第4 d后,蓝藻细胞膜出现了一定程度的不完整,类囊体片层结构松散,部分区域有溶解现象,原本紧密排列在类囊体上的藻胆体也出现了溶解,细胞内部结构出现了实质性损伤(图2e). 8 d后,蓝藻细胞内规则的类囊体片层结构完全瓦解,拟核区消失(图2f). 可见,PAC改性粘土短期内可造成铜绿微囊藻细胞的病变损伤,并最终导致了死亡.
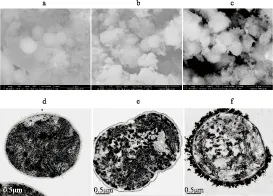
图2 PAC改性粘土沉降对蓝藻结构影响的电镜观察(a~c分别为沉淀0、4、8 d的扫描电镜;d~f分别为沉淀0、4、8 d的透射电镜)
2.4 PAC改性粘土施用对水体藻毒素释放、降解的影响
由于无水华水体中的藻类以绿藻为主,且通过高效液相色谱未检测出MC-LR和MC-RR. 因此在研究PAC改性粘土施用对水体藻毒素释放、降解的影响时仅针对低水华塘水和高水华塘水. PAC改性粘土施用下的低水华塘水,其MC-LR和MC-RR浓度变化趋势与空白对照组相比差异均不显著(图3). 但在高水华水体中,PAC改性粘土的施用并沉积至水体导致MC-LR与MC-RR的释放最高峰出现在第4 d,明显早于空白对照组的第8 d. 且PAC改性粘土施用并沉积至水体导致MC-LR与MC-RR释放的最高峰值分别为空白对照组的1.69±0.09和2.04±0.09倍. 而藻毒素的快速释放,可能主要由于PAC改性粘土造成铜绿微囊藻细胞病变损伤引起的. 我国《生活饮用水卫生标准》(GB 5749-2006)和世界卫生组织(WHO)的标准均指出MC-LR的安全限为1 μg/L. 在20 d的实验周期里,对于PAC改性粘土施用下的低水华水体,其水体MC-LR达到安全限的时间和空白对照组一致,均为4 d. 而对于PAC改性粘土施用下的高水华水体,其水体MC-LR达到安全限的时间明显比空白对照组早8 d. 通过Pearson相关性分析,发现PAC改性粘土的施用使水体MC-LR浓度与DTP浓度呈显著负相关(低水华塘水处理组中Pearson’sr=-0.805、P<0.01;高水华塘水处理组中Pearson’sr=-0.709、P<0.05). 以DTP为代表的细胞内容物在水体呈现逐步释放的过程中,水体的MC-LR浓度却呈下降趋势,可见,藻毒素降解菌对MC-LR的降解作用并未受到PAC改性粘土的强烈抑制.
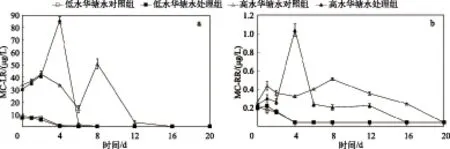
图3 不同水华程度下PAC改性粘土的施用对水体MC-LR(a)和MC-RR(b)浓度的影响
2.5 PAC改性粘土施用对水体硝化、反硝化细菌的影响
为排除蓝藻水华对水体硝化、反硝化细菌影响的干扰,PAC改性粘土施用对水体硝化、反硝化细菌影响的研究仅针对无水华塘水展开. PAC改性粘土施用当日,水体的总细菌数相比空白对照组显著下降,而硝化、反硝化细菌数的变化并不显著(图4). 随着PAC改性粘土沉积水体时间的增加,水体的总细菌数与空白对照组趋于一致,但硝化、反硝化细菌数却显著下降,尤其是硝化细菌的减少早于反硝化细菌. 可见,PAC改性粘土沉积水体对水体硝化、反硝化细菌产生了一定的不利影响. 而硝化、反硝化细菌是水体自净作用中重要的功能性微生物,PAC改性粘土的施用对水体硝化、反硝化细菌的不利影响,是否会对水体自净功能造成干扰尚需要进一步明确.
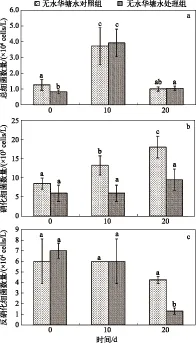
图4 PAC改性粘土的施用对水体总细菌(a)、硝化细菌(b)和反硝化细菌(c)数量的影响(图中不同小写字母表示差异达到P<0.05)
2.6 PAC改性粘土施用对水体游离铝和氯的影响
空白对照组中水体Al3+与Cl-浓度呈显著正相关(无水华塘水对照组中Pearson’sr=0.676、P<0.05;低水华塘水对照组中Pearson’sr=0.741、P<0.05;高水华塘水对照组中Pearson’sr=0.780、P<0.05). PAC改性粘土的施用打破了原有的相关性,促进了水体中Al3+和Cl-浓度的增加,但随着粘土沉积时间的增加,Al3+浓度出现回落并逐步稳定,Cl-浓度则相对保持平稳(图5). 我国《生活饮用水卫生标准》(GB 5749-2006)指出,Al3+浓度不得超过0.2 mg/L,Cl-浓度不得超过250 mg/L. 可见,PAC改性粘土的施用并没有导致水体中Al3+和Cl-浓度超标. Al3+与Cl-是PAC改性最优先考虑的离子,PAC改性粘土的施用对其他离子间相关性的影响以及离子浓度的安全性影响还有待进一步研究.
3 讨论
通过PAC这类预聚合无机混凝剂的改性粘土,使粘土含有较高的正电荷,电性中和成为其混凝除藻的重要机理之一[22]. 有研究发现,短裸甲藻(Gymnodiniumbreve)能够逃离粘土絮体,使水体中的藻细胞浓度在24 h内迅速增加,120 h后达到空白对照组的约66.67%[23].研究表明,PAC改性粘土沉降铜绿微囊藻细胞,48 h后藻细胞也存在一部分逃离絮体、恢复生长的现象,但PAC改性粘土却仍然能够在较长时间内有效地降低水体中的藻细胞浓度. 以高水华塘水实验为例,PAC改性粘土处理后恢复生长的蓝藻细胞最高浓度仅为空白对照组的22.70%,这很可能是由于铜绿微囊藻与短裸甲藻不同,不具有鞭毛的原因.
通过透射电镜观察到PAC改性粘土对铜绿微囊藻细胞的损伤作用. 有研究发现,0.5 mg/L Al3+能够导致杜氏盐藻(Dunaliellatertiolecta)细胞的皱缩,但不致死[24],15 mg/L Al3+能够导致鱼害微囊藻(Microcystisichthyoblabe)细胞的死亡[25]. 本研究结果显示,投加PAC改性粘土后,水体中Al3+浓度最高达到70.07 μg/L. 以此浓度为参考依据,分别采用PAC改性粘土混凝处理过的Hogland’s培养基、添加80 μg/L Al3+的Hogland’s培养基和正常的Hogland’s培养基来培养铜绿微囊藻,结果显示,15 d后铜绿微囊藻的生物量增长率分别为4.45%±0.83%、4.64%±1.07%、3.81%±0.11%,3个处理组之间的藻细胞增长率差异并不显著. 可见,Al3+等这类PAC改性粘土释放到水中的成分并不是PAC改性粘土对铜绿微囊藻细胞产生损伤重要原因. 铜绿微囊藻细胞表面带负电荷,而PAC改性粘土含有的大量正电荷是否对藻细胞膜电位、电阻产生了不可逆的影响,从而导致铜绿微囊藻细胞的损伤死亡,这一推测还有待进一步研究.
改性粘土除藻一直被视为环境友好型的处理方法[15]. 研究表明,PAC改性粘土施用下的低水华塘水,其MC-LR和MC-RR浓度变化趋势与空白对照组相比差异不显著. 然而,正是由于PAC改性粘土短期内可造成铜绿微囊藻细胞的病变损伤并最终致死的特点,在处理高浓度水华时,容易导致藻细胞中含有的氮、磷营养盐和微囊藻毒素加快释放到水体中. 虽然从藻毒素的降解速度来看,PAC改性粘土并没有抑制藻毒素的降解,反而加快了高水华水体中MC-LR浓度达到安全限值以下,但短期内PAC改性粘土引起高水华水体藻毒素快速释放的隐患不容忽视. 改性粘土的施用仍需考虑施用的水体性质. 在处理养殖水体时,除了注意施用改性粘土的种类、剂量外,更需注意施用时水华形成的严重度以防止藻毒素过快释放带来的安全风险. 对蓝藻水华堆积的湖泊近岸区域应急喷洒改性粘土时,最好配合适当的粘土取出机制或者藻毒素强化去除机制来尽可能的减少其安全风险.
另外,水体硝化、反硝化细菌是水体自净作用中重要的功能性微生物,本文首次报道了PAC改性粘土沉积水体对水体硝化、反硝化细菌产生的不利影响,但是这种不利影响对硝化、反硝化脱氮效应影响的程度和时效性还有待进一步探讨. 由于水华蓝藻及其产生的微囊藻毒素本身对硝化、反硝化细菌有一定的竞争抑制作用[26-27],那么相比这种来自蓝藻的压力,改性粘土对硝化、反硝化细菌有没有形成更多的压力,有没有进一步对水体自净作用产生干扰,这一问题也有待进一步结合沉积物因素进行深入研究. 本研究补充了改性粘土除藻的部分研究空白,为其应用的安全性研究奠定了一定的基础数据.

图5 不同水华程度下PAC改性粘土的施用对水体Al3+(a)和Cl-浓度(b)的影响
4 结论
1)PAC改性粘土的施用对低水华水体蓝藻细胞的去除率达到96.04%±0.99%,高水华水体与低水华水体施用的去除率之间差异不显著,PAC改性粘土的施用能够在较长的时间内有效地控制水体中的蓝藻浓度.
2)PAC改性粘土沉降蓝藻第4 d后,蓝藻细胞膜出现了一定程度的不完整,细胞内规则的类囊体片层结构出现了实质性损伤. 水体中的DTN浓度出现迅速的上升,但DTP浓度仍可在较长一段时间内维持在较低水平.
3)随着PAC改性粘土沉积水体时间的增加,水体硝化、反硝化细菌数出现了显著下降.
4)PAC改性粘土施用下的藻毒素释放风险主要集中在高水华水体. 高水华水体中,PAC改性粘土施用导致MC-LR和MC-RR加速释放,其最高峰值分别达到空白对照组的1.69±0.09和2.04±0.09倍. 但PAC改性粘土施用并没有抑制藻毒素的降解,其水体MC-LR达到安全限(<1 μg/L)的时间明显早于空白对照组.
[1] Pan G, Zhang M, Chen Hetal. Removal of cyanobacterial blooms in Taihu Lake using local soils. I. Equilibrium and kinetic screening on the flocculation ofMicrocystisaeruginosausing commercially available clays and minerals.EnvironmentalPollution, 2006, 141(2): 195-200.
[2] Wu Xiaodong, Kong Fanxiang. The determination ofinsitugrowth rates of the bloomedMicrocystisin Meiliang Bay, Lake Taihu.ChinaEnvironmentalScience, 2008, 28(6): 552-555. [吴晓东, 孔繁翔. 水华期间太湖梅梁湾微囊藻原位生长速率的测定. 中国环境科学, 2008, 28(6): 552-555.]
[3] Papadimitriou T, Armeni E, Stalikas CDetal.Detection of microcystins in Pamvotis lake water and assessment of cyanobacterial bloom toxicity.EnvironmentalMonitoringandAssessment, 2012, 184(5): 3043-3052.
[4] Kong Fanxiang, Hu Weiping, Gu Xiaohongetal. On the cause of cyanophyta bloom and pollution in water intake area and emergency measures in Meiliang Bay, Lake Taihu in 2007.JLakeSci, 2007, 19(4): 357-358. DOI: 10.18307/2007.0401.[孔繁翔,胡维平,谷孝鸿等.太湖梅梁湾2007年蓝藻水华形成及取水口污水团成因分析与应急措施建议. 湖泊科学, 2007, 19(4): 357-358.]
[5] Lü Zhenlin. Practice and thoughts on comprehensive treatment of water pollution in Taihu Lake.JournalofHohaiUniversity:NaturalScience, 2012, 40(2): 123-128. [吕振霖. 太湖水环境综合治理的实践与思考. 河海大学学报: 自然科学版, 2012, 40(2): 123-128.]
[6] Anderson DM. Turning back the harmful red tide.Nature, 1997, 388: 513-514.
[7] Archambault MC, Bricelj VM, Grant Jetal. Effects of suspended and sedimented clays on juvenile hard clams,Mercenariamercenaria, within the context of harmful algal bloom mitigation.MarineBiology, 2004, 144(3): 553-565.
[8] Cuker BE. Suspended clays alter trophic interactions in the plankton.Ecology, 1993, 74(3): 944-953.
[9] Han MY, Kim W. A theoretical consideration of algae removal with clays.MicrochemicalJournal, 2001, 68(2/3): 157-161.
[10] Zou H, Pan G, Chen Hetal. Removal of cyanobacterial blooms in Taihu Lake using local soils II. Effective removal ofMicrocystisaeruginosausing local soils and sediments modified by chitosan.EnvironmentalPollution, 2006, 141: 201-205.
[11] Liu G, Fan C, Zhong Jetal. Using hexadecyltrimethyl ammonium bromide (CTAB) modified clays to clean theMicrocystisaeruginosablooms in Lake Taihu, China.HarmfulAlgae, 2010, 9: 413-418.
[12] Zhou Qing, Han Shiqun, Yan Shaohua. Simultaneous removal of phosphorus and algae in eutrophic waters by modified complexes of aluminium polychlorid and clay.EnvironmentalChemistry, 2015, 34(11): 2059-2066. [周庆, 韩士群, 严少华. 聚合氯化铝与黏土的改性对富营养水体磷和蓝藻的同步去除. 环境化学, 2015, 34(11): 2059-2066.]
[13] Lewis MA, Dantin DD, Walker CCetal. Toxicity of clay flocculation of the toxic dinoflagellate,Kareniabrevis, to estuarine invertebrates and fish.HarmfulAlgae, 2003, 2(4): 235-246.
[14] Cao Xihua, Song Xiuxian, Yu Zhiming. Removal efficiency of red tide organisms by modified clay and its impacts on cultured organisms.ChineseJournalofEnvironmentalScience, 2004, 25(5): 148-152.[曹西华, 宋秀贤, 俞志明. 改性粘土去除赤潮生物及其对养殖生物的影响. 环境科学, 2004,25(5): 148-152.]
[15] Tian Juan, Song Biyu, Lin Shenetal. Removal of colonialMicrocystisaeruginosausing two kinds of modified clays.JLakeSci,2009, 21(5): 669-674. DOI: 10.18307/2009.0509.[田娟, 宋碧玉, 林燊等. 两种改性粘土去除群体状铜绿微囊藻的比较.湖泊科学, 2009, 21(5): 669-674.]
[16] Editorial board of water and wastewater monitor the analytical method, State Environmental Protection Administration ed. Water and wastewater monitor the analytical method(4th ed). Beijing: China Environmental Science Press, 2002: 244-256. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法(第四版). 北京: 中国环境科学出版社, 2002: 244-256.]
[17] GB/T 5750.6-2006, Standard examination methods for drinking water—Metal parameters. [GB/T 5750.6-2006,生活饮用水标准检验方法金属指标.]
[18] GB/T 5750.6-2006, Standard examination methods for drinking water—Nonmetal parameters. [GB/T 5750.6-2006, 生活饮用水标准检验方法无机非金属指标.]
[19] Wintermans JFGM, Mots AD. Spectrophotometric characteristics of chlorophyll a and b and their phaeophytins in ethanol.BiochimicaetBiophysicaActa, 1965, 109(2): 448-453.
[20] Shen Ping, Fan Xiurong, Li Guangwu eds. Microbiology experiment. Beijing: China Higher Education Press, 2001: 214-215. [沈萍, 范秀容, 李广武. 微生物学实验. 北京: 高等教育出版社, 2001: 214-215.]
[21] Zhang Guangya, Chen Meici, Min Hangetal. Reasearch of N2O flux from greenhouse and nitrifier and denitrifier numbers.PlantNutritionandFertilizerScience, 2002, 8(2): 239-243. [张光亚, 陈美慈, 闵航等. 设施栽培土壤氧化亚氮释放及硝化、反硝化细菌数量的研究. 植物营养与肥料学报, 2002, 8(2): 239-243.]
[22] Jiang J, Kim CG. Comparison of algal removal by coagulation with clays and Al-based coagulants.SeparationScience&Technology, 2008, 43(7): 1677-1686.
[23] Sengco MR, Li AS, Tugend Ketal. Removal of red and brown tide cells using clay flocculation: I. laboratory culture experiments with gymnodinium breve and aureococcus anophagefferens.MarineEcologyProgress, 2001, 210(8): 41-53.
[24] Saçan MT, Oztay F, Bolkent S. Exposure ofDunaliellatertiolectato lead and aluminum: Toxicity and effects on ultrastructure.BiologicalTraceElementResearch, 2007, 120(1-3): 264-72.
[25] Han J, Jeon BS, Park HD. Cyanobacteria cell damage and cyanotoxin release in response to alum treatment.WaterScience&TechnologyWaterSupply, 2012, 12(5): 549-555.
[26] Zuo Xinyu. Preliminary studies on relationship betweenMicrocystissp. and nitrifying bacteria[Dissertation]. Wuhan: Huazhong Agricultural University, 2013. [左新宇. 微囊藻与硝化细菌相互关系的初步研究[学位论文]. 武汉:华中农业大学, 2013.]
[27] Yang Cuiyun. Studies on the ecophysiological effects of microcystins against microbes[Dissertation]. Wuhan:Institute of Hydrobiology, Chinese Academy of Sciences, 2007. [杨翠云. 微囊藻毒素对微生物的生理生态学效应[学位论文]. 武汉:中国科学院水生生物研究所, 2007.]
Impacts of PAC modified clay applied in the control of cyanobacteria bloom and left in water on water environment
ZHOU Qing, YANG Xiaojie & HAN Shiqun**
(InstituteofAgriculturalResourcesandEnvironmentalSciences,JiangsuAcademyofAgriculturalSciences,Nanjing210014,P.R.China)
It has become an important measure for emergency treatment of cyanobacteria by using modified clays to control algal blooms in coastal regions and aquaculture water.However, there is less research focusing on the security risks led by toxic algae which were attached on the modified clay and left in the water. In this paper, PAC modified clay was selected for simulation experiments.The effects of applying the modified clay on the structure of cyanobacteria attached on the PAC modified clay, release and reduction of nutrients and microcystins, and the amounts of other functional bacteria (nitrifying-denitrifying bacteria) were investigated. The results showed that algae removal rate of modified clay applied in the slightly blooming water was 96.04%±0.99%. There was not a significant difference of algae removal rate inslightly blooming water and severely blooming water. Application of the modified clay effectively controlled the concentration of cyanobacteria in water for a long time. Transmission electron microscopy experiments revealed that cyanobacterial cell membrane became incomplete and the regular lamella structure was damaged after the cyanobacteria being settled with modified clay for 4 days. With the damage of cyanobacteria attached on PAC modified clay, the content of dissoloved total nitrogen in water increased rapidly, while the content of dissoloved total phosphorus could be maintained at a low concentration for a long time. With the application of PAC modified clay in water, the total bacteria number in the water was in agreement with that of the blank control, while the number of nitrifying-denitrifying bacteria decreased significantly. The releasing risks of microcystins after loading the modified clay mainly happened in the severely blooming water. The application of PAC modified clays in severely blooming water resulted in an accelerating release of MC-LR and MC-RR. The peak value of MC-LR and MC-RR amounts were 1.69±0.09 times and 2.04±0.09 times larger than that in control case,respectively. But the time of MC-LR amount reaching to the safety limit(<1 μg/L)was shortened for about 8 days, compared to the control case. In addition, the application of PAC modified clay in water did not lead to excessive concentrations of Al3+and Cl-.
PAC modified clay; cyanobacteria bloom; nutrients release; microcystins release; nitrifying-denitrifying bacteria
*国家水体污染控制与治理科技重大专项(2012ZX07103-002)和江苏省自然科学基金项目(BK20130730)联合资助. 2016-05-24收稿;2016-08-05收修改稿. 周庆(1980~),女,博士研究生,副研究员;E-mail:qqzhouqing@hotmail.com.
J.LakeSci.(湖泊科学), 2017, 29(2): 343-350
DOI 10.18307/2017.0210
©2017 byJournalofLakeSciences
**通信作者; E-mail:shyan@jaas.ac.cn.
