藏药复方多血康胶囊对脂多糖诱导急性肺损伤小鼠的保护作用Δ
2017-04-12胡晓鑫杜蕾蕾降拥四郎成都中医药大学民族医药学院成都611137
胡晓鑫,罗 强,杜蕾蕾,张 艺,降拥四郎(成都中医药大学民族医药学院,成都 611137)
·民族医药·
藏药复方多血康胶囊对脂多糖诱导急性肺损伤小鼠的保护作用Δ
胡晓鑫*,罗 强,杜蕾蕾,张 艺,降拥四郎#(成都中医药大学民族医药学院,成都 611137)
目的:考察藏药复方多血康胶囊对脂多糖诱导急性肺损伤小鼠的保护作用。方法:将60只KM小鼠随机分为空白组、模型组、地塞米松组(阳性对照,1 mg/kg)和复方多血康胶囊高、中、低剂量组(3.6、1.8、0.9 g/kg,以生药计),每组10只。ig给药,空白组和模型组小鼠ig等体积生理盐水,每天1次。连续给药7 d后,除空白组外,其余各组小鼠均ip脂多糖诱导急性肺损伤。造模6 h后,观察小鼠肺组织病理改变,测量肺组织含水量,检测肺组织中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)水平以及血清中白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)水平。结果:与空白组比较,模型组小鼠肺组织发生充血水肿、炎症细胞浸润、肺泡间隔及肺泡壁明显增宽等病理变化,肺组织含水量和肺组织中MDA水平以及血清中IL-6、TNF-α水平均显著升高(P<0.01),肺组织中SOD、GSH-Px水平显著降低(P<0.05)。与模型组比较,各给药组小鼠肺组织损伤程度均不同程度降低;除复方多血康胶囊低剂量组大鼠肺组织含水量、肺组织中MDA水平以及血清中TNF-α水平变化不明显外,其余各给药组小鼠上述指标均显著改善(P<0.05或P<0.01)。结论:藏药复方多血康胶囊可明显减轻小鼠氧化应激和炎症反应,对脂多糖诱导的急性肺损伤小鼠有一定保护作用。
藏药;复方多血康胶囊;急性肺损伤;炎症;氧化应激;小鼠
藏药复方多血康胶囊由红景天、沙棘、余甘子、干姜4味药材组成,为藏医大师措如·才郎的临床经验方,常用于治疗红细胞增多症。方中红景天养肺清热[1];沙棘除肺病,治培根病;余甘子治培根病、赤巴病、血病;干姜引肺脓、生胃火[2]。现代研究表明,红景天对高原肺动脉高压和大鼠急性肺损伤均有保护作用[3-4]。武冬梅等[5]研究发现,沙棘提取物异鼠李素对脂多糖(LPS)诱导小鼠肺损伤有明显的抑制炎症反应的作用。本课题组前期已对复方多血康胶囊治疗红细胞增多症展开了相关药效学及机制研究[6-7],但关于其对急性肺损伤的药理作用研究未见报道。本研究采用LPS复制小鼠急性肺损伤模型,探究复方多血康胶囊对急性肺损伤小鼠的保护作用,为后期治疗肺部疾病的新药开发提供药效学基础。
1 材料
1.1 仪器
550型酶标仪(美国Bio-Rad公司);UV-1800型紫外-可见分光光度计(上海美谱达仪器有限公司);TDZ5-WS型离心机(湘仪离心机仪器有限公司);CT15RT型台式高速冷冻离心机(上海天美生化仪器设备工程有限公司);cx41型光学显微镜(日本Olympus公司)。
1.2 药品与试剂
复方多血康胶囊(成都中医药大学民族医药学院自制,批号:20160515,规格:每1 g胶囊内容物相当于2.5 g原药材);醋酸地塞米松片(辰欣药业股份有限公司,批号:150527205,规格:0.75 mg/片);二喹啉甲酸(BCA)蛋白定量试剂盒和白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)酶联免疫吸附(ELISA)试剂盒(联科生物技术有限公司,批号:6219116、220660242、228260425);超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(南京建成生物工程研究所,批号:20160504、20160518、20160517);其余试剂均为分析纯。
1.3 动物
SPF级KM小鼠,60只,♂,6~8周龄,体质量为(20±2)g,由成都达硕生物科技有限公司提供[实验动物生产许可证号:SCXK(川)2013-24]。
2 方法
2.1 分组与造模
将60只小鼠适应性喂养7 d,然后随机分为空白组、模型组、地塞米松组(阳性对照,1 mg/kg)[8]和复方多血康胶囊高、中、低剂量组(3.6、1.8、0.9 g/kg,以生药计,根据成人临床剂量的20、10、5倍剂量换算而得),每组10只。将复方多血康胶囊溶于生理盐水中,制备成按生药计质量浓度分别为0.36、0.18、0.09 g/mL的药液。各给药组小鼠ig相应药液(10 mL/kg),空白组和模型组小鼠ig等体积生理盐水,每天1次,连续给药7 d。末次给药1 h后,空白组小鼠ip等体积生理盐水(10 mL/kg),其余各组小鼠均ip LPS(10 mg/kg)诱导急性肺损伤模型[9],注射完后动物自由摄食及饮水。
2.2 取材与指标检测
造模6 h后,各组小鼠摘眼球采血[10],1 500×g离心10 min,取血清,置于-80℃超低温冰箱中冻存,按照试剂盒说明书操作测定血清中TNF-α、IL-6水平。将小鼠处死后打开胸腔,暴露肺组织,以磷酸盐缓冲液(PBS)灌注右心室直至流出液体清澈,分离小鼠完整肺组织。用预冷的PBS冲洗肺组织3次清除残血,然后用滤纸吸干,再将肺组织分为左、右两叶,肉眼观察肺组织形态学变化。然后将左侧肺组织放于扁形称量瓶中称湿质量,测定肺组织含水量。右侧肺组织上叶用10%中性甲醛固定,采用苏木精-伊红(HE)染色法观察肺组织形态学变化;剩余右肺组织制作为10%肺组织匀浆,按质量(g)∶体积(mL)=1∶9的比例将肺组织移至冰冷PBS中,剪碎,电动匀浆机匀浆,4℃下2 000×g离心10 min,取上清液,-80℃超低温冰箱冻存,按照试剂盒说明书操作测定肺组织中SOD、MDA、GSH-Px水平。
2.3 统计学方法
3 结果
3.1 血清中IL-6、TNF-α水平及肺组织含水量测定结果
与空白组比较,模型组小鼠血清中IL-6、TNF-α水平明显升高,肺组织含水量明显增加(P<0.01)。与模型组比较,除复方多血康胶囊低剂量组小鼠血清中TNF-α及肺组织含水量变化不明显外,其余各给药组小鼠上述指标水平均明显降低(P<0.05或P<0.01)。结果见表1。
表1 各组小鼠血清中IL-6、TNF-α水平及肺组织含水量测定结果(±s,n=10)Tab 1 Determination results of the levels of IL-6,TNF-α in serum and water content in lung tissue of mice in each group(±s,n=10)
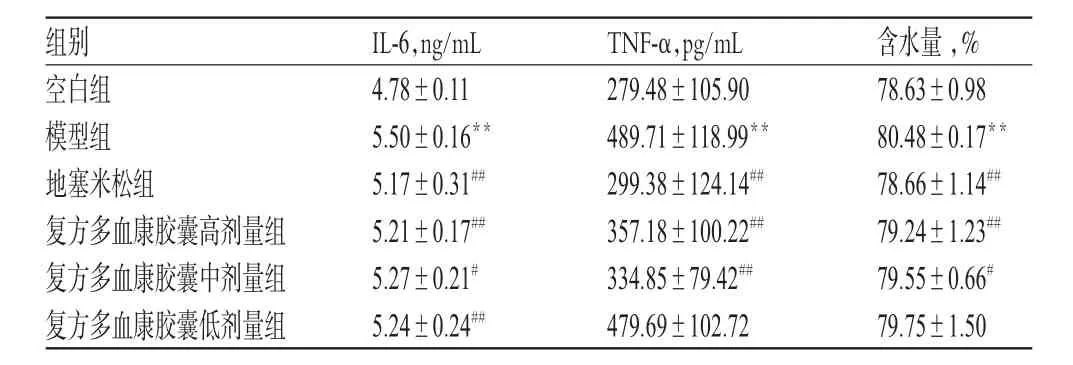
表1 各组小鼠血清中IL-6、TNF-α水平及肺组织含水量测定结果(±s,n=10)Tab 1 Determination results of the levels of IL-6,TNF-α in serum and water content in lung tissue of mice in each group(±s,n=10)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.blank group,**P<0.01;vs.model group,#P<0.05,##P<0.01
组别IL-6,ng/mL TNF-α,pg/mL含水量,% 78.63±0.98 80.48±0.17**78.66±1.14##79.24±1.23##79.55±0.66#79.75±1.50空白组模型组地塞米松组复方多血康胶囊高剂量组复方多血康胶囊中剂量组复方多血康胶囊低剂量组4.78±0.11 5.50±0.16**5.17±0.31##5.21±0.17##5.27±0.21#5.24±0.24##279.48±105.90 489.71±118.99**299.38±124.14##357.18±100.22##334.85±79.42##479.69±102.72
3.2 肺组织形态学观察结果
3.2.1 肉眼观察结果 空白组小鼠双肺饱满,呈粉红色,表面光滑,未见淤血,肺切面未见溢出粉红色液体。与空白组比较,模型组小鼠肺体积增大,被膜光亮、湿润,表面呈红褐色或暗紫色,可见点状或片状出血,部分剪断气管时有粉红色泡沫样液体流出。与模型组比较,地塞米松组小鼠肺体积减小,出血点减少;复方多血康胶囊各剂量组小鼠病变均不同程度减轻,其中复方多血康胶囊高、中剂量组小鼠肺组织体积正常,表面红润,肺表面未见明显出血斑,剪断气管时无液体流出;复方多血康胶囊低剂量组小鼠肺组织改善效果不及高、中剂量组明显,结果见图1。
3.2.2 HE染色结果 空白组小鼠肺组织结构正常,肺泡腔清晰,各级支气管壁及肺泡间隔无水肿或炎症细胞浸润。模型组小鼠肺组织变化明显,肺组织正常结构消失,出现弥漫性肺水肿,肺泡间隔及肺泡壁明显增宽,肺泡和间质充血且有大量炎症细胞浸润,肺泡腔出现渗出液。与模型组比较,地塞米松组小鼠肺泡结构完整,肺间隔未见明显增厚;复方多血康胶囊高剂量组小鼠肺间隔增厚较轻、炎症细胞较少、出血现象较轻,中、低组小鼠肺组织的病理变化改善不及高剂量组,结果见图2。
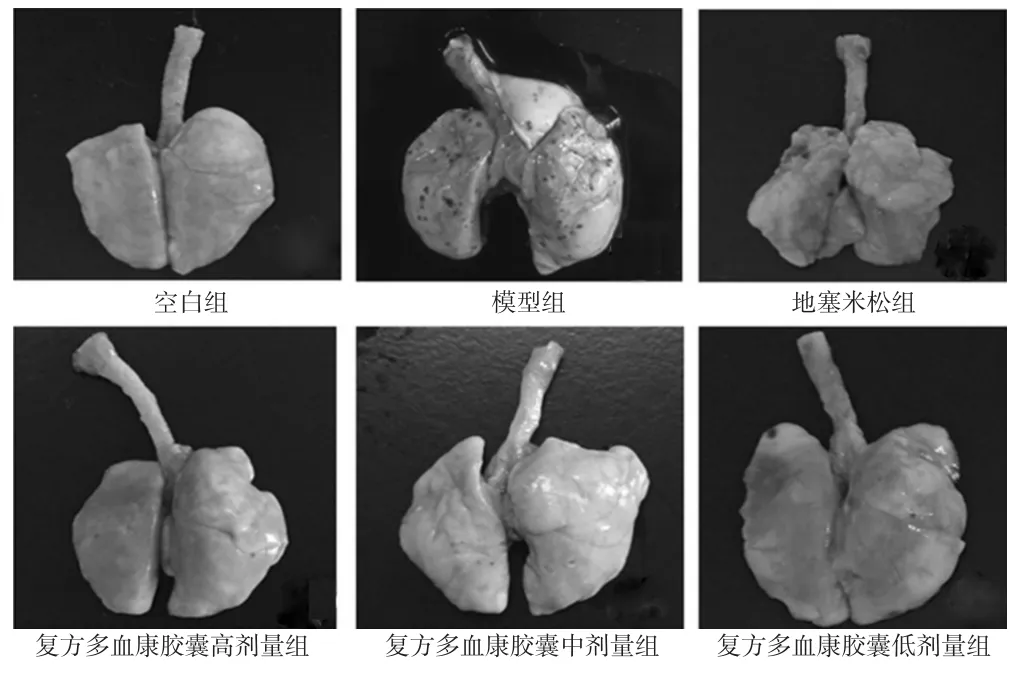
图1 肉眼观察肺组织形态学改变Fig 1 Morphological changes of lung tissue by visual observation
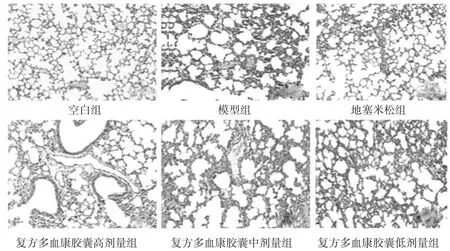
图2 光镜下观察小鼠肺组织的病理学变化(HE染色,× 10)Fig 2 Histopathological changes of lung tissue observed under light microscopy(HE staining,×10)
3.3 肺组织中MDA、SOD和GSH-Px水平测定结果
与空白组比较,模型组小鼠肺组织中MDA水平明显升高(P<0.01),SOD、GSH-Px水平明显降低(P<0.01)。与模型组比较,除复方多血康胶囊低剂量组小鼠肺组织中MDA水平降低不明显外,其余各给药组小鼠上述指标均明显改善(P<0.05或P<0.01),结果见表2。
4 讨论
急性肺损伤的发病机制主要是炎症反应所导致的各种急性、进行性缺氧性呼吸衰竭。如何减轻这种组织损伤、降低炎症反应对机体的危害是目前研究的热点[11]。LPS是革兰氏阴性菌感染时细菌崩解所释放的一种物质,又叫内毒素,可作为抗原激活机体的免疫应答,诱使TNF-α、IL-6等炎症细胞因子的释放[12],近年来成为研究急性肺损伤的理想致伤剂[9-10,12]。LPS的给药途径有通过气道内滴入、腹腔注射、雾化吸入、静脉注射等[13]。前2种给药途径在急性肺损伤小鼠模型中使用较多,但是气道内滴入LPS较腹腔注射操作复杂,故本研究最终选择腹腔注射LPS的给药方式进行造模。结果显示,给予LPS后小鼠肺组织形态学、病理学、含水量变化均符合肺损伤模型特征,提示造模成功。此外,已有研究表明在急性肺损伤发生早期给予中、低剂量地塞米松可以减轻肺组织损伤[8],故本实验采用地塞米松作为阳性对照药物。
表2 各组小鼠肺组织中MDA、SOD和GSH-Px水平测定结果(±s,n=10)Tab 2 Determination results of MDA,SOD and GSHPx levels in lung tissue of mice in each group(±s,n=10)
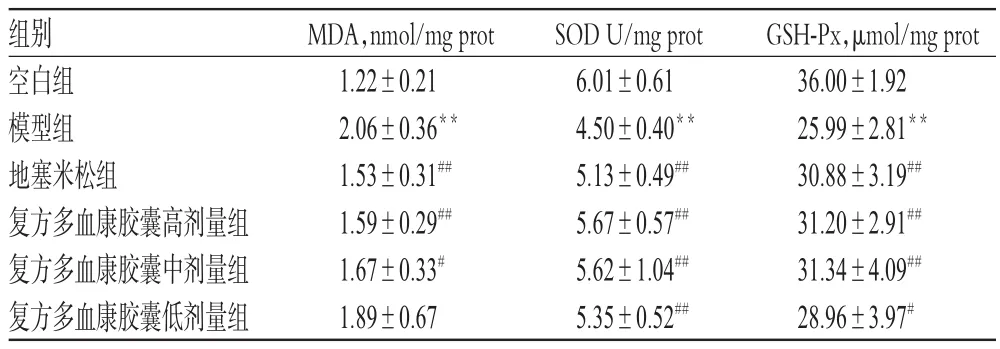
表2 各组小鼠肺组织中MDA、SOD和GSH-Px水平测定结果(±s,n=10)Tab 2 Determination results of MDA,SOD and GSHPx levels in lung tissue of mice in each group(±s,n=10)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.blank group,**P<0.01;vs.model group,#P<0.05,##P<0.01
GSH-Px,μmol/mg prot36.00±1.9225.99±2.81**30.88±3.19##31.20±2.91##31.34±4.09##28.96±3.97#组别空白组模型组地塞米松组复方多血康胶囊高剂量组复方多血康胶囊中剂量组复方多血康胶囊低剂量组MDA,nmol/mg prot1.22±0.212.06±0.36**1.53±0.31##1.59±0.29##1.67±0.33#1.89±0.67SOD U/mg prot6.01±0.614.50±0.40**5.13±0.49##5.67±0.57##5.62±1.04##5.35±0.52##
SOD是生物体内重要的抗氧化酶。当肺损伤时,SOD的生成及活性受到炎症因子的抑制,在清除氧自由基时消耗剧烈,从而降低了SOD的含量及活性。MDA是脂质过氧化物的主要产物,与机体内氧自由基的生成量及其活性成正比,故当发生急性肺损伤时,MDA的含量增加[14]。GSH-Px是一种在机体内广泛存在的过氧化物分解酶,能催化谷胱甘肽(GSH)变为GSH-Px,使有毒的过氧化物还原成无毒的羟基化合物,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害[15]。在本研究中,笔者评估了复方多血康胶囊对LPS诱导小鼠肺氧化应激的作用。结果表明,模型组小鼠肺组织中MDA水平升高,SOD、GSH-Px水平降低,提示机体氧化与抗氧化平衡失调;复方多血康胶囊各剂量组肺组织中MDA水平均降低,SOD、GSH-Px水平均升高,表明复方多血康胶囊可以降低LPS诱导的氧化应激反应,发挥肺保护作用。
LPS刺激并活化单核-巨噬细胞,致使相关炎症细胞合成并分泌大量的炎症介质,对组织产生广泛的损害效应。TNF-α被认为是感染性急性肺损伤发病中较为重要的细胞因子。LPS诱导单核细胞、巨噬细胞活化分泌TNF-α,可进一步作为主要的促炎性细胞因子诱导IL-6的生成[12]。本研究中,模型组小鼠血清中TNF-α和IL-6的分泌量较基础水平均有所升高,提示在LPS致肺组织损害的过程中发生了炎症反应。而复方多血康胶囊各剂量组小鼠血清中TNF-α、IL-6水平明显降低,提示复方多血康胶囊对急性肺损伤过程中炎症因子有抑制作用。
综上所述,藏药多血康胶囊可改善由LPS引起的小鼠急性肺损伤的症状,减轻肺损伤程度,增加肺组织中抗氧化酶产生,减少血液中炎症介质的产生和渗出,对LPS诱导的急性肺损伤小鼠具有一定的保护作用。笔者推测其保护作用机制可能与其保护肺部血管内皮细胞功能、减少大分子物质渗出相关,但有待进—步的研究证实。
[1] 帝玛尔·丹增彭措.晶珠本草[M].毛继祖,罗达尚,王振华,等,译.上海:上海科学技术出版社,2012:149.
[2] 罗达尚.新修晶珠本草[M].成都:四川科学技术出版社,2004:438、462、685.
[3] 佟昌慈,柳云恩,金红旭,等.红景天苷对脂多糖诱导的急性肺损伤的保护机制研究[J].临床急诊杂志,2015,16(9):667-671.
[4] 白玛康卓,郭燕,边巴顿珠,等.藏药红景天减弱高原肺动脉高压大鼠肺小血管病理变化和血管内皮生长因子的增高[J].生理学报,2011,63(2):143-148.
[5] Yang B,Li XP,Ni YF,et al.Protective effect of isorhamnetion on lipopolysaccharide induced acute lung injury in mice[J].Inflammation,2016,39(1):1-9.
[6] 伍文彬,赖先荣,索朗其美,等.多血康对高原红细胞增多症的影响研究[J].中药药理与临床,2009,25(5):93-95.
[7] 伍文彬,赖先荣,索朗其美,等.藏药多血康对家兔血瘀症模型全血黏度及红细胞流变性的影响[J].西藏科技,2009(2):39-40.
[8] 李成玉.地塞米松对脂多糖致大鼠急性肺损伤的治疗作用[D].遵义:遵义医学院,2010.
[9] 朱贲贲,马晓鹂,吴科锋,等.13-甲基嘌呤对脂多糖诱导小鼠急性肺损伤的保护作用及其机制研究[J].中国药房,2016,27(4):464-467.
[10] 宣国平,张琳,钟明媚.脂多糖致大鼠急性肺损伤模型取材时间选择[J].中华实用诊断与治疗杂志,2015,29(2):136-138.
[11] Butt Y,Kurdowska A,Allen TC.Acute lung injury:a clinical and molealar review[J].Arch Pathol Lab Med,2016,140(4):345-350.
[12] 刘中原,李延平.细菌脂多糖的生物活性及作用机制[J].医学综述,2010,16(2):166-169.
[13] 祖峰.不同气管滴注方法在小鼠急性肺损伤模型中的比较性研究[D].长春:吉林大学,2010:18.
[14] 张秋萍,吴霞红,郑剑恒,等.生物样本中丙二醛测定方法研究进展[J].理化检验(化学分册),2016,58(8):979-985.
[15] 郭笑,陈冬雪,韩笑,等.人谷胱甘肽过氧化物酶的生物信息学分析[J].北华大学学报(自然科学版),2016,17(6):750-755.
Protective Effect of Tibetan Medicine Compound Duoxuekang Capsules on Acute Lung Injury in Mice Induced by Lipopolysaccharide
HU Xiaoxin,LUO Qiang,DU Leilei,ZHANG Yi,JIANGYONG Silang(College of Ethnic Medicine,Chengdu University of Traditional Chinese Medicine,Chengdu 611137,China)
OBJECTIVE:To investigate the protective effect of Tibetan medicine Compound Duoxuekang capsules on the acute lung injury in mice induced by lipopolysaccharide.METHODS:60 KM mice were randomly divided into blank group,model group,dexamethasone group(positive control,1 mg/kg)and Compound Duoxuekang high-dose,medium-dose,low-dose groups(3.6,1.8,0.9 g/kg,calculated by crude drug),10 in each group.Intragastrically administrated,mice in blank group and model group intragastrically administrated equal volume of normal saline,once a day.After 7 d of administration,except for blank group,mice in other groups intraperitoneally injected lipopolysaccharide to induce acute lung injury.After 6 h modeling,pathological changes in the lung tissue was observed,lung tissue water content was measured,superoxide dismutase(SOD),glutathione peroxidase(GSH-Px),malondialdehyde(MDA)levels in lung tissue and IL-6,TNF-α levels in serum were detected.RESULTS:Compared with blank group,mice in model group showed pathological changes in congestion and edema,inflammatory cell infiltration,obvious widened alveolar septum and alveolar wall;water content in lung tissue and IL-6,TNF-α levels in serum were significantly increased(P<0.01);SOD,GSH-Px levels in lung tissue were significantly decreased(P<0.01).Compared with model group,injury degree of lung tissue reduced to varying degrees in each treatment group,except for the water content,MDA level in lung tissue and TNF-α level in serum in Compound Duoxuekang capsules low-dose group;the above-mentioned indexes in other groups were significantly improved(P<0.05 or P<0.01).CONCLUSIONS:Compound Duoxuekang capsules can obviously reduce mice’s oxidative stress and inflammatory response,and has certain protective effect on acute lung injury in mice.
Tibetan medicine;Compound Duoxuekang capsules;Acute lung injury;Inflammation;Oxidative stress;Mice
R965
A
1001-0408(2017)07-0926-04
2016-10-02
2016-12-23)
(编辑:林 静)
国家自然基金青年项目(No.8150141651);成都中医药大学科技发展基金资助项目(No.030018002,CGPY1503);医药行业科研专项(No.201507002)
*硕士研究生。研究方向:民族医学。电话:028-31800400。E-mail:Hxxsunny520@163.com
#通信作者:藏医主任医师,教授,硕士生导师。研究方向:南派藏医药。电话:028-61800400。E-mail:dwyx110520@qq.com
DOI10.6039/j.issn.1001-0408.2017.07.18
