复合微生态制剂对断奶仔猪生长性能、腹泻率、免疫性能和肠道菌群的影响
2017-04-11谢全喜亓秀晔于佳民徐海燕
谢全喜 亓秀晔 陈 振 于佳民 徐海燕 谷 巍
(山东宝来利来生物工程股份有限公司,泰安271000)
复合微生态制剂对断奶仔猪生长性能、腹泻率、免疫性能和肠道菌群的影响
谢全喜 亓秀晔 陈 振 于佳民 徐海燕 谷 巍
(山东宝来利来生物工程股份有限公司,泰安271000)
本试验旨在研究复合微生态制剂对断奶仔猪生长性能、腹泻率、免疫性能和肠道菌群的影响。选取(30±2)日龄平均体重为(8.15±0.05) kg的莱芜黑猪断奶仔猪96头,随机分为4组,每组6个重复(公母各占1/2),每个重复4头猪。Ⅰ组为对照组,饲喂不添加任何益生菌和抗生素的基础饲粮;Ⅱ组为复合微生态制剂组,在基础饲粮中添加1.0‰肽菌素;Ⅲ组为抗生素组,在基础饲粮中添加500 mg/kg硫酸黏杆菌素;Ⅳ组为肽菌素和抗生素混用组,在基础饲粮中添加1.0‰肽菌素的同时添加200 mg/kg的喹乙醇和110 mg/kg的吉他霉素。预试期3 d,正试期28 d。结果表明,1)Ⅱ组平均日增重较Ⅰ、Ⅲ和Ⅳ组分别显著提高了13.16%、15.77%和10.66%(P<0.05),F/G分别显著降低了8.54%、12.10%和6.50%(P<0.05)。与Ⅰ组相比,Ⅱ、Ⅲ和Ⅳ组均显著降低了仔猪腹泻率(P<0.05)。2)与Ⅰ和Ⅲ组相比,Ⅱ组肝脏指数和脾脏指数分别提高了12.13%、24.76%和14.60%、12.45%,血清免疫球蛋白G和免疫球蛋白A含量分别提高了49.73%、37.50%和61.05%、46.67%,且差异均显著(P<0.05)。3)与Ⅰ和Ⅲ组相比,Ⅱ组显著降低了胃和十二指肠内容物的pH(P<0.05),且显著提高了盲肠和结肠中乳酸杆菌数量(P<0.05)。由此可知,本试验条件下,饲粮添加1.0‰复合微生态制剂肽菌素可改善断奶仔猪生长性能,降低腹泻率,促进免疫器官的发育,提高血清中免疫球蛋白含量,增强仔猪免疫力,降低胃和十二指肠内容物pH,改善肠道菌群平衡。
肽菌素;断奶仔猪;抗生素;生长性能;腹泻率;免疫性能;肠道菌群
断奶是养猪生产过程中最重要的环节之一,早期断奶可以提高母猪的生产效率,并且降低饲养成本[1]。但仔猪肠道免疫系统一般在4~7周龄时才能基本发育成熟,因此早期断奶仔猪自身产生免疫抗体水平和细胞免疫能力较低,同时中断了母源免疫抗体的提供,使仔猪表现出显著的免疫抑制[2]。在现代养猪生产模式中,强制早期断奶可造成仔猪心理、饲粮和环境等应激,极易引起断奶应激综合征,会对仔猪生长性能及自身肠道健康产生不良的影响,导致仔猪肠道菌群失调、采食量下降、生长缓慢、腹泻甚至死亡,造成严重的经济损失[3-4]。因此确保仔猪顺利断奶对提高养猪效益具有重要的意义。饲用抗生素具有显著的抗病、抗应激和促生长效果,实际生产中往往选择抗生素来治疗和预防仔猪疾病,来达到减缓应激和促进生长的目的[5]。但随着全球经济一体化地不断加剧,中国畜牧业的相关标准与法律法规也必然要和世界上畜牧业发达国家相接轨,“饲料禁抗”亦在其中。随着老百姓生活水平地不断提高,公众对于食品安全越来越重视,对于抗生素在畜禽产品中的残留也更加关注,来自社会的压力将会促使“饲料禁抗”成为必然。从当前中国养殖业的实际情况来看,抗生素的滥用和乱用对养殖业带来了很大的影响,过多使用抗生素导致仔猪肠道细菌耐药性增强,打破原有菌群平衡状态,最终导致仔猪严重腹泻甚至死亡[6]。因此,寻求绿色环保型饲料添加剂是解决抗生素产生负面影响的有效途径之一。
益生菌是抗生素的最佳替代品之一,是能够改善宿主肠道菌群结构并提高宿主健康水平和健康状态的活菌制剂及其代谢产物[7]。目前,微生态制剂已广泛应用在断奶仔猪饲粮中,用来改善仔猪肠道菌群平衡和减缓早期断奶应激。近年来关于饲粮中添加复合益生菌对断奶仔猪生长发育、腹泻情况、免疫性能和肠道菌群等方面的影响研究较多。刘虎传等[8]研究发现,饲粮中添加复合益生菌可显著提高断奶仔猪的平均日增重(ADG),显著降低料重比(F/G)。李焕友等[9]在断奶仔猪饲粮中添加600 mg/kg的益生菌制剂,可取代饲粮中的抗生素类药物添加剂。赵京杨等[10]研究发现,将乳酸杆菌、酵母菌、芽孢杆菌和白地霉等活菌制成的液态复合微生态制剂饲喂断奶仔猪,显著降低了腹泻率。雷详前等[11]在断奶仔猪饲粮中添加1 000 mg/kg复合益生菌制剂,ADG较200 mg/kg土霉素组显著提高了13.52%,较300 mg/kg痢特灵组显著提高了14.49%。肖宏德等[12]研究发现,用复合益生菌制剂代替断奶前后仔猪饲粮中的抗生素,具有抗病、促生长效果,且在降低仔猪腹泻率上显著优于饲用抗生素。因此,本试验旨在研究公司产品肽菌素部分或全部替代断奶仔猪饲粮中的抗生素,对断奶仔猪进行饲喂试验,测定其对断奶仔猪生长性能、腹泻率、免疫性能和肠道菌群的影响,为肽菌素替代饲用抗生素在断奶仔猪应用中奠定理论和实践依据。
1 材料与方法
1.1 试验材料
复合微生态制剂——肽菌素:由植物乳杆菌、戊糖片球菌、枯草芽孢杆菌、丁酸梭菌、酵母菌及其培养物、曲霉及其培养物、抗菌肽CEC-38和柠檬酸等组成,活菌总数≥5.0×108CFU/g。
饲用抗生素:市售硫酸黏杆菌素、喹乙醇和吉他霉素,其中硫酸黏杆菌素纯度为10%、喹乙醇和吉他霉素纯度均为50%。
1.2 试验设计及饲粮组成
选用(30±2)日龄平均体重为(8.15±0.05) kg的莱芜黑断奶仔猪96头,随机分为4组,每组6个重复(公母各占1/2),每个重复4头猪,每个重复为1栏。Ⅰ组为对照组,饲喂不添加任何益生菌和抗生素的基础饲粮;Ⅱ组为复合微生态制剂组,在基础饲粮中添加1.0‰肽菌素;Ⅲ组为抗生素组,在基础饲粮中添加500 mg/kg硫酸黏杆菌素;Ⅳ组为肽菌素和抗生素混用组,在基础饲粮中添加1.0‰肽菌素的同时添加200 mg/kg的喹乙醇和110 mg/kg的吉他霉素。预试期3 d,正试期28 d。
基础饲粮参照NRC(2012)标准配制,其组成及营养水平见表1。

表1 基础饲粮组成及营养水平(风干基础)

续表1项目Items含量Content赖氨酸Lys1.24蛋氨酸Met0.40苏氨酸Thr0.70色氨酸Try0.19
1)预混料(不含抗生素)为每千克饲粮提供 The premix (without antibiotics) provided the following per kilogram of the diet: Fe 110 mg,Zn 100 mg,Cu 20 mg,Mn 15 mg,Se 0.3 mg,I 0.4 mg,VA 6 000 IU,VD 3 400 IU,VE 50 IU,VK32 mg,VB13.5 mg,VB25.5 mg,VB63.5 mg,VB1225.0 μg,生物素 biotin 0.05 mg,叶酸 folic acid 0.3 mg,D-泛酸D-pantothenic acid 20 mg,烟酸 niacin 20 mg,氯化胆碱 choline chloride 500 mg。
2)代谢能为计算值,其余为实测值。ME was a calculated value, while the others were measured values.
1.3 饲养管理
试验在山东宝来利来巴夫农业科技有限公司宁阳试验猪场进行,所有仔猪在封闭式猪舍中饲养,水泥地面,自由采食和饮水,驱虫、消毒及免疫均按猪场常规饲养管理程序进行。
1.4 测定指标
1.4.1 生长性能
试验全程以栏为单位记录采食量,第1天和第28天08:00对每头仔猪空腹称重,计算第1~28天的ADG、平均日采食量(ADF1)及F/G。具体计算公式如下:
ADG=栏总增重/(栏仔猪数×试验天数);
ADFI=栏总采食量/(栏仔猪数×试验天数);
F/G=ADFI/ADG。
1.4.2 腹泻率
试验期内每天09:00和15:00分别观察仔猪粪便,根据史自涛等[4]的方法对粪便进行评分。0分:粪便条形或粒状;1分:软粪、能成形;2分:稠状、不成形、粪水未分离;3分:液状、不成形、粪水分离。当粪便评分为2分或以上时认为仔猪发生腹泻,试验结束后计算各组的腹泻率(diarrhea rate,DR)。
腹泻率(%)=100×[试验期内每组仔猪腹泻头次
总数/(每组仔猪总头数×试验总天数)]。
1.4.3 免疫器官指数
试验结束时,每组每个重复选1头接近平均体重的仔猪屠宰,切开腹腔取肝脏和脾脏,去除结缔组织,用滤纸擦干血液,称取湿重,并计算器官指数。
器官指数(g/kg)=器官湿重/活体重。
1.4.4 胃肠道pH
试验结束时,每组每个重复选1头接近平均体重的仔猪屠宰,切开腹腔,采用PHB-2型便携式pH计测定胃、十二指肠、空肠、回肠和盲肠内容物的pH。
1.4.5 血清免疫指标
试验结束后,每组每个重复选1头接近平均体重的仔猪,前腔静脉采血,静置1 h后4 000 r/min离心10 min,分离血清。采用酶联免疫吸附法测定血清免疫球蛋白G(IgG)和免疫球蛋白A(IgA)含量,试剂盒由北京雅安达生物技术有限公司提供,具体操作按试剂盒说明书进行。
1.4.6 肠道菌群数量
试验结束时,每组每个重复选1头接近平均体重的仔猪屠宰,分别无菌操作采集盲肠和结肠内容物,在灭菌生理盐水中摇匀,用平板培养计数法计数肠道乳杆菌和大肠杆菌数量,菌群数量以每克肠道内容物所含细菌群落总数的对数[(lgCFU/g)]表示。在无菌操作台中称取1 g内容物于99 mL灭菌带有玻璃珠的生理盐水中摇匀,然后取1 mL于试管中,加入无菌0.9%生理盐水9 mL,振荡混匀,依次按10倍等比稀释至10-7。其中乳杆菌接种于乳酸菌选择性培养基(LBS)上培养,在37 ℃生化培养箱中厌氧培养48 h后进行菌落计数;大肠杆菌则接种于伊红美兰琼脂培养基上培养,在37 ℃生化培养箱中有氧培养24 h后进行菌落计数。
1.5 数据处理与分析
试验数据用Excel处理后,采用SPSS 13.0软件的ANOVA程序进行显著性分析,用LSD法进行多重比较,以P<0.05为差异显著性判断标准。测定结果以“平均值±标准差”表示。
2 结 果
2.1 复合微生态制剂对断奶仔猪生长性能和腹泻率的影响
由表2可知,各组初始体重差异均不显著(P>0.05),终末体重以Ⅱ最高,分别高出Ⅰ、Ⅲ和Ⅳ组5.69%、6.79%和4.89%,且差异均显著(P<0.05)。各组ADFI差异均不显著(P>0.05)。ADG以Ⅱ组最高,分别高出Ⅰ、Ⅲ和Ⅳ组13.16%、15.77%和10.66%,差异均显著(P<0.05)。F/G以Ⅱ组最低,分别低出Ⅰ、Ⅲ和Ⅳ组8.54%、12.10%和6.50%,差异均显著(P<0.05)。腹泻率以Ⅰ组最高,显著高于其余各组(P<0.05),其余3个组间差异均不显著(P>0.05)。

表2 复合微生态制剂对断奶仔猪生长性能和腹泻率的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2 复合微生态制剂对断奶仔猪免疫性能的影响
由表3可知,肝脏重量以Ⅳ组最高,其次是Ⅱ组,2组间差异不显著(P>0.05),但均显著高于Ⅰ和Ⅲ组(P<0.05)。脾脏重量除Ⅰ组外,其余各组间差异均不显著(P>0.05)。Ⅱ组肝脏指数和脾脏指数分别比Ⅰ和Ⅲ组提高了12.13%、24.76%和14.60%、12.45%,差异均显著(P<0.05),但与Ⅳ组差异不显著(P>0.05)。血清IgG和IgA含量均以Ⅱ组最高,显著高于Ⅰ和Ⅲ组(P<0.05),但与Ⅳ组差异不显著(P>0.05)。

表3 复合微生态制剂对断奶仔猪免疫性能的影响
2.3 复合微生态制剂对断奶仔猪胃肠道内容物pH的影响
由表4可知,在试验的第28天,与Ⅰ组相比,Ⅱ组胃和十二指肠内容物的pH显著降低(P<0.05),分别降低了22.33%和16.56%;但Ⅱ组空肠、回肠和盲肠3个肠道内容物的pH差异不显著(P>0.05)。Ⅲ组胃、十二指肠、空肠、回肠和盲肠内容物的pH与Ⅰ组相比差异均不显著(P>0.05)。Ⅳ组胃和十二指肠内容物的pH显著低于Ⅰ组(P<0.05),分别降低了21.05%和14.33%;Ⅳ组空肠、回肠和盲肠3个肠道内容物的pH均低于Ⅰ组,但差异均不显著(P>0.05)。
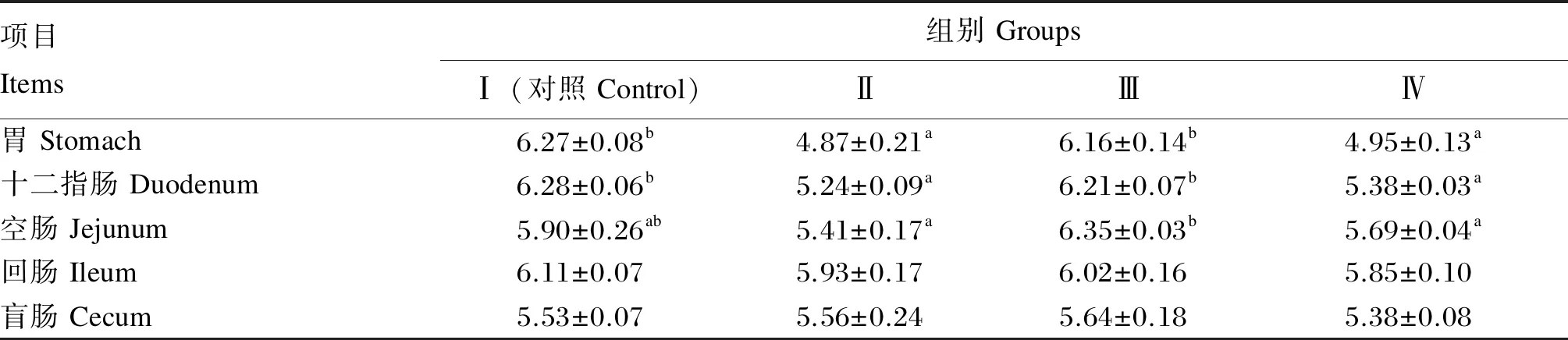
表4 复合微生态制剂对断奶仔猪胃肠道pH的影响
2.4 复合微生态制剂对断奶仔猪肠道菌群数量的影响
由表5可知,Ⅱ、Ⅲ和Ⅳ组盲肠和结肠大肠杆菌数量差异均不显著(P>0.05),但均显著低于Ⅰ组(P<0.05);Ⅱ组盲肠和结肠乳酸杆菌数量均显著高于其余各组(P<0.05),Ⅰ、Ⅲ和Ⅳ组间盲肠乳酸杆菌数量差异均不显著(P>0.05),Ⅰ组结肠乳酸杆菌数量显著高于Ⅲ和Ⅳ组(P<0.05),Ⅲ和Ⅳ组之间结肠乳酸杆菌数量差异不显著(P>0.05)。

表5 复合微生态制剂对断奶仔猪肠道菌群数量的影响
3 讨 论
3.1 复合微生态制剂对断奶仔猪生长性能和腹泻率的影响
仔猪断奶时因换料、病原性、生理性和环境等应激因素导致仔猪断奶应激综合征,严重影响早期断奶仔猪的成活率和养猪业的经济效益[13]。国内外研究者在断奶仔猪饲粮中添加中草药、酸化剂、酶制剂和微生态制剂等来缓解仔猪断奶应激综合征[14],研究发现益生菌可以替代抗生素应用在仔猪上,提高其采食量[15]和生长性能[16],并且提高机体免疫力[17],促进肠道内益生菌的生长并抑制有害菌的生长。尹清强等[18]报道,在仔猪的教槽料和保育料中分别加入0.10%和0.05%微生态制剂(有效菌数量分别为1×106和5×105CFU/g),可使仔猪的腹泻率和死亡率较对照组明显降低,且优于抗生素。本试验中,复合微生态制剂组显著提高了仔猪ADG,显著降低了F/G,效果均优于抗生素组和肽菌素和抗生素混用组,复合微生态制剂组ADG显著高于抗生素组15.77%,F/G显著降低了12.10%。复合微生态制剂组腹泻率显著低于对照组,但和抗生素组相比差异不显著。复合微生态制剂肽菌素缓解了仔猪断奶后产生的应激,提高了生长性能,在防治仔猪断奶腹泻方面可以达到抗生素同样的效果。
3.2 复合微生态制剂对断奶仔猪免疫性能的影响
动物机体的器官指数是一种生物学特性指标,它的大小在一定程度上决定了其功能的强弱[19-20]。肝脏是动物体内新陈代谢最旺盛的代谢器官,还担负着一定的免疫功能。脾脏是机体最大的外周免疫器官,是各种免疫细胞产生、分化、成熟、定居以及进行免疫应答的主要场所[21]。关于微生态制剂对断奶仔猪免疫器官影响的报道很多,王永等[22]在断奶仔猪饲粮中添加屎肠球菌发现其对肝脏指数影响不大,但显著提高了脾脏重量和脾脏指数。辛娜等[23]研究发现,添加0.75%芽孢杆菌组仔猪的胸腺指数比对照组提高了62.30%,脾脏指数提高了12.04%。本试验结果表明,第28天时,与对照组相比,复合微生态制剂组显著提高了仔猪的肝脏重量、脾脏重量、肝脏指数和脾脏指数,促进了肝脏和脾脏的发育。与抗生素组相比,复合微生态制剂组肝脏重量、脾脏重量、肝脏指数和脾脏指数分别提高了10.27%、8.03%、14.60%和12.45%,在促进肝脏和脾脏发育上肽菌素效果优于硫酸黏杆菌素的使用。1.0‰肽菌素+200 mg/kg喹乙醇+110 mg/kg吉他霉素复配使用在提高肝脏重量、脾脏重量、肝脏指数和脾脏指数方面与肽菌素单独使用差异均不显著,但均优于硫酸黏杆菌素的使用,说明肽菌素可以与喹乙醇和吉他霉素复配使用应用在断奶仔猪上。体液免疫力是动物机体产生抗体的能力,是动物抵抗疾病的重要机制[24]。IgA、IgG和免疫球蛋白M(IgM)能够特异性的与相应抗原结合,是机体体液免疫机能的主要物质,免疫球蛋白在血清中含量可以衡量机体的免疫机能[25]。张彩云等[26]在仔猪饲粮中添加芽孢杆菌,显著提高血清中IgG含量。本试验结果表明,复合微生态制剂组仔猪血清IgG和IgA含量分别高出对照组49.73%和37.50%、61.05%和46.67%,且差异均显著。
3.3 复合微生态制剂对断奶仔猪胃肠道内容物pH的影响
胃肠道是动物机体养分消化和吸收的主要场所,对断奶仔猪来说,胃肠道pH是影响其消化吸收的重要因素[27]。所以适宜的酸度是维持断奶仔猪消化系统正常生理功能的关键。研究表明,益生菌能增加仔猪肠道中挥发性脂肪酸的含量,降低肠道pH[28],抑制病原菌的增殖作用[29]。Hogberg等[30]研究发现,饲粮中益生菌含量升高时,仔猪肠道内挥发性脂肪酸含量显著增加,同时pH显著降低。辛娜等[31]研究发现,芽孢杆菌能显著降低空肠和盲肠的pH。乳酸菌可发酵产生大量的乳酸和乙酸,降低肠道pH。柠檬酸作为饲料添加剂主要应用在断奶仔猪上,能够降低饲粮的pH和缓冲能力[32],进而增加胃肠道内酸度,主要作用在胃和小肠前段部分。Risley等[33]在仔猪饲粮中添加1.5%的柠檬酸,饲粮pH由6.42降低到4.92,胃内容物的pH由4.07降到3.82。本试验结果表明,1.0‰肽菌素的使用显著降低了胃和十二指肠内容物的pH,与对照组相比,分别降低了22.33%和16.56%。上述结果说明仔猪饲粮中添加复合微生态制剂肽菌素可以降低胃肠道pH,抑制病原菌繁殖,维护仔猪肠道健康。
3.4 复合微生态制剂对断奶仔猪肠道菌群数量的影响
健康仔猪肠道中有害菌和有益菌应该处于一个动态平衡状态,当机体处于应激状态时(如断奶等),各肠段内有害菌量数量就会增加,有益菌量数量会降低。因此,控制好肠道菌群平衡是很关键的[34]。研究发现,在仔猪断奶阶段应用以乳酸菌为主的单一或复合益生菌能够干预并纠正肠道微生态体系失衡现象,促进其生长发育[35-36]。Bon等[37]研究发现,饲粮中添加酿酒酵母和乳酸片可显著减少粪便中大肠杆菌数量。Dong等[38]研究发现,饲喂断奶仔猪益生菌可以显著降低粪便中大肠杆菌的数量,提高生长性能和免疫力。本试验结果表明,饲粮添加1.0‰肽菌素可以显著提高盲肠和结肠乳酸杆菌数量,对有益菌增殖具有较好效果。与对照组相比,复合微生态制剂组可显著降低盲肠和结肠中大肠杆菌数量,对病原菌具有较好的抑菌效果。复合微生态制剂组与抗生素组间盲肠和结肠中大肠杆菌数量差异不显著,说明在断奶仔猪饲粮中添加适宜水平的肽菌素在抑制病原菌生长方面具有与抗生素一致的效果。
4 结 论
本试验条件下,饲粮添加1.0‰复合微生态制剂肽菌素可改善断奶仔猪生长性能,降低腹泻率,促进免疫器官的发育,提高血清中免疫球蛋白含量,增强仔猪免疫力,降低胃和十二指肠内容物pH,改善肠道菌群平衡。
[1] 周盟,张乃锋,董晓丽,等.益生菌对断奶仔猪生长性能、免疫器官指数及胃肠道pH的影响[J].动物营养学报,2014,26(2):445-452.
[2] 刘涛.谷氨酰胺对早期断奶仔猪肠道营养与免疫功能影响机理的研究[D].博士学位论文.武汉:华中农业大学,2002:8-28.
[3] HEO J M,OPAPEJU F O,PLUSKE J R,et al.Gastrointestinal health and function in weaned pigs:a review of feeding strategies to control post-weaning diarrhoea without using in-feed antimicrobial compounds[J].Journal of Animal Physiology and Animal Nutrition,2013,97(2):207-237.
[4] 史自涛,姚焰础,江山,等.粪肠球菌替代抗生素对断奶仔猪生长性能、腹泻率、血液生化指标和免疫器官的影响[J].动物营养学报,2015,27(6):1832-1840.
[5] HOFER U.Effects of in-feed antibiotics on pig microbiota[J].Nature Reviews Microbiology,2014,12(4):234.
[6] 王杰,艾萍萍,刁其玉,等.复合益生菌和纤维寡糖对断奶仔猪生长性能、粪便微生物及血清指标的影响[J].动物营养学报,2016,28(3):881-890.
[7] 晏雪勇,杨群,周希平,等.浅谈益生素在动物生产上的应用与研究进展[J].江西饲料,2010(5):16-18.
[8] 刘虎传,张敏红,冯京海,等.益生菌制剂对早期断奶仔猪生长性能和免疫指标的影响[J].动物营养学报,2012,24(6):1124-1131.
[9] 李焕友,甄辑铭,田萍,等.微生态制剂在断奶仔猪饲料中应用效果研究[J].饲料工业,2001,22(3):10-12.
[10] 赵京杨,吕茂洲,苏海涯.微生物制剂添加方式对哺乳断奶仔猪生产性能和腹泻率的影响[J].湖北农业科学,2002(5):124-126,131.
[11] 雷详前,张明海.微生态制剂对断奶仔猪增重和预防腹泻的效果[J].畜牧兽医杂志,2002,21(5):8-9.
[12] 肖宏德,肖运才,何熙贞,等.用益生菌制剂代替断奶仔猪日粮中抗生素的研究[J].动物医学进展,2014,35(3):53-58.
[13] 高印,王国军,来航线,等.益生菌发酵苹果渣对断奶仔猪生长性能、血清生化指标和粪便微生物菌群的影响[J].动物营养学报,2016,28(5):1515-1524.
[14] 卢俊鑫,杨金波,邝哲师,等.猪源性PR39抗菌肽对断奶仔猪生产性能、血清免疫指标和肠道菌群的影响[J].动物营养学报,2014,26(6):1587-1592.
[15] 王士长,陈静,潘健存,等.植物乳杆菌对断奶仔猪生产性能和血液生化指标的影响[J].中国畜牧兽医,2006,33(8):67-70.
[16] 张董燕,季海峰,王晶,等.猪源罗伊氏乳酸杆菌对断奶仔猪生长性能和血清指标的影响[J].动物营养学报,2011,23(9):1553-1559.
[17] WEN K,LI G H,BUI T,et al.High dose and low doseLactobacillusacidophilusexerted differential immune modulating effects on T cell immune responses induced by an oral human rotavirus vaccine in gnotobiotic pigs[J].Vaccine,2012,30(6):1198-1207.
[18] 尹清强,李小飞,常娟,等.微生态制剂对哺乳和断奶仔猪生产性能的影响及作用机理研究[J].动物营养学报,2011,23(4):622-630.
[19] RIVAS A L,FABRICANT J.Indications of immunodepression in chickens infected with various strains of Marek’s disease virus[J].Avian Diseases,1988,32(1):1-8.
[20] 陈佳力,陈代文,余冰,等.苯甲酸对断奶仔猪生长性能、器官指数和胃肠道内容物pH的影响[J].动物营养学报,2015,27(1):238-246.
[21] MAROUFYAN E,KASIM A,HASHEMI S R,et al.Change in growth performance and liver function enzymes of broiler chickens challenged with infectious bursal disease virus to dietary supplementation of methionine and threonine[J].American Journal of Animal and Veterinary Sciences,2010,5(1):20-26.
[22] 王永,杨维仁,张桂国.饲粮中添加屎肠球菌对断奶仔猪生长性能、肠道菌群和免疫功能的影响[J].动物营养学报,2013,25(5):1069-1076.
[23] 辛娜,刁其玉,张乃锋,等.芽孢杆菌制剂对断奶仔猪生长性能、免疫器官指数及胃肠道pH值的影响[J].饲料工业,2011,32(9):33-36.
[24] 吴海港,刘佳,左春生.中药添加剂对断奶仔猪生长性能、免疫功能及肠道微生物的影响[J].饲料研究,2016(6):16-19.
[25] 徐长跃,李杰,于艳,等.代谢有机酸对断奶仔猪血清免疫指标及甲状腺激素的影响[J].饲料工业,2016,37(12):6-9.
[26] 张彩云,刘来亭,杜灵广,等.酪酸芽孢杆菌对断奶仔猪生产性能和血清生化指标的影响[J].中国畜牧杂志,2009,45(13):43-45.
[27] 王珅,毕聪明,陈强,等.低聚果糖对断奶仔猪消化酶活性肠道菌群及胃肠酸碱度的影响[J].饲料研究,2014(11):28-30,43.
[28] 刘虎传,张敏红,李素霞,等.益生菌制剂对早期断奶仔猪肠道pH、黏膜形态结构和挥发性脂肪酸含量的影响[J].动物营养学报,2012,24(7):1329-1335.
[29] WANG J Q,YIN F G,ZHU C,et al.Evaluation of probiotic bacteria for their effects on the growth performance and intestinal microbiota of newly-weaned pigs fed fermented high-moisture maize[J].Livestock Science,2012,145(1/2/3):79-86.
[30] HÖGBERG A,LINDBERG J E.The effect of level and type of cereal non-starch polysaccharides on the performance,nutrient utilization and gut environment of pigs around weaning[J].Animal Feed Science and Technology,2006,127(3/4):200-219.
[31] 辛娜,张乃峰,周盟,等.芽孢杆菌制剂对断奶仔猪生长性能、胃肠道pH值及免疫器官指数的影响[J].中国饲料,2011(12):21-24.
[32] GIANNENAS I A,PAPANEOPHYTOU C P,TSALIE E,et al.The effects of benzoic acid and essential oil compounds in combination with protease on the performance of chickens[J].Journal of Animal and Feed Sciences,2014,23(1):73-81.
[33] RISLEY C R,KORNEGAY E T,LINDEMANN M D,et al.effect of feeding organic acids on selected intestinal content measurements at varying times postweaning in pigs[J].Journal of Animal Science,1992,70(1):196-206.
[34] 陈国旺,黄大鹏.谷氨酰胺和低聚异麦芽糖对断奶仔猪生长性能和肠道微生物的影响[J].饲料工业,2016,37(6):47-50.
[35] LIU H,JI H F,ZHANG D Y,et al.Effects ofLactobacillusbrevispreparation on growth performance,fecal microflora and serum profile in weaned pigs[J].Livestock Science,2015,178:251-254.
[36] MISHRA D K,VERMA A K,AGARWAL N,et al.Effect of dietary supplementation of probiotics on growth performance,nutrients digestibility and faecal microbiology in weaned piglets[J].Animal Nutrition and Feed Technology,2014,14(2):283-290.
[37] BON M L,DAVIES H E,GLYNM C,et al.Influence of probiotics on gut health in the weaned pig[J].Livestock Science,2010,133(1/2/3):179-181.
[38] DONG X L,ZHANG N F,ZHOU M,et al.Effects of dietary probiotics on growth performance,faecal microbiota and serum profiles in weaned piglets[J].Animal Production Science,2013,54(5):616-621.
Author, XIE Quanxi, professor, E-mail: xiequanxi@126.com
(责任编辑 武海龙)
Effects of Compound Probiotics on Growth Performance, Diarrhea Rate, Immunity Performance and Intestinal Microflora of Weaned Piglets
XIE Quanxi QI Xiuye CHEN Zhen YU Jiamin XU Haiyan GU Wei
(ShandongBaolai-LeelaiBioengineeringCo,Ltd.,Tai’an271000,China)
This trial was conducted to evaluate the effects of compound probiotics on growth performance, diarrhea rate, immunity performance and intestinal microflora of weaned piglets. A total of 96Laiwublack weaned piglets with an average body weight of (8.15±0.05) kg and at the age of (30±2) days were selected and divided into 4 groups with 6 replicates per group (half male and half female) and 4 piglets per replicate. The piglets in the control group (group Ⅰ) were only fed a basal diet without probiotics and antibiotics, the piglets in the compound probiotics group (group Ⅱ) were fed the basal diet+1.0‰ antibactierial probiotics, the piglets in the antibiotic group (group Ⅲ) were fed the basal diet+500 mg/kg colistin sulphate, and the others in the antibactierial probiotics and antibiotics mixed group (group Ⅳ) were fed the basal diet+1.0‰ antibactierial probiotics+200 mg/kg olaquindox+110 mg/kg kitasamycin. The pre-trial period lasted for 3 days, and the experiment lasted for 28 days. The results showed as follows: 1) the average daily gain of group Ⅱ was significantly increased by 13.16%, 15.77% and 10.66% than that of groups Ⅰ, Ⅲ and Ⅳ (P<0.05), and the ratio of feed to gain of group Ⅱ was significantly decreased by 8.54%, 12.10% and 6.50% than that of groups Ⅰ, Ⅲ and Ⅳ (P<0.05), respectively. Compared with group Ⅰ, the diarrhea rate of groups Ⅱ, Ⅲ and Ⅳ was significantly reduced (P<0.05). 2) Compared with groups Ⅰ and Ⅲ, the liver index and spleen index of group Ⅱ were significantly increased by 12.13%, 24.76% and 14.60%, 12.45% (P<0.05), respectively; the serum immunoglobulin G and immunoglobulin A contents of group Ⅱ were significantly increased by 49.73%, 37.50% and 61.05%, 46.67% (P<0.05), respectively. 3) Compared with groups Ⅰ and Ⅲ, the pH in stomach and duodenal contents of group Ⅱ was significantly decreased (P<0.05), the number ofLactobacillusin cecum and colon was significantly increased (P<0.05). In conclusion, under this experimental condition, the supplementation of 1.0‰ antibactierial probiotics in diets can improve growth performance, decrease weaning diarrhea, promote the development of immune organs, increase serum immunoglobulin contents, increase immunity of weaner piglets, and decrease the pH in stomach and duodenum contents, improve the balance of intestinal microflora.[ChineseJournalofAnimalNutrition, 2017, 29(3):850-858]
antibactierial probiotics; weaned piglets; antibiotics; growth performance; diarrhea rate; immunity performance; intestinal microflora
10.3969/j.issn.1006-267x.2017.03.015
2016-09-09
863课题——新型抗感染功能型微生态制剂研制与应用(2013AA102806)
谢全喜(1984—),女,山东聊城人,研究员,硕士,主要从事动物微生态制剂研发工作。E-mail: xiequanxi@126.com
S828
A
1006-267X(2017)03-0850-09
