繁殖母羊的氧化应激和氧化损伤研究
2017-04-11余思佳施东辉徐建雄徐维娜
余思佳 施东辉 朱 勇 徐建雄* 徐维娜 张 京
(1.上海交通大学农业与生物学院,上海市兽医生物技术重点实验室,上海200240;2.上海市崇明县动物疫病预防控制中心,上海202150)
繁殖母羊的氧化应激和氧化损伤研究
余思佳1施东辉2朱 勇2徐建雄1*徐维娜1张 京1
(1.上海交通大学农业与生物学院,上海市兽医生物技术重点实验室,上海200240;2.上海市崇明县动物疫病预防控制中心,上海202150)
本试验旨在探究不同生殖阶段、胎次繁殖母羊的氧化应激及氧化损伤状态。试验1选取体重、体况相近的2~3胎空怀期、妊娠期(30、60、120 d)、分娩及哺乳期(21 d)的崇明白山羊各5只;试验2选取后备、1胎、2~3胎、4~5胎、6胎及以上的崇明白山羊母羊各5只。分别采集血样,测定血清自由基代谢指标[皮质醇、过氧化氢(H2O2)含量]、抗氧化指标[总抗氧化能力(T-AOC)、谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)活性]、氧化损伤指标[丙二醛(MDA)、8-异前列腺素-F2α(8-ISO-PGF2α)、8-羟基脱氧鸟苷(8-OHDG)、蛋白质羰基化(PC)含量]。结果表明:试验1,从空怀期至哺乳期,血清皮质醇、H2O2含量呈先上升后降低的趋势,在分娩时达最高值,较空怀期显著提高(P<0.05);血清T-AOC、SOD活性逐渐增强,且哺乳期21 d较空怀期显著提高(P<0.05);血清MDA、8-ISO-PGF2α、PC含量先增加后趋于平稳,且在分娩时达最高,较空怀期显著提高(P<0.05),血清8-OHDG含量逐渐增加,哺乳期21 d达到最高,较空怀期显著提高(P<0.05)。试验2,随着母羊胎次的增加,血清中皮质醇含量无显著变化(P>0.05),4~5胎、6胎及以上血清H2O2含量显著高于其他胎次(P<0.05);血清T-AOC无显著变化(P>0.05),血清SOD及GSH-Px活性逐级递减,6胎及以上较后备母羊下降显著(P<0.05);血清MDA、8-ISO-PGF2α、8-OHDG和PC含量逐渐增加,6胎及以上显著高于其他胎次(P<0.05)。综上所述,伴随着妊娠的进行,母羊体内的自由基代谢逐渐增强,与此同时,体内的抗氧化水平也相应提高以维持氧化-抗氧化体系平衡,但在妊娠后期至哺乳期激增的活性氧自由基破坏了自由基稳衡体系,导致氧化应激和氧化损伤;随着母羊胎次的增加,抗氧化能力逐渐减弱,高胎次母羊氧化损伤严重。
繁殖母羊;妊娠;胎次;氧化应激
氧化应激是指机体在遭受体内外各种有害刺激时,氧化系统和抗氧化系统失衡,体内高活性分子如活性氧自由基(reactive oxygen species,ROS)和活性氮自由基(reactive nitrogen species,RNS)的产生量大大超过机体的清除能力,抗氧化系统不能及时清除过多的自由基。过多的自由基会攻击机体内的生物大分子物质及各种细胞器,造成机体在分子水平、细胞水平及组织器官水平的各种损伤。研究发现,妊娠过程是一个高代谢的生理阶段,在这个过程中,母体和胎儿需要更多的能量及营养物质来保证胎儿正常的生长发育。伴随着代谢的提高,机体对氧的需求量增加,从而产生过量的ROS[1],致使氧化系统和抗氧化系统失衡,发生氧化应激。医学研究证明,氧化应激与一系列妊娠并发症有关,比如子痫前期、妊娠高血压综合征、妊娠期糖尿病等[2]。
越来越多的研究表明,氧化应激不仅出现在病理妊娠中,它同样也发生在正常妊娠中。Morris等[3]和Little等[4]发现,妊娠期妇女血清中的脂质过氧化(lipid peroxidation,LPO)水平和丙二醛(maleic dialdehyde,MDA)含量要显著高于未妊娠妇女。妊娠期发生的氧化应激对母体、胎儿以及胎儿日后的成长都有显著的影响。吴永霞等[5]在研究氧化应激对奶牛的危害时提出,妊娠期间过量的ROS易攻击生物膜系统,使细胞发生脂质过氧化,从而又产生脂质自由基,产生脂质过氧化链式反应,严重损伤乳腺细胞,使细胞老化、凋亡,引发乳腺炎,而奶牛乳腺炎是奶牛饲养中花费最高的疾病之一。妊娠期的氧化应激导致了母体胎盘血管功能紊乱,低氧供给导致了胎盘滋养层非正常分化,从而引发胎盘血流减少和胎儿的组织损伤[2],这些将易造成胎儿生长阻滞[6-7],影响动物的初生重,同时对新生动物的健康以及以后的生长发育有影响。研究发现,受到氧化应激影响的仔猪,其日增重、氮表观消化率、干物质表观消化率和脂肪表观消化率等一系列生产性能指标显著下降[8],血清中免疫球蛋白A(IgA)、免疫球蛋白G(IgG)和免疫球蛋白M(IgM)含量显著降低,脾脏中淋巴细胞和巨噬细胞数量减少,仔猪免疫能力显著降低[9]。已有研究关注围产期母羊氧化应激[10],但未见对不同生殖阶段、胎次母羊氧化应激和氧化损伤的系统研究。本试验以崇明白山羊为研究对象,系统地研究了不同生殖阶段、胎次繁殖母羊自由基代谢、抗氧化能力和氧化损伤,旨在明确母羊繁殖过程中氧化应激状况,并为建立相应的营养调控技术提供理论基础,为提高母羊的繁殖性能提供参考思路。
1 材料与方法
1.1 试验动物
试验在上海市崇明区崇明白山羊保种基地进行,试验季节为春季。
试验1:选取体重、体况相近的2~3胎空怀母羊、妊娠前期(30 d)、妊娠中期(60 d)、妊娠后期(120 d)、分娩及哺乳期(21 d)的崇明白山羊各5只。
试验2:选取体重、体况相近的后备、1胎、2~3胎、4~5胎、6胎及以上空怀期崇明白山羊母羊各5只。
1.2 饲养管理
试验羊饲养在半开放式漏缝地板羊舍,空胎羊及轻胎羊(配种1~90 d)每栏10只,重胎羊(配种91~145 d)及哺乳羊每栏5只。各类母羊饲养环境一致,每天清理料槽和水槽1次,保持羊舍清洁。试验饲粮组成及营养水平见表1。重胎羊及哺乳羊由于营养需求较高,每日每只平均多补充180 g试验饲粮。采用定量饲喂的方法,每天喂2次(09:00和14:00)。饲喂时控制总量,个体采食相对自由。
1.3 样品采集和测定
早晨空腹前腔静脉采集母羊血液10 mL,于离心管内静置30 min后,3 000 r/min离心15 min,收集上清液,分装在1.5 mL EP管中,-20 ℃保存待测。
1.4 检测指标与方法
1.4.1 皮质醇
血清皮质醇含量采用酶联免疫吸附测定(ELISA)法测定,试剂盒购自南京建成生物科技有限公司,按照试剂盒说明书进行。
1.4.2 过氧化氢(H2O2)
血清中H2O2含量按南京建成生物科技有限公司测定试剂盒说明书测定。
1.4.3 抗氧化性能
血清抗氧化性指标包括总抗氧化能力(total antioxidant capacity,T-AOC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和超氧化物歧化酶(superoxide dismutase,SOD)活性。其中,T-AOC和GSH-Px活性采用比色法测定,SOD活性采用羟胺法测定,试剂盒均购自南京建成生物科技有限公司,具体步骤按照试剂盒说明书进行。
1.4.4 氧化损伤
血清氧化损伤指标包括MDA、8-异前列腺素-F2α(8-iso prostaglandin,8-ISO-PGF2α)、8-羟基脱氧鸟苷(8-hydroxydeoxyguanosine,8-OHDG)、蛋白质羰基化(protein carbonyl,PC)。其中MDA含量采用硫代巴比妥酸(TBA)法测定,8-ISO-PGF2α和8-OHDG含量采用ELISA法测定,PC含量采用紫外比色法测定,以上试剂盒均购自南京建成生物科技有限公司,具体步骤按照试剂盒说明书进行。
1.5 数据统计分析
数据处理与分析采用SPSS 17.0的单因素方差分析,并用LSD法进行多重比较,以P<0.05为显著性差异判断标准,结果以平均值±标准误表示。用OriginPro 9.2进行作图。

表1 试验饲粮组成及营养水平(风干基础)
1)妊娠期与哺乳期母羊使用不同种类预混料 Ewes were fed different premixes during pregnancy and lactation。每千克妊娠预混料含有 Contained the following per kg of the pregnant premix:VA 200 000 IU,VD330 000 IU, VE 250 IU,烟酸 niacin acid 500 mg,泛酸 pantothenic acid 150 mg,生物素 biotin 10.0 mg,Fe 1 200 mg,Cu 100 mg, Mn 1 000 mg,Zn 1 000 mg,I 17.5 mg,Se 7.5 mg,Co 7.5 mg。每千克哺乳预混料含有 Contained the following per kg of the lactating premix:VA 240 000 IU,VD375 000 IU,VE 900 mg,烟酸 niacin acid 1 000 mg,泛酸 pantothenic acid 210 mg,生物素 biotin 12.0 mg,Fe 2 400 mg,Cu 300 mg, Mn 2 000 mg,Zn 2 000 mg,I 20.0 mg,Se 5.0 mg,Co 5.0 mg。
2)计算值 Calculated values。
2 结 果
2.1 不同生殖阶段母羊氧化应激和氧化损伤
2.1.1 皮质醇
不同生殖阶段母羊血清中皮质醇含量如图1所示。从空怀期至分娩阶段,血清中皮质醇含量呈上升趋势,妊娠期120 d起提高显著(P<0.05),在分娩时达到最高点;分娩后,血清中皮质醇含量有下降趋势,但哺乳期21 d的水平与分娩时相比,无显著差异(P>0.05)。
2.1.2 H2O2
不同生殖阶段母羊血清H2O2含量如图2所示。从空怀期到分娩,血清中H2O2含量逐渐升高,其中空怀期、妊娠期30 d、妊娠期60 d的H2O2含量无显著差异(P>0.05);妊娠期120 d、分娩时比之前各阶段显著提高(P<0.05),并在分娩时达到最高;哺乳期21 d血清H2O2含量恢复至与妊娠期60 d同一水平。
2.1.3 抗氧化指标
不同生殖阶段母羊血清抗氧化指标如图3所示。总体上看,从空怀期至哺乳期21 d,血清中T-AOC、SOD和GSH-Px活性呈现上升的趋势。T-AOC在哺乳期21 d达到最高,且显著高于分娩前各阶段(P<0.05);与空怀期至妊娠期30 d相比,妊娠期120 d至哺乳期21 d,血清中SOD活性显著提高(P<0.05);对于GSH-Px活性,空怀期、妊娠期30 d、妊娠期60 d血清GSH-Px活性变化相对较小,差异不显著(P>0.05),在妊娠期120 d时有所提高,但差异不显著(P>0.05) 。

数据标注不同小写字母表示差异显著(P<0.05)。下图同。
2.1.4 氧化损伤指标
不同生殖阶段母羊的氧化损伤指标如图4所示。从空怀期至妊娠期120 d,血清MDA、8-ISO-PGF2α、8-OHDG、PC含量总体呈升高趋势;分娩时血清MDA、8-ISO-PGF2α及PC含量达到最高,且与空怀期差异显著(P<0.05),在哺乳期21 d有所下降;血清8-OHDG含量在哺乳期21 d达到最高,与分娩时无显著差异(P>0.05),这2阶段显著高于其他阶段(P<0.05)。

图2 不同生殖阶段母羊血清H2O2含量

图3 不同生殖阶段母羊血清抗氧化指标

图4 不同生殖阶段母羊血清氧化损伤指标
2.2 不同胎次母羊氧化应激和氧化损伤
2.2.1 皮质醇
不同胎次母羊血清中皮质醇含量如图5所示。6胎及以上母羊血清中皮质醇含量最高但与后备、1胎、2~3胎、4~5胎母羊相比,并无显著差异(P>0.05)。

图5 不同胎次母羊血清中皮质醇含量
2.2.2 H2O2
不同胎次母羊血清中H2O2含量如图6所示。后备、1胎、2~3胎母羊血清H2O2含量之间差异不显著(P>0.05),4~5胎、6胎及以上显著高于其他胎次(P<0.05)。
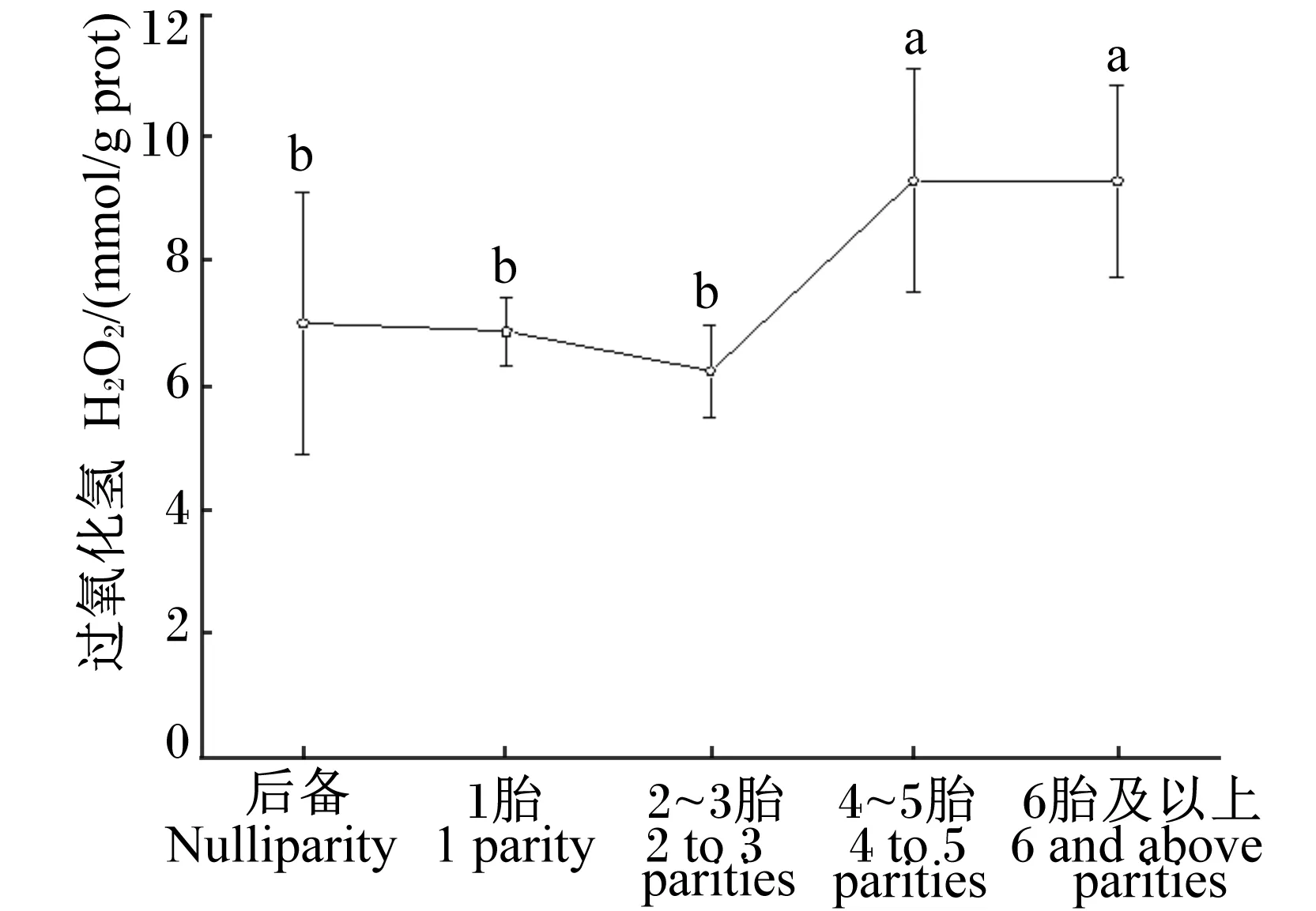
图6 不同胎次母羊血清H2O2含量
2.2.3 抗氧化指标
不同胎次母羊的抗氧化能力如图7所示。各胎次间血清T-AOC无显著差异(P>0.05);随着胎次的增加,血清SOD活性逐渐降低,与后备和1胎母羊相比,6胎及以上母羊血清SOD活性显著下降(P<0.05);6胎及以上母羊血清GSH-Px活性显著低于其他胎次母羊(P<0.05)。
2.2.4 氧化损伤指标
不同胎次母羊氧化损伤情况如图8所示。随着胎次的增加,血清MDA、8-ISO-PGF2α、8-OHDG和PC含量逐渐增加,6胎及以上达最高点,并显著高于其他各胎次母羊(P<0.05)。

图7 不同胎次母羊血清抗氧化指标
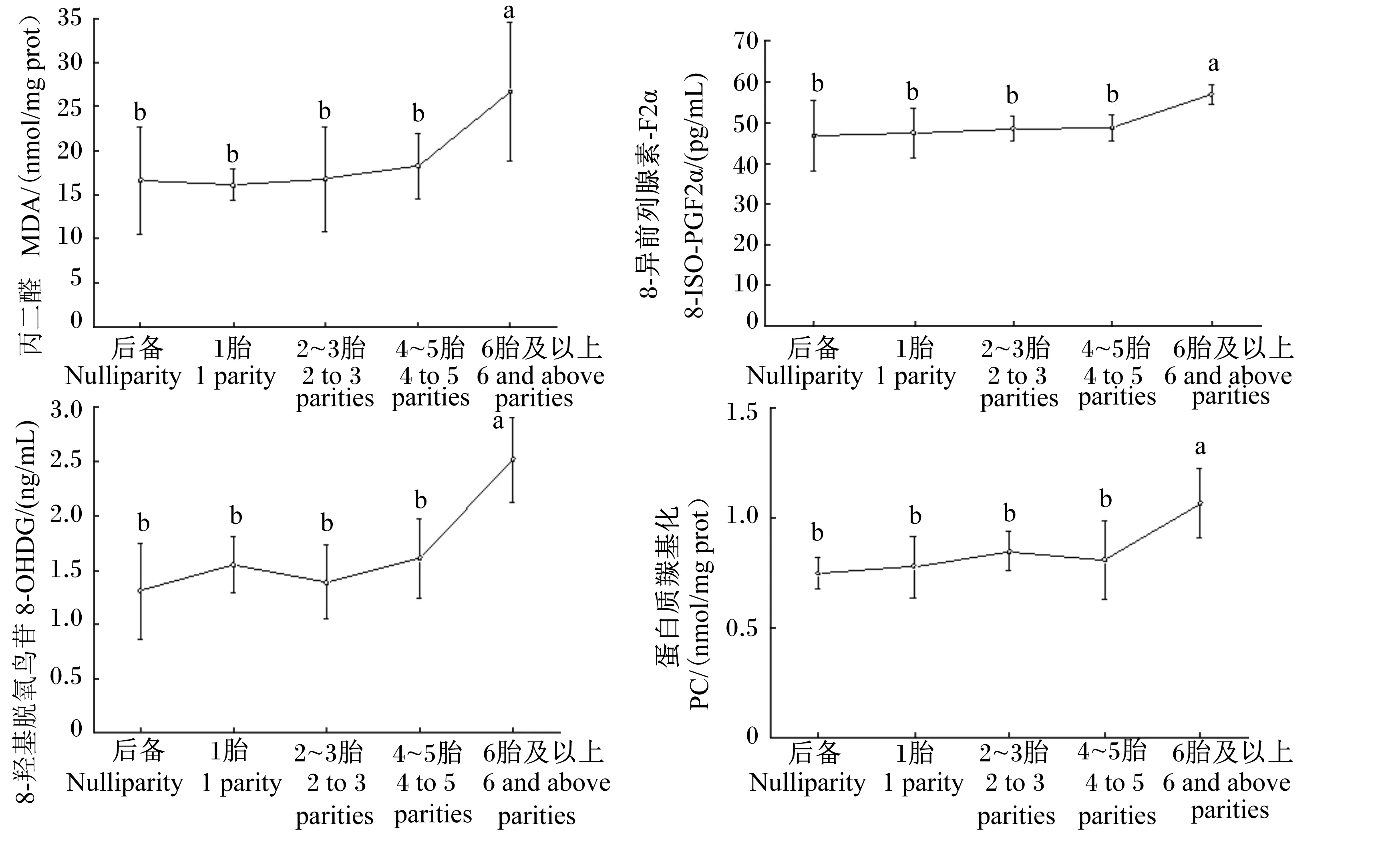
图8 不同胎次母羊血清氧化损伤指标
3 讨 论
3.1 妊娠后期至哺乳期母羊氧化应激加剧
本试验数据表明,伴随着妊娠的进行,母羊血清中皮质醇和H2O2含量逐渐增加,在妊娠期120 d较空怀期显著提高,并在分娩时达到最高,哺乳期仍维持在较高水平。与此同时,在整个妊娠过程中,机体抗氧化能力(血清T-AOC、SOD和GSH-Px活性)也出现了上升的趋势,并持续到了哺乳期21 d,但是血清MDA、8-ISO-PGF2α、8-OHDG和PC含量等氧化损伤指标并无下降趋势,它们在妊娠后期至哺乳期显著高于空怀期。因此,作者推测随着妊娠进程的发展,母羊体内的自由基代谢逐渐增加,与此同时,其体内的抗氧化能力也相应提高以维持氧化-抗氧化体系平衡,但是母羊自身的抗氧化能力并不足以缓解大量能量代谢导致的氧化应激,尤其是在妊娠后期至哺乳期,激增的ROS破坏了自由基稳衡体系,导致母羊机体出现了氧化损伤高峰,机体内细胞脂质、蛋白质及DNA氧化损伤严重,氧化-抗氧化平衡受到了严重破坏。
皮质醇含量是衡量机体应激反应的重要指标之一。本试验发现,在整个妊娠过程中,母羊血清中皮质醇含量逐渐增加,妊娠后期至哺乳期显著高于妊娠初期及妊娠中期,说明从妊娠开始,母羊机体的应激反应加强,在妊娠后期至哺乳期应激反应剧烈。而动物在遭受应激刺激时,机体代谢则出现异常,产生大量自由基。如果自身的抗氧化系统不能及时将自由基清除,将会对机体造成严重的氧化损伤。ROS包括超氧阴离子(·O2-)、羟自由基(·OH)和H2O2等。本试验数据表明,从空怀期至哺乳期21 d,母羊血清中H2O2含量逐渐升高,空怀期至妊娠期60 d,升高趋势较为平缓,妊娠期120 d起H2O2含量骤然升高直到分娩时达到最高。Celi等[10]在研究营养状况对围产期母羊氧化应激程度的影响时发现,围产期母羊ROS含量较非围产期显著提高。在妊娠后期至分娩前后机体应激反应剧增,ROS含量升高的原因可能是因为反刍动物在妊娠后期至哺乳早期这一转型时期,机体新陈代谢、内分泌及免疫情况发生剧烈的改变。研究表明,在妊娠后期,胎儿利用的总葡萄糖中55%是用于氧化反应[11]。在哺乳期,母体需要更高的能量来满足母乳的合成。平均来说,在妊娠期间,母体日能量需求比平时增加20%左右,哺乳期间增加50%[12]。而在分娩过程中,也由于体力变化较大,增加了骨骼肌组织的能量需求[13]。因此,随着妊娠期间胎儿的逐渐成长以及哺乳期间母乳的合成,更高的能量需求导致机体代谢增强,自由基产生过量,氧化反应增强,对母体氧化-抗氧化平衡造成了一定的负担。与此同时,由于在正常妊娠中绒毛膜间隙的血流是处于间歇性的。在分娩过程中,子宫的收缩加剧,导致这种间歇现象增强,产生胎盘的局部缺血再灌注损伤[14],从而产生了过量的自由基。本试验发现,随着妊娠进展,母羊体内自由基含量增多,体内抗氧化能力也出现了持续增高的趋势并维持到了哺乳期21 d。Miller等[15]研究表明,在机体在受到外界压力刺激的关键时刻,体内矿物质和微量元素含量充足的情况下,抗氧化系统也能产生某些特定的抗氧化酶对抗体内的氧化损伤。因此,可以推断,与其他动物一样,母羊在遭受氧化应激刺激时,会负反馈地调节机体刺激抗氧化酶的产生,以重新维持氧化-抗氧化的平衡,减缓氧化损伤。对于机体而言,氧化-抗氧化系统失衡的重要表现就是其受到了氧化损伤。MDA、8-ISO-PGF2α、8-OHDG和PC都是衡量氧化损伤的重要标志物。MDA是脂质过氧化物在机体内代谢的终产物,能够间接反映机体内氧自由基代谢状况、机体组织细胞受自由基供给的程度及脂质过氧化程度[16]。8-ISO-PGF2α是细胞膜上的花生四烯酸在自由基的攻击下发生脂质过氧化,经非酶途径产生的前列腺素衍生物,是脂质过氧化的敏感标志物之一。8-OHDG是ROS攻击DNA分子中的鸟嘌呤碱基第8位碳原子致DNA氧化损伤的产物。PC是由于ROS通过金属催化氧化等方式氧化蛋白质侧链的残基或者是ROS通过α过酰胺化途径和谷氨酰基残基氧化途径,诱导蛋白质肽链断裂,造成蛋白质损伤[14]。从总体上看,本试验中MDA、8-ISO-PGF2α、8-OHDG及PC含量在妊娠初期至妊娠中期虽有上升趋势但较为平缓,在妊娠后期至哺乳期显著提高。说明在妊娠期间,母羊的氧化损伤随着妊娠天数的增加呈现上升趋势,且主要在妊娠后期开始出现直至哺乳期后。Hung等[17]在对正常妊娠期妇女氧化应激情况的研究也中发现,8-ISO-PGF2α和8-OHDG这2个氧化应激标志物含量在妊娠26~30周及37~41周显著提高,在产后6~8周逐渐回落至非妊娠状态水平。
综上所述,在母羊的整个妊娠及哺乳过程中,妊娠后期至哺乳前期是需要高度重视的关键时期。因为这段时期母羊极易出现氧化应激并导致氧化损伤。这一时期由于母羊机体因胎儿生长及哺乳等原因所带来的能量需求增加以及分娩时子宫收缩引起的胎盘局部缺血再灌注损伤,导致机体自由基过量产生。为了对抗机体过量产生的自由基,妊娠母羊的抗氧化酶活性也随之增强,即使这样,母羊自身仍旧没办法维持氧化-抗氧化平衡的稳定,导致氧化损伤发生。
3.2 高胎次母羊氧化损伤较低胎次严重
医学研究发现,随着母体胎次的增加,母体患妊娠并发症的风险在提高,如高血压、糖尿病、子痫前期、贫血、宫内胎儿死亡以及胎儿早产等一系列疾病[18-19]。本试验发现,高胎次(4胎及以上)母羊血清H2O2含量显著高于低胎次(0~3胎次)母羊;随着胎次的增加,血清SOD及GSH-Px活性递减;超高胎次(6胎及以上)母羊受到的细胞脂质、蛋白质及DNA氧化损伤显著提高。由此说明,随着胎次的增加,母体抗氧化能力减弱,清除自由基的能力减弱,氧化损伤逐渐累积。Golalizadeh等[20]在研究胎次对母亲及新生儿氧化应激情况的研究中发现,高胎次母亲脐带血及母亲血浆抗氧化能力要显著低于初次生产的母亲。Ziomkiewicz等[21]对绝经后经历过不同生产次数的妇女氧化应激指标的调查中发现,高胎次妇女比低胎次妇女血液中8-OHDG含量高了将近20%。Mutlu等[12]发现,和低胎次妇女相比,高胎次妇女有着更高的氧化应激水平以及更低的抗氧化能力。
对于高胎次母体内更高的氧化应激水平,产生的原因有3点。首先可能是因为高胎次母体在分娩时需要更高的能量代谢,由此产生了过量的自由基,导致氧化-抗氧化系统失衡。有研究表明,高胎次母体分娩时需要花费甚至低胎次母体2倍的能量[12]。其次,每次分娩后所带来的氧化损伤可能有一个累积的作用,特别在当妊娠期间,如果进行过多的体力劳动,则会抢夺母体用于修复机体损伤的能量,导致氧化损伤的累积作用加强[21],同时,随着胎次升高,逐渐降低的抗氧化能力也加剧了高胎次母体的氧化损伤[20]。最后,更高的胎次往往伴随着更大的年龄,随年龄而逐渐降低的抗氧化能力也加剧了高胎次母体的氧化损伤[20,22]。
4 结 论
① 伴随着妊娠的进行,母羊体内的自由基代谢逐渐增强,与此同时,体内的抗氧化水平也相应提高以维持氧化-抗氧化体系平衡,但在妊娠后期至哺乳期激增的活性氧自由基破坏了自由基稳衡体系,导致氧化应激和氧化损伤。
② 随着母羊胎次的增加,抗氧化能力逐渐减弱,高胎次母羊氧化损伤严重。
③ 结果提示,可以通过在饲粮中添加适量的抗氧化剂,减缓妊娠后期至哺乳期母羊以及高胎次母羊的氧化损伤,保证胎儿的正常发育,提高母羊的繁殖性能。
[1] MYATT L,CUI X L.Oxidative stress in the placenta[J].Histochemistry and Cell Biology,2004,122(4):369-382.
[2] MIN J,PARK B,KIM Y J,et al.Effect of oxidative stress on birth sizes:consideration of window from Mid pregnancy to delivery[J].Placenta,2009,30(5):418-423.
[3] MORRIS J M,GOPAUL N K,ENDRESEN M J R,et al.Circulating markers of oxidative stress are raised in normal pregnancy and pre-eclampsia[J].BJOG:An International Journal of Obstetrics and Gynaecology,1998,105(11):1195-1199.
[4] LITTLE R E,GLADEN B C.Levels of lipid peroxides in uncomplicated pregnancy:a review of the literature[J].Reproductive Toxicology,1999,13(5):347-352.
[5] 吴永霞,董国忠,贾亚伟.氧化应激对奶牛的危害及其防治[J].中国饲料,2011(4):32-35.
[6] KIM Y J,HONG Y C,LEE K H,et al.Oxidative stress in pregnant women and birth weight reduction[J].Reproductive Toxicology,2005,19(4):487-492.
[7] MIN J,PARK H,PARK B,et al.Paraoxonase gene polymorphism and vitamin levels during pregnancy:relationship with maternal oxidative stress and neonatal birthweights[J].Reproductive Toxicology,2006,22(3):418-424.
[8] 黄成竹,于倩楠,陶林林,等.氧化应激对断奶仔猪的影响以及氨基酸对氧化应激调控作用的研究[J].养猪,2013(1):49-51.
[9] 李永义,段绪东,赵娇,等.茶多酚对氧化应激仔猪生长性能和免疫功能的影响[J].中国畜牧杂志,2011,47(15):53-57.
[10] CELI P,DI TRANA A,CLAPS S.Effects of plane of nutrition on oxidative stress in goats during the peripartum period[J].The Veterinary Journal,2010,184(1):95-99.
[11] BROWN L,REGNAULT T,ROZANCE P,et al.Pregnancy and feto-placental growth:macronutrients[M]//SYMONDS M E,RAMSAY M M.Maternal-fetal nutrition during pregnancy and lactation.Cambridge:Cambridge University Press,2010.
[12] MUTLU B,BAS A Y,AKSOY N,et al.The effect of maternal number of births on oxidative and antioxidative systems in cord blood[J].The Journal of Maternal-Fetal & Neonatal Medicine,2012,25(6):802-805.
[13] 李桂玲.产程中静脉补充能量的效果研究[J].中国医药科学,2011,1(10):79,93.
[14] STADTMAN E R,LEVINE R L.Free radical-mediated oxidation of free amino acids and amino acid residues in proteins[J].Amino Acids,2003,25(3/4):207-218.
[15] MILLER J K,BRZEZINSKA-SLEBODZINSKA E,MADSEN F C.Oxidative stress,antioxidants,and animal function[J].Journal of Dairy Science,1993,76(9):2812-2823.
[16] 陈小连,孙婷婷,徐建雄.微生物源性抗氧化剂对大鼠抗氧化及损伤修复的作用[J].中国饲料,2010(22):11-15.
[17] HUNG T H,LO L M,CHIU T H,et al.A longitudinal study of oxidative stress and antioxidant status in women with uncomplicated pregnancies throughout gestation[J].Reproductive Sciences,2010,17(4):401-409.
[18] 徐又先.氧化应激在妊娠方面的研究进展[J].中国优生与遗传杂志,2012,20(12):7-9.
[19] JUNTUNEN K,KIRKINEN P,KAUPPILA A.The clinical outcome in pregnancies of grand grand multiparous women[J].Acta Obstetricia et Gynecologica Scandinavica,1997,76(8):755-759.
[20] GOLALIZADEH F,SHOBEIRI F,RANJBAR A,et al.Maternal parity and blood oxidative stress in mother and neonate[J].Biotechnology and Health Sciences,2016,3(1):e34165.
[21] ZIOMKIEWICZ A,SANCILIO A,GALBARCZYK A,et al.Evidence for the cost of reproduction in humans:high lifetime reproductive effort is associated with greater oxidative stress in post-menopausal women[J].PLoS One,2016,11(1):e0145753.
[22] FINKEL T,HOLBROOK N J.Oxidants,oxidative stress and the biology of ageing[J].Nature,2000,408(6809):239-247.
(责任编辑 王智航)
*Corresponding author, professor, E-mail: jxxu1962@sjtu.edu.cn
A Research in Oxidative Stress and Damage of Breeding Goats
YU Sijia1SHI Donghui2ZHU Yong2XU Jianxiong1*XU Weina1ZHANG Jing1
(1.ShanghaiKeyLaboratoryofVeterinaryBio-Tech,SchoolofAgricultureandBiology,ShanghaiJiaoTongUniversity,Shanghai200240,China; 2.ShanghaiChongmingAnimalDiseasePreventionandControlCenter,Shanghai202150,China)
This study was conducted to investigate the oxidative stress and damage status of breeding goats at different breeding stages and different parities. In test 1,Chongmingwhite goats with similar body weight and physical condition at 2 to 3 parities at different breeding stages were used, and the stages were as follows: non-pregnant stage, pregnant stage (30, 60 and 120 d), the parturition day and lactation stage (21 d), and five from each were used; in test 2,Chongmingwhite goats at different parities were used, and the parities were nulliparity,1 parity, 2 to 3 parities, 4 to 5 parities and 6 and above parities, and five from each were used. Blood sample was collected to analysis serum free radical metabolism indexes [cortisol and hydrogen peroxide (H2O2) contents], antioxidant indexes [total antioxidant capacity (T-AOC), and the activities of glutathione peroxidase (GSH-Px) and superoxide dismutase (SOD)] and oxidative damage indexes [maleic dialdehyde (MDA), 8-iso prostaglandin (8-ISO-PGF2α), 8-hydroxydeoxyguanosine (8-OHDG), and protein carbonyl (PC) contents]. The results showed as follows: in test 1, from non-pregnant stage to lactation stage, serum contents of cortisol and H2O2were firstly increased and then decreased, and reached the highest values on the parturition day, which were significantly higher than those at non-pregnant stage (P<0.05); serum T-AOC and SOD activity were gradually increased, and lactation stage (21 d) was significantly higher than non-pregnant stage (P<0.05); serum contents of MDA, 8-ISO-PGF2α and PC were firstly increased and then tended to be stable, and reached the highest values on the parturition day, which were significantly higher than those at non-pregnant stage (P<0.05); serum 8-OHDG content was gradually increased, and reached the highest value at lactation stage (21 d), which was significantly higher than that at non-pregnant stage (P<0.05). In test 2, with the increase of parities, there was no significant changes of serum cortisol content (P>0.05), and serum H2O2content at 4 to 5 parities and 6 and above parities was significantly higher than that at the other parities (P<0.05); there was no significant change of serum T-AOC (P<0.05), but serum activities of SOD and GSH-Px were gradually decreased, and 6 and above parities were significantly decreased compared with nulliparity (P<0.05); serum contents of MDA, 8-ISO-PGF2α, 8-OHDG and PC were gradually increased, and 6 and above parities were significantly higher than parities (P<0.05). In conclusion, with the development of pregnancy, free radical metabolism of goats is gradually enhanced, meanwhile, antioxidant capacity is also improved to keep the oxidant-antioxidant system balance; but due to the proliferation of reactive oxygen species from late-pregnant stage to lactation stage, the balance is broken, and strong oxidative damage is caused. with the increase of parities, the antioxidant capacity of goats get weak, high parities goats suffer strong oxidative damage.[ChineseJournalofAnimalNutrition, 2017, 29(3):814-823]
breeding goat; pregnancy; parity; oxidative stress
10.3969/j.issn.1006-267x.2017.03.011
2016-09-02
公益性行业(农业)科研专项(201303143-06-01)
余思佳(1992—),女,福建龙岩人,硕士研究生,研究方向为动物营养与饲料科学。E-mail: scarlettyu@yeah.net
*通信作者:徐建雄,教授,博士生导师,E-mail: jxxu1962@sjtu.edu.cn
S826
A
1006-267X(2017)03-0814-10
