奎河两岸污灌区浅层地下水氮污染特征及同位素示踪分析
2017-04-11王锦国王碧莹
王锦国,李 群,王碧莹,章 颖
(河海大学 地球科学与工程学院,南京 211000)
奎河两岸污灌区浅层地下水氮污染特征及同位素示踪分析
王锦国,李 群,王碧莹,章 颖
(河海大学 地球科学与工程学院,南京 211000)
地下水中氮污染主要包括铵态氮和硝态氮,特别是当铵(NH4+)作为地下水的主要污染物时,由于其在含水层中迁移规律复杂,且难以去除,成为研究该问题的难点。在奎河徐州段两岸通过钻孔对浅层地下水进行取样测试分析,研究区浅层地下水中氮的存在形式主要为NH4+,其次为NO3-。通过对δ15N-NH4+同位素分析可知,地下水中约27.3%的NH4+来源于化肥,约72.7%NH4+来自于动物粪便、生活污水等高δ15N值的污染源;对δ15N-NO3-同位素分析可知,地下水中约有15.2%的NO3-来源于化肥和土壤有机氮,63.6%的NO3-来源于动物粪便和污水;约21.2%的地下水样本中δ15N-NO3-值超出了污染源的同位素值,可能产生了反硝化作用。
奎河两岸污灌区; 地下水; 硝态氮; 铵态氮; 同位素; 反硝化
1 研究背景
氮以多种形态存在于环境中,在地下水中以NO3-离子较为丰富。天然条件下,地下水中氮含量相对较低,NH4+含量更低。在污灌区,由于常常采用污水灌溉、施用粪肥和化肥以及生活污水排放等,使得地下水中NO3-,NO2-以及NH4+含量大幅度上升。高浓度的硝酸盐、氨氮在地下水中会引起水质下降、适用性降低,导致水质变坏;特别是饮用了亚硝酸盐含量超标的水,可对人体产生较大的危害。因此,只有合理地识别地下水氮污染的来源,才能针对性地进行预防和控制。
污灌区地下水中氮的来源包括:化肥使用、生活污水、人畜粪肥、土壤有机氮等。随着降雨、灌溉入渗,氨氮和硝酸盐氮可以从土壤中进入地下水[1-4]。如何确定各种来源对地下水中氮污染的贡献程度非常困难,近来很多研究采用氮同位素来确定地下水中氮的来源,特别是硝酸盐的来源[5-8]。硝酸盐不同来源有不同的同位素特征,通过分析地下水中同位素的组成可以追溯污染物的来源[9]。随着氨氮引起的地下水污染的不断加剧,近年来对氨氮污染来源也开始了相应的同位素研究[10]。
本文研究区位于江苏省徐州市的奎河两岸(图1),为当地的主要农业区,种植方式多样,主要有水稻、小麦、大棚蔬菜、金针菇、果树林等。

图1 研究区位置示意图Fig.1 Map of the study area
该地区地下水中的氮主要来自粪肥、化肥、污水灌溉等。奎河河水接受了来自上游徐州市的排污,因此污染较为严重。近年来已开始增设污水处理厂,但河水氮污染指标超标仍很严重,如图2所示。两岸农田长期采用奎河水进行灌溉,与施肥叠加,对当地浅层地下水造成了严重污染。近年来已有很多学者关注该地区浅层地下水氮污染问题[11-12]。本文首先对浅层地下水中硝酸盐和氨氮进行了调查,并进行了氮同位素分析,判断了该地区浅层地下水中氮污染各种来源所占的比例,并对可能产生的反硝化反应进行了分析。

图2 奎河黄桥闸下水质监测成果Fig.2 Monitoring results of water quality at Huangqiao floodgate, Kuihe River
2 研究区概况
研究区选择在江苏省徐州市铜山县三堡镇奎河段,处于117°12′E,34°04′N—34°08′N,如图1所示。研究区地势开阔平坦,海拔标高30 m左右。地表主要是第四系全新统亚砂土、亚黏土及粉砂。为了灌溉需要,在奎河黄桥附近设置了1个水闸。本次研究选择黄桥闸上游的河段,布置了3个断面,如图1所示。通过钻孔揭示的每个剖面的地层分布具体如下。
(1) 黄桥闸断面。埋深0~2.0 m为杂填土及粉质黏土;2.0~8.0 m为粉质砂壤土;8.0 m之下为黏土。地下水位一般在杂填土底板以下。该断面处地下水直接接受降雨入渗补给,与河水联系密切。地下水位埋深为2.0~4.0 m,年变幅约为2.0 m左右。由于受黄桥闸上游蓄水或放水的影响,河岸两侧150 m范围内地下水位受地表水影响较大。黄桥闸断面在奎河以西为小麦地,以东为树林苗圃和小麦地或小麦水稻轮作田。
(2) 石桥断面。地表为杂填土,厚度0.2 m左右;埋深0.2~4.0 m为黏土;埋深4.0~7.0 m为粉质砂壤土;埋深7.0 m以下为粉质黏土。含水层主要为粉质砂壤土层,具有承压性,地下水位年变幅为1.2 m。石桥断面奎河东西两侧多为蔬菜大棚。
(3) 徐村断面。埋深0~0.4 m为杂填土;0.4~4.0 m为粉质砂壤土;埋深4.0 m以下主要为黏土。地下水埋深一般为2.0~4.0 m。奎河东西两侧多为金针菇大棚,灌溉相对较少,地下水位变幅不大。
3 采样和分析
3.1 采 样
在原位进行钻孔,钻孔开孔直径为190 mm,放置直径为110 mm的PVC套管,钻孔深为10.0 m,PVC套管进水滤管(花管)设置在浅层含水层中部,埋深在2.0~6.0 m的位置;PVC死管管外填充黏土,花管外填充细砾料作为滤层。取样前先将孔内的水抽干,待水位恢复后,进行取样。采样瓶采用聚乙烯塑料瓶,每次采样之前用待测水样洗瓶3次,测试NH4+,NO3-等离子的每个水样采集1 000 mL。
采集河水和地下水样约1 000 mL用于δ15N的测试。水样用0.45 μm的滤纸进行过滤,用HCl酸化后密封,防止产生微生物。水样于24 h内送至检测机构进行前处理和同位素测试。
研究区一般在6—10月份种植水稻,10月份—次年6月份种植小麦,为此选择种植水稻前和种植小麦前分别采样进行分析;10月份—次年6月份采样1次(采样时间选择在2月份)。
3.2 化学和同位素分析
在取样后立即送至现场实验室并于当天进行测试NH4+,NO3-,测试仪器采用美国哈希公司的DR2800型可见光分光光度仪。NH4+-N测试采用USEPA的纳氏试剂法,该方法精度为1.0%,仪器的检测下限为0.02 mg/L;NO3--N测试采用镉还原法,该方法的精度为4.0%,仪器的检测下限为0.04 mg/L。测试具体操作根据《水质分析手册(第五版)》(2009)[13]。
水中NO3-的δ15N采用反硝化细菌法测试[9]。菌种采用致金色假单胞菌,6~20 μg的NO3-定量加到2 mL浓缩菌液中,产生的N2O由带有预浓缩装置的MAT253质谱仪测试其中的δ15N值。每批样品带2个国际同位素标准IAEA-N3和USGS34,用于实际样品的氮同位素校正,测试精度优于0.5‰。
水中NH4+的δ15N采用叠氮法[9]测试。样品中NH4+经次溴酸氧化,转化为NO2-,再经叠氮化物还原为N2O,然后与反硝化细菌法相同的方法测试N2O中的δ15N值。每批样品带3个同位素标准IAEA-N1,USGS25和USGS26对实际样品进行校正,测试精度优于0.5‰。上述测试工作均由中国科学院南京土壤研究所在MAT253同位素质谱仪上完成。
4 结果与讨论
4.1 地下水氮分布特征
在2010年10月份、2011年2月份和2011年6月份进行了3次采样。为了与地表水进行对比,还在3个断面采集了奎河水进行水质分析。分析结果列于表1中,对比可以看出,2月份地下水中氨氮含量较低,10月份含量较高。这与当地的种植结构和灌溉有关:一般每年6—10月份种植水稻和蔬菜,灌溉、施肥量都很大,因此到10月份地下水中氮的含量都会较高;10月份开始种植小麦和少部分大棚冬菜,灌溉和施肥相对较少,因此2月份时地下水中氮含量相对较低。灌溉一般采用奎河水,其氮的含量均高于地下水中氮的含量。
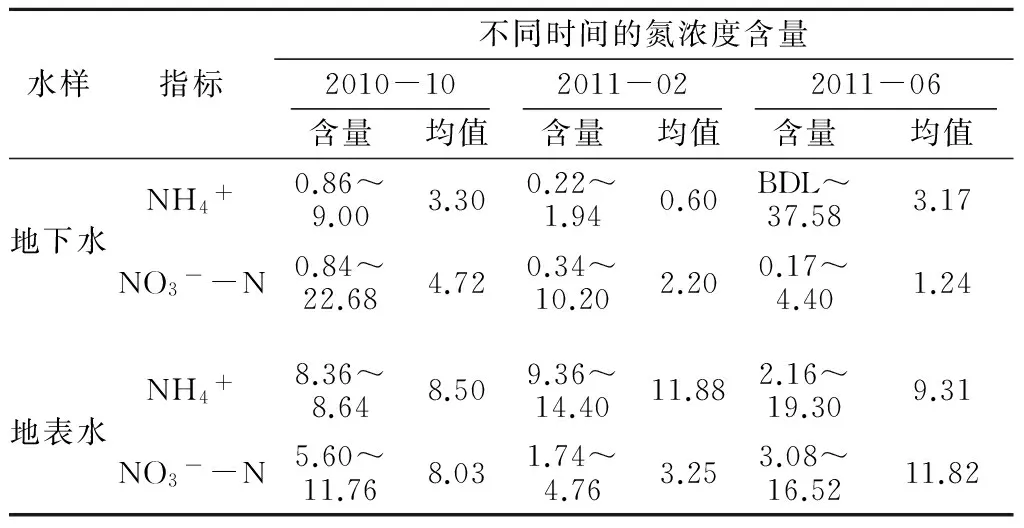
表1 研究区地表水和地下水中氮含量特征Table 1 Contents of nitrogen in surface water and groundwater in the study area mg/L
注:BDL表示低于检出限。
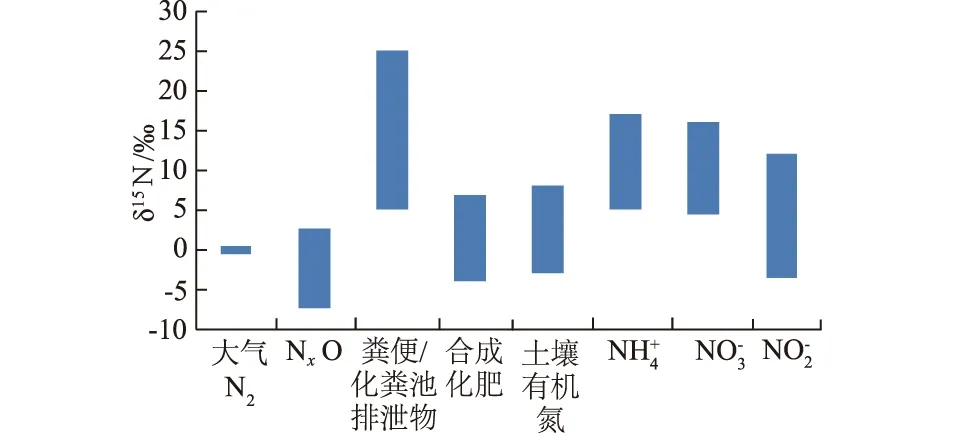
在规范《地下水质量标准》(GB/T14848—93)[14]中,根据NH4+含量将地下水分为5级:Ⅰ级和Ⅱ级,NH4+含量≤0.02 mg/L;Ⅲ级,NH4+含量≤0.2 mg/L;Ⅳ级,NH4+含量≤0.5 mg/L;Ⅴ级,NH4+含量>0.5 mg/L。采集分析的地下水51个(次)样本中,有30个水样的NH4+含量>0.5 mg/L,为Ⅴ级,占总样本的58.8%,其中2010年10月份水样全部为Ⅴ级;有18个水样NH4+含量0.2~0.5 mg/L,为Ⅳ级,占总样本的35.3%。根据NO3--N分级时,NO3--N含量>20 mg/L(IV级)的地下水样仅有1个,Ⅲ级(5 mg/L 图3 NH4+与NO3--N 分级示意图Fig.3 Classification according to concentrations of NH4+ and NO3--N 从图3可以看出,在采样期间奎河水中NH4+含量较高,均为V类。10月份所有地下水样中NH4+含量都很高,指标均为V类;夏季水稻和蔬菜灌溉量大,10月份水稻收割后地下水中的NH4+含量达到了最大。10月份后蔬菜种植量相对较少,同时部分土地开始种植小麦,灌溉量减少,且小麦施肥主要为硝态氮,因此到次年2月份地下水中的NH4+含量较低。春季开始后,小麦灌溉量增大,蔬菜种植量开始增多,灌溉量也相对增大,因此在6月份地下水中NH4+含量相对2月份有所增大。 4.2 NH4+来源及其δ15N分析 由于土壤对NH4+具有很强的吸附性,在土壤呈碱性环境的情况下,氨的挥发也很强烈;在浅层透气性好的条件下还易发生硝化作用,因此天然条件下进入地下水中NH4+含量很低。然而由于大量的污水灌溉、禽畜养殖排污、垃圾淋滤液下渗等,使得大量NH4+进入地下水中,部分地区NH4+含量还很高。受NH4+污染后的地下水需要经历NH4+→NO3-→N2过程后才能真正把NH4+从污染含水层中去除,相对时间较长,也很困难。因此地下水中NH4+的运移和转化研究已成为诸多学者的研究课题。美国地质调查局(USGS)科学家通过几十年的观测和试验表明,NH4+相对于NO3-在地下水中的运移速率很慢,并且现有资料几乎未涉及到铵的运移转化规律,一旦地下水受到铵的污染很难用现有的知识和方法加以去除。 根据以往研究成果可知,世界不同地区雨水中δ15N-NH4+平均值为(-12.2~-0.5)‰;中国生产的铵态氮肥δ15N平均值为(-1.48~0.91)‰,其中尿素平均值为(-1.12±1.44)‰、硝酸铵平均值为(-0.98±1.42)‰、碳酸氢铵平均值为(0.91±1.05)‰、硫酸铵平均值为(-1.48±1.38)‰、氯化铵平均值为(-1.35±2.28)‰;猪粪和禽粪中δ15N值分别为7.47‰和14.87‰,人粪δ15N值可高达49.71‰[15]。 对地表水和地下水水样中的δ15N-NH4+进行分析,结果如表2。研究区农作物除了施用硝酸铵和尿素外,主要有农家肥、粪肥等,此外采用奎河水进行污水灌溉也是土壤肥料的来源之一。 将本次测试的δ15N-NH4+与NH4+含量关系绘制于图4,从图中可以看出,奎河水中NH4+同位素δ15N值为6.31‰~21.54‰,几乎都来自生活污水和动物排泄物的污染。所有地下水的33个有同位素测值的水样中,NH4+同位素值δ15N≤5.0‰的有9个水样,占27.3%;5.0‰<δ15N≤15.0‰的有15个水样,占45.4%;δ15N>15.0‰的有9个水样,占27.3%。也就是说,地下水中NH4+的来源约27.3%为化肥,72.7%来自于动物粪便、生活污水等高δ15N值的污染源。地下水取样期间同时进行的pH值测试结果显示,取样点地下水pH值为6.3~7.5,为弱酸性-中性,同时研究区含水层透气性差,且有大量的NH4+补给,因此比较难以发生硝化作用。 表2 研究区地表水和地下水中氮同位素含量Table 2 Nitrogen isotopes in surface water and groundwater in the study area ‰ 图4 δ15N-NH4+与NH4+含量关系Fig.4 Relationship between δ15N-NH4+and NH4+ contents 地下水中的NH4+从地表经非饱和带进入地下水,中间经过了土壤的吸附、挥发、硝化作用等过程,但由于研究区常年的灌溉和施肥,有充足的补给来源,非饱和带土壤甚至达到饱和状态,因此可以直接进入地下水中,造成了地下水的NH4+污染。当地一年四季都有作物种植(水稻、小麦、蔬菜等),常年灌溉和施肥,仅在冬季施肥量和灌溉的次数相对较少。因此NH4+含量在2011年2月份大部分测值<1.0 mg/L,而2010年10月份和2011年6月份的大部分测值>1.0 mg/L(图4)。 4.3 δ15N-NO3-分析 在研究区的地下水中,与NH4+相比,NO3-污染程度相对较轻,但也有部分超过了III类地下水。不同来源的硝酸盐可以通过δ15N来判别,大量研究表明,不同N源的δ15N存在差异,且有一定的规律性(图5)[16]。一般来自于化学肥料的δ15N值在-7.4‰~6.8‰,土壤中有机氮的δ15N值在-3.0‰~8.0‰,来自于粪肥等肥料的δ15N值在5.0‰~25.0‰,来自于污水的δ15N值为4.0‰~19.0‰[8,17]。由于地域的不同,硝酸盐δ15N范围值也略有不同,但相差不大。 图5 不同来源NO3-的N同位素值Fig.5 Nitrogen isotopes in different NO3- sources 研究区地表水和地下水样中δ15N-NO3-值见表2。地下水样本中测得δ15N值的水样总量有33个,其中δ15N值≤5.0‰的水样有5个,占15.2%;5.0‰<δ15N值≤25‰的水样有21个,占63.6%;δ15N值>25.0‰的水样有7个,占21.2%。初步可以判断地下水中约有15.2%的NO3-来自化肥和土壤有机氮,约63.6%可能来自动物粪便和污水,其他样本中δ15N值很高,有可能发生过反硝化反应,产生了同位素分馏作用。地表河水中δ15N值为8.16‰~24.24‰,表明河水的硝酸盐污染基本来自动物粪便和污水排泄。 图6 水样中δ15N-NO3-与NO3-含量关系Fig.6 Relationship between δ15N-NO3- and NO3- contents in water samples 图6为水样中δ15N-NO3-与NO3-含量关系,对6月份和10月份的数据进行线性拟合可以看出,总体上表现出随着NO3-含量的增加,其δ15N值也增加,这是粪肥污染的典型特征。δ15N>25‰的水样中NO3-含量都<10 mg/L,这部分水样中可能存在反硝化作用。在反硝化作用过程中,NO3-被还原为NOx或N2,产生了显著的同位素分馏[18],水样中残留的NO3-富集δ15N,而NO3-含量却相对较低。 从图6可以看出,高δ15N值的样本点主要出现在2011年2月份采集的水样中,也就是说2月份(冬季)地下水中硝酸根的δ15N值比其他季节(夏季、秋季)的要高。李思亮等[19](2005)在遵义地下水硝酸盐污染来源分析中也有类似的发现。研究区大量的施肥和灌溉发生在春、夏季,污水和粪肥来源的硝酸盐入渗至地下水中后,经过反硝化作用,在冬季施肥和灌溉较少的时候,表现出了高δ15N值、低NO3-含量的特点。据Wang[20](1997)的研究,当潜水面埋藏较浅,土壤潮湿,透气性差或非饱和带颗粒粗细相间,土壤水含氧量较小时,最有利于反硝化作用的进行,此时地下水中硝态氮将被逐步还原。研究区表层主要为黏土、粉质壤土,地下水埋深较浅(一般为2.0~4.0 m),土壤含水量大,有利于反硝化作用的进行。 通过对奎河徐州段两岸浅层地下水污染进行调查,并取样进行水质分析后可知: (1) 研究区浅层地下水的氮污染物主要为NH4+,其次为NO3-。 (2) 每年10月份地下水中硝酸盐和铵含量较高,到2月份含量降低,主要是由于不同月份的灌溉和施肥量不同。 (3) 由δ15N-NH4+同位素值分析可知,浅层地下水中NH4+的来源约27.3%为化肥,72.7%来源于动物粪便、生活污水等污染源。δ15N-NO3-同位素分析可知,研究区浅层地下水中约有15.2%的NO3-潜在污染源来自化肥和土壤有机氮,约63.6%潜在污染源来自动物粪便和污水,约21.2%水样δ15N-NO3-甚至超出了污染源的同位素值,分析认为在这些水样点的地下水可能产生了反硝化作用,致使水样同位素分馏后残留的NO3-富集δ15N。 (4) 需要指出的是,本文仅利用δ15N和NO3-含量识别水土环境中NO3-的来源和转化,结果可能会造成不同NO3-来源的δ15N值存在一定范围的重叠,对可能产生的硝化作用和反硝化作用还有待进一步论证。 [1] JIAO J J, WANG Y, CHERRY J A,etal. Abnormally High Ammonium of Natural Origin in a Coastal Aquifer-aquitard System in the Pearl River Delta, China[J]. Environmental Science and Technology, 2010, 44(19): 7470-7475. [2] NOLAN B T. Nitrate Behavior in Ground Water of Southeastern USA[J]. Journal of Environmental Quality, 1999, 28(5): 1518-1527. [3] CHOI W J, HAN G H, LEE S M,etal. Impact of Land-use Types on Nitrate Concentration and δ15N in Unconfined Groundwater in Rural Areas of Korea[J]. Agriculture Ecosystems & Environment,2007, 120(2/4): 259-268. [4] 陈建平, 丁际豫, 吴子杰. 氮肥对地下水中氮迁转机理研究[J]. 长江科学院院报, 2015, 32(2): 24-29. [5] KOMOR S C, ANDERSON W H. Nitrogen Isotopes as Indicators of Nitrate Sources in Minnesota Sand-plain Aquifers[J]. Ground Water,1993, 31(2): 269-270. [6] DEUTSCH B, LISKOW I, KAHLE P ,etal. Variations in the δ15N and δ18O Values of Nitrate in Drainage Water of Two Fertilized Fields in Mecklenburg-Vorpommern (Germany)[J]. Aquatic Sciences,2005, 67(2): 156-165. [7] SEILER R L. Combined Use of δ15N and δ18O of Nitrate and 11B to Evaluate Nitrate Contamination in Groundwater[J]. Applied Geochemistry,2005, 20(9): 1626-2163. [8] HOSONO T, WANG C H, YU U,etal. Multiple Isotope (H, O, N, S and Sr) Approach Elucidates Complex Pollution Causes in the Shallow Groundwaters of the Taipei Urban Area[J]. Journal of Hydrology,2011, 397(1): 23-36. [9] 张翠云, 张 胜, 马琳娜, 等. 污灌区地下水硝酸盐污染来源的氮同位素示踪[J]. 地球科学,2012, 37(2): 350-356. [10]XING G X, CAO Y C, SHI S L,etal. N Pollution Sources and Denitrification in Waterbodies in Taihu Lake Region[J]. Science in China(Series B), 2001, 44(3): 304-314. [11]王 超, 李 勇, 包振琪. 污染河道对沿岸地下水环境影响规律研究[J]. 水科学进展,2002,13(3): 535-541. [12]梁 斌,王 超,王沛芳,等.河流污水非饱和入渗对沿岸地下水质的影响[J]. 水科学进展,2003,14(3): 548-553. [13]美国哈希公司. 水质分析手册(第五版)[K] . 北京:化学工业出版社, 2009. [14]GB/T14848—93,地下水质量标准[S].北京:中国标准出版社,1993. [15]肖化云, 刘丛强, 李思亮. 贵阳地区夏季雨水硫和氮同位素地球化学特征[J]. 地球化学,2003, 32(3): 248-254. [16]袁利娟,庞忠和. 地下水硝酸盐污染的同位素研究进展[J]. 水文地质工程地质,2010, 37(2): 108-113. [17]ZHANG Y, LIU X J, FANGMEIER A,etal. Nitrogen Inputs and Isotopes in Precipitation in the North China Plain[J]. Atmospheric Environment,2008, 42(7): 1436-1448. [18]KENDALL C, MCDONNELL J J.Isotope Tracers in Catchment Hydrology[M]. Amsterdam: Elsevier Science, 1998:519-576. [19]李思亮, 刘丛强, 肖化云, 等. δ15N在贵阳地下水氮污染来源和转化过程中的辨识应用[J].地球化学, 2005, 34(3): 257-262. [20]WANG D S. Basis for the Use of Nitrogen Isotopes to Identify Nitrogen Contamination of Groundwater[J]. Acta Geoscientia Sinica,1997, 18(2): 220-223. (编辑:占学军) Characteristics of Nitrogen Pollution and Isotopic Tracer Analysis ofShallow Groundwater in the Sewage Irrigation Area of Kuihe River WANG Jin-guo, LI Qun, WANG Bi-ying, ZHANG Ying (School of Earth Science and Engineering, Hohai University, Nanjing 211000, China) Nitrogen pollution in groundwater is mainly caused by the intrusion of ammonium nitrogen and nitrate nitrogen. Especially when ammonium (NH4+) is the major pollutant in groundwater, studying its distribution characteristics will be difficult as its migration law in aquifers is complicated and the pollutant is hard to be removed. Through boring holes at both banks of Kuihe River in Xuzhou city, we collected water samples to analyze nitrogen pollution. Test results showed that the main existence form of nitrogen in the study area was NH4+, followed by NO3-. Isotopic analysis of δ15N-NH4+showed that 27.3% of NH4+in the groundwater was from chemical fertilizer and the rest was from the sources with high δ15N, such as animal manure and domestic sewage, etc. On the other hand, isotopic analysis of δ15N-NO3-showed that 15.2% of NO3-was from chemical fertilizer and soil organic nitrogen and 63.6% of that was from animal manure and sewage. Test and analysis of groundwater also showed that about 21.2% of samples were with higher isotope values than the pollution source, reflecting the denitrification in shallow groundwater at the study area. sewage irrigation area of Kuihe River; groundwater; nitrate nitrogen; ammonium nitrogen; isotope; denitrification 2016-02-17; 2016-10-02 水利部公益性行业科研专项经费项目(200901064);江苏省“六大人才高峰”高层次人才项目(2014-JY-001) 王锦国(1974-),男,山西阳泉人,教授,博士,主要从事水文地质研究,(电话)025-83787140(电子信箱)wang_jinguo@hhu.edu.cn。 10.11988/ckyyb.20160120 2017,34(4):15-19,32 X522 A 1001-5485(2017)04-0015-05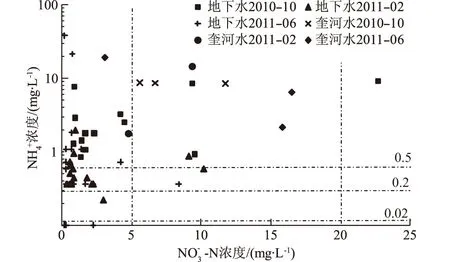



5 结 论
