脊柱关节病致敏蛋白HLA-B27的非经典同源二聚体的表达与纯化
2017-04-11涂文亚
涂文亚,曾 驰
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
脊柱关节病致敏蛋白HLA-B27的非经典同源二聚体的表达与纯化
涂文亚,曾 驰
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
强直性脊柱炎(ankylosing spondylitis)与人体白细胞抗原HLA-B27编码基因高度相关。强直性脊柱炎的发病机制至今尚不明确。HLA-B27重链同源二聚导致强直性脊柱炎的假说近年来受到关注。但是一直缺乏结构的数据去分析证实这种假说。解析HLA-B27同源二聚体的结构有望从结构角度阐明强直性脊柱炎的分子机理,并为后续的药物设计和过敏预防提供理论基础。本研究在E.coli中表达出包涵体形式的HLA-B27蛋白,将包涵体溶解、复性和纯化。最终从20 mg HLA-B27包涵体中得到0.2 mg纯度高且性状均一的HLA-B27同源二聚体,为获得高质量HLA-B27同源二聚体蛋白晶体及结构数据奠定了重要基础。
强直性关节炎;HLA-B27;同源二聚体;纯化
1 引言
强直性脊柱炎(ankylosing spondylitis, AS)是脊柱关节病(spondyloarthritides, SpA)的一种,属于风湿性疾病。强直性脊柱炎与HLA-b27基因高度相关,94%的强直性脊椎炎患者其HLA-B27抗原表达为阳性[1]。强直性脊柱炎的发病机制至今尚不明确,有效的治疗方案也比较匮乏。关于HLA-B27致强直性脊柱炎机制,主要有2种假说[2]。
第一种假说是风湿性病原多肽提呈理论。HLA(人体白细胞抗原)在体内承担1种经典角色,即与β2m(β2-微球蛋白)、病原多肽形成异源三聚复合物,提呈多肽被TCR(T细胞受体)识别,激活T细胞,引发下游炎症反应[3]。HLA-B27可能也是通过类似方式,将人体的某些与抗原肽高度相似的内源肽提呈给TCR,导致炎症反应,并且这种反应是持续的[4]。第二种假说是HLA-B27重链(heavy chain)的非经典的错误折叠理论。HLA-B27的重链会在内质网的装配过程中错误折叠导致内质网压力反应和自噬反应[5]。Allen等人首先在体外发现了HLA-B27的重链在缺乏β2m的情况下,67位的Cys之间产生二硫键,形成同源二聚体(B272),并且在培养的转染细胞表面也检测到了这种二聚体的存在[6]。因此引发猜想,人体内的细胞表面有这种非常规的二聚体存在时就会致病,而且这种二聚体仅形成于特定HLA-b27基因型中[7]。这也正好呼应了强直性脊柱炎与HLA-b27基因高度相关而与其他基因型关联度低的问题。
HLA-B27重链同源二聚导致强直性脊柱炎的假说是近年来的研究热点。但是一直缺乏结构的数据去分析证实这种假说。解析HLA-B27同源二聚体的结构有望从结构角度阐明强直性脊柱炎的分子机理,并为后续的药物设计和过敏预防提供理论基础。
本研究通过原核表达、体外复性、纯化得到纯度高且性状均一的HLA-B27同源二聚体蛋白,为获得高质量HLA-B27同源二聚体蛋白晶体及结构数据奠定了重要基础。
2 材料与方法
2.1 仪器设备及材料
UH06高压破碎仪(上海永联生物);ZQZY-CT振荡培养箱(上海知楚仪器);4 ℃冷柜(中科美菱);pH计(赛多利斯,北京);ST40R离心机(美国Thermo);超滤管Centrifugal Filter Units(美国Millipore);Biologic Duo Flow FPLC(美国Bio-rad);HP Q预装柱(美国GE);Superdex 200 10/300 GL分子筛预装柱(美国GE)。
2.2 方法
2.2.1 HLA-B27的原核表达
将HLA-B*2705(HLA-B*2705是最普遍的HLA-B27亚型)的胞外序列(24-299aa,全文特指HLA-B27)插入表达载体pET-28a质粒构建HLA-B27表达载体。将构建的HLA-B27表达载体转入E.coli菌株Rosetta(DE3)。将转化子菌株接入1.5L LB培养基中,摇菌(37 ℃ 200 r/min)。待菌液OD600nm达到0.6—0.8时,加入终浓度1 mM的IPTG诱导表达,继续摇菌(37 ℃,200 r/min)4 h;冷冻离心(4 500 g,10 min,4 ℃)收菌。
2.2.2 包涵体提取
向收集的菌中加入50 mL重悬液(50 mM Tris-HCL,25% 蔗糖,1mM EDTA,1mM PMSF,10 mM DTT,pH 8.0)重悬,加入100 mL裂解液(50mM Tris-HCl,1% Triton X-100,1% 脱氧胆酸钠,100 mM NaCl,10 mM DTT,pH 8.0)。菌悬液搅拌均匀后倒入高压破碎仪破碎(700 bar,10 min)。将裂解物离心(10 000 g,15 min)。弃上清液,向沉淀中加入150 mL清洗液I(50 mM Tris-HCl,0.5% Triton X-100,100 mM NaCl,1 mM EDTA,1 mM DTT,1 mM PMSF,pH 8.0),在磁力搅拌器上快速搅拌1 h,然后离心(10 000 g,15 min,4 ℃)。重复此步骤3次。弃上清液,向沉淀中加入100 mL清洗液II(50mM Tris-HCl,1 mM EDTA,1mM DTT,1mM PMSF,pH 8.0),在磁力搅拌器上快速搅拌1h,然后离心(10 000 g,15 min)。弃上清液,向沉淀中加入10 mL变性剂溶解液(20 mM Tris-HCL,8 M尿素,0.5 mM EDTA,1 mM DTT,1mM PMSF,pH 6.0,现配现用),在研磨器中研磨加速溶解。将溶解后的包涵体溶液离心(18 000 g,2 h)。收集上清液,SDS-PAGE检测,-80 ℃冻存。以上提取步骤均在4 ℃进行。
2.2.3 复性
复性条件高通量筛选:按照文献[8]配制96种复性溶液(如表1、表2所示)。在96孔板中每孔加入99 μL复性溶液和1μL包涵体蛋白(上步提取的HLA-B27包涵体),置于震动摇床上震动,4 ℃复性36 h,Native-PAGE检测。扩大复性:根据筛选出来的条件配100 mL复性溶液,在转子的快速搅拌下用注射器缓慢注入包涵体,1 mL包涵体溶液分3次注入,每隔12 h加一次,每次加入包涵体后再将转子调至低速,复性36 h。
表1 前80种复性液(A-H,1-10)的成分组成

缓冲液(50mM)离子强度两亲试剂去垢剂(100mM)还原剂(10mM)添加剂NaAc,pH4MES,pH5MES,pH6TRIS,pH7TRIS,pH8CHES,pH9NaCl100mMNaCl200mMKCl200mM甘油20%(V/V)PEG40000.05%(W/V)PEG4000.05%(W/V)NDSB195NDSB201NDSB256β⁃MSH精氨酸800mM葡萄糖500mM混合物aEDTA1mM
注:以上浓度指加入蛋白之前的溶液浓度;“混合物a”包含以下成分(每种成分的浓度均为50 μM):NADH, 盐酸硫胺素, 生物素, CaCl2, MgCl2, CuSO4, ZnCl2, CoSO4, ADP, NiCl2。
表2 96孔复性板中每孔复性液的具体成分
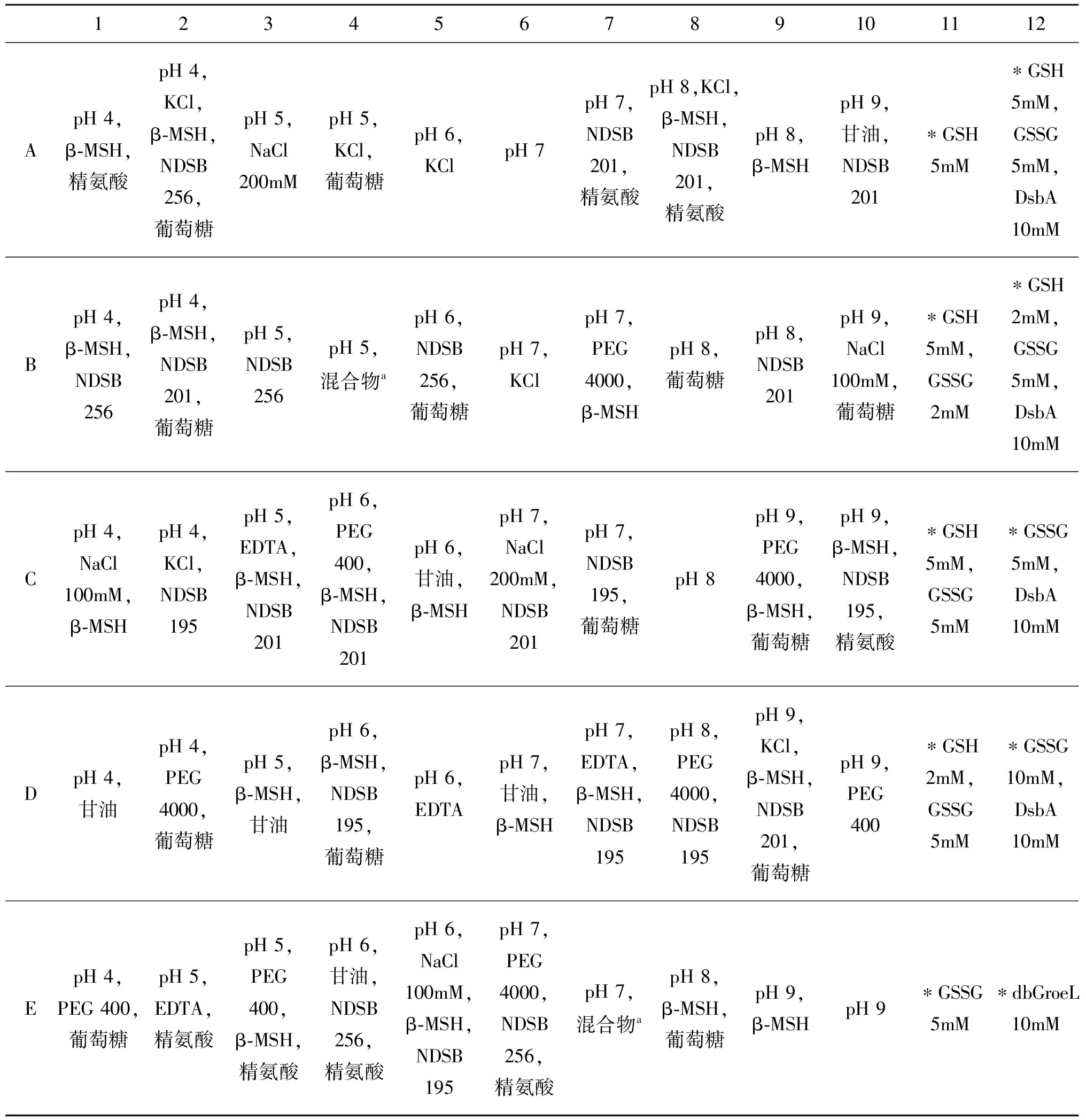
123456789101112ApH4,β⁃MSH,精氨酸pH4,KCl,β⁃MSH,NDSB256,葡萄糖pH5,NaCl200mMpH5,KCl,葡萄糖pH6,KClpH7pH7,NDSB201,精氨酸pH8,KCl,β⁃MSH,NDSB201,精氨酸pH8,β⁃MSHpH9,甘油,NDSB201∗GSH5mM∗GSH5mM,GSSG5mM,DsbA10mMBpH4,β⁃MSH,NDSB256pH4,β⁃MSH,NDSB201,葡萄糖pH5,NDSB256pH5,混合物apH6,NDSB256,葡萄糖pH7,KClpH7,PEG4000,β⁃MSHpH8,葡萄糖pH8,NDSB201pH9,NaCl100mM,葡萄糖∗GSH5mM,GSSG2mM∗GSH2mM,GSSG5mM,DsbA10mMCpH4,NaCl100mM,β⁃MSHpH4,KCl,NDSB195pH5,EDTA,β⁃MSH,NDSB201pH6,PEG400,β⁃MSH,NDSB201pH6,甘油,β⁃MSHpH7,NaCl200mM,NDSB201pH7,NDSB195,葡萄糖pH8pH9,PEG4000,β⁃MSH,葡萄糖pH9,β⁃MSH,NDSB195,精氨酸∗GSH5mM,GSSG5mM∗GSSG5mM,DsbA10mMDpH4,甘油pH4,PEG4000,葡萄糖pH5,β⁃MSH,甘油pH6,β⁃MSH,NDSB195,葡萄糖pH6,EDTApH7,甘油,β⁃MSHpH7,EDTA,β⁃MSH,NDSB195pH8,PEG4000,NDSB195pH9,KCl,β⁃MSH,NDSB201,葡萄糖pH9,PEG400∗GSH2mM,GSSG5mM∗GSSG10mM,DsbA10mMEpH4,PEG400,葡萄糖pH5,EDTA,精氨酸pH5,PEG400,β⁃MSH,精氨酸pH6,甘油,NDSB256,精氨酸pH6,NaCl100mM,β⁃MSH,NDSB195pH7,PEG4000,NDSB256,精氨酸pH7,混合物apH8,β⁃MSH,葡萄糖pH9,β⁃MSHpH9∗GSSG5mM∗dbGroeL10mM

续表
注:“*”的成分为Tris(pH8),NaCl 150 mM,EDTA;GroEL是可溶的分子伴侣。
2.2.4 透析
将复性后的溶液倒入透析袋,再将透析袋放入4 L透析液(10 mMTris-HCl pH 8.0),转子缓慢搅动下透析12 h。透析完成后进行抽滤。
2.2.5 纯化
通过蠕动泵上样,将抽滤后的复性液流动穿过HP Q预装柱。复性后的蛋白富集挂在Q柱上。然后将Q柱接到FPLC(快速蛋白液相色谱)进行梯度洗脱纯化。对应检测器显示的洗脱峰取相应的收集管进行SDS-PAGE检测。根据检测结果取含有目的蛋白的样品,用超滤管浓缩换液(10 mM Tris-HCl, pH 8.0),浓缩到200 μL上样过Superdex 200 10/300 GL分子筛预装柱。每个收集管收集体积0.5 mL。整个过程在4 ℃进行。根据检测峰取对应的收集样品进行SDS-PAGE鉴定。
3 结果与讨论
3.1 HLA-B27的原核表达SDS-PAGE检测
由SDS-PAGE的结果(图1)可以看出,相比于未诱导的菌表达的总蛋白、加IPTG诱导后的菌的破碎上清液中的蛋白,诱导后的菌的破碎沉淀样品在胶上有明显加粗的条带位于30—40 kD之间,HLA-B27的大小约为33 kD,说明HLA-B27在E.coli中表达为包涵体。

图1 HLA-B27的原核表达SDS-PAGE检测
3.2 HLA-B27包涵体提取溶解后的SDS-PAGE检测
3 L菌表达的包涵体,最后用10 mL高浓度尿素溶液溶解,用梯度稀释法点样SDS-PAGE检测,每孔点样10 μL(图2)。与蛋白分子量标准比对可知溶解的包涵体浓度为20 mg/mL。
3.3 HLA-B27的复性条件筛选
由Native-PAGE结果(图3)看出,在A10(50 mM CHES pH 9.0, 20% 甘油,100 mM NDSB201)条件下,在胶上可见几条收敛的条带。由于未变性的蛋白在Native-PAGE中的迁移速率是由蛋白的大小和表面电荷共同决定的,在Native-PAGE中能看到的收敛的条带往往代表着此条带的蛋白的大小和表面电荷等性状一致,并且是具有一定结构的。所以结果表明,HLA-B27包涵体在A10条件复性成功。

图2 HLA-B27包涵体SDS-PAGE检测

图3 A10条件下的Native-PAGE
3.4 HLA-B27扩大复性纯化后的分子筛鉴定和SDS-PAGE检测
由监测器可以看出(图4),第1个出峰位置为8 mL(第16管),第2个出峰位置为13 mL(第26管)。根据与标准蛋白过Superdex 200 10/300 GL分子筛的检测图谱比较可知,第1个峰为HLA-B27蛋白的多聚体,第2个峰出来的蛋白大小约为67 kD(图5),正好与HLA-B27同源二聚体的大小(66 kD)相近。将在第2个峰收集的样品(26管),通过在上样缓冲液里未加和加入β-巯基乙醇对比进行SDS-PAGE(图5)可以看出,加入β-巯基乙醇时蛋白条带在33 kD处,未加β-巯基乙醇时蛋白条带在66 kD处,进一步证实第二个峰出来的蛋白确实是HLA-B27的同源二聚体,而且是通过二硫键形成的。通过胶图的估算和Nanodrop测量,最终得到0.2 mg。

图4 Superdex 200 10/300 GL分子筛纯化图

图5 第二个峰样品SDS-PAGE
4 结束语
本研究从3 L Rosetta(DE3)表达菌中提取和多步清洗溶解处理,得到较纯的HLA-B27包涵体约200 mg。取20 mg包涵体作复性、透析、纯化,最后得到HLA-B27同源二聚体蛋白0.2 mg,得率为1%。我们曾按照文献[6]中的条件和方法进行包涵体复性,当尿素溶解后的包涵体加入配制好的复性溶液时,包涵体在复性溶液中迅速沉淀析出,无法复性。所以本实验选择通过高通量筛选的方法,首先筛选出适合HLA-B27复性的条件,然后扩大复性纯化出目的蛋白HLA-B27同源二聚体,为以后的蛋白晶体生长以及结构生物学研究奠定基础。
[1] Reveille J D. Epidemiology of spondyloarthritis in North America[J].Am J Med Sci, 2011, 341(4):284-286.
[2] Bowness P. HLA-B27[J].Annu Rev Immunol, 2015, 33:29-48.
[3] Benjamin R, Parham P. Guilt by association: HLA-B27 and ankylosing spondylitis[J].Immunol Today, 1990, 11(4):137-142.
[4] Benjamin R J, Madrigal J A, Parham P. Peptide binding to empty HLA-B27 molecules of viable human cells[J].Nature, 1991, 351(6321):74-77.
[5] Antoniou A N, Ford S, Taurog J D,et al. Formation of HLA-B27 homodimers and their relationship to assembly kinetics[J].J Biol Chem, 2004, 279(10):8895-8902.
[6] Allen R L, O’Callaghan C A, McMichael A J, et al. Cutting edge: HLA-B27 can form a novel beta 2-microglobulin-free heavy chain homodimer structure[J].J Immunol, 1999, 162(9):5045-5048.
[7] Bird L A, Peh C A, Kollnberger S, et al. Lymphoblastoid cells express HLA-B27 homodimers both intracellularly and at the cell surface following endosomal recycling[J].Eur J Immunol, 2003, 33(3):748-759.
[8] Vincentelli R, Canaan S, Campanacci V, et al. High-throughput automated refolding screening of inclusion bodies[J]. Protein Sci, 2004, 13(10):2782-2792.
Expression and purification of unconventional homodimer of spondyloarthritides associatied HLA-B27
TUWen-ya,ZENGChi
(School of Biology and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023,China)
Ankylosing spondylitis is highly associated with a certain HLA allotype-HLA-B27. But the pathogenic role of HLA-B27 remains unclear. Recently,the theory of HLA-B27 homodimer inducing ankylosing spondylitis is becoming popular, but the corresponding structural evidence is lacked. The crystal structure data of HLA-b27 homodimer might provide the most intuitive evidence for this pathogenic mechanism and theoretical guidance for effective drug design and clinical treatment. In this study, the HLA-B27 protein was expressed inE.colias inclusion body. After refolding and purification, 0.2mg HLA-B27 homodimer with high purity and homogeneity was obtained from 20mg inclusion bodies, which laid an important foundation for obtaining high quality protein crystal and structure data of HLA-B27 homodimer.
ankylosing spondylitis;HLA-B27;homodimer;purification
2017-01-06.
涂文亚(1990-),男,硕士研究生,E-mail:wenya_tu@163.com.
曾驰(1980-),男,副教授,E-mail:232881046@qq.com.
2095-7386(2017)01-0048-06
10.3969/j.issn.2095-7386.2017.01.010
Q 512
A
