放牧对若尔盖高原湿地CH4排放的影响
2017-04-10周文昌崔丽娟王义飞
周文昌,崔丽娟,王义飞,李 伟
1 中国林业科学研究院湿地研究所,湿地生态功能与恢复北京市重点实验室, 北京 100091 2 湖北省林业科学研究院, 武汉 430075
放牧对若尔盖高原湿地CH4排放的影响
周文昌1,2,崔丽娟1,*,王义飞1,李 伟1
1 中国林业科学研究院湿地研究所,湿地生态功能与恢复北京市重点实验室, 北京 100091 2 湖北省林业科学研究院, 武汉 430075
湿地是大气甲烷(CH4)的主要排放源,而有关放牧对湿地CH4排放的影响特征仍未得到足够的报道。因此,通过静态箱法,研究了放牧对四川省若尔盖高原湿地CH4排放的影响,CH4气体通过快速温室气体分析仪测量。结果表明:放牧样地和围栏内样地生长季CH4排放量为(31.32±19.57)g/m2和(30.31±23.46)g/m2,它们之间无差异显著;但是集中放牧期间(7—9月),放牧样地(21.01±12.35)g/m2较围栏内样地显著增加了CH4排放量为54.3%。2014年生长季期间通过刈割植物模拟放牧表明两种刈割强度CH4排放量为(5.01±5.37)g/m2和(4.69±5.99)g/m2,较未刈割样地(1.15±1.89)g/m2增加了335.9%和308.0%,其原因可能是放牧或者刈割减少地表植物生物量,降低植物高度,缩短了CH4排放的路径距离。该结果可为我国高原湿地保护与管理决策提供基础数据支撑。
放牧;刈割;CH4排放;若尔盖高原湿地
甲烷(CH4)是一种重要的温室气体,在全球变暖过程中起着重要的作用[1]。自从工业革命以来,由于人类活动的影响,全球大气CH4浓度增加了2.5倍[1],且CH4单分子潜在增温效应是二氧化碳(CO2)的25倍,是比CO2更活跃的温室气体,对全球温室效应的贡献率仅次于CO2[2]。尽管湿地仅占地球陆地面积的2%—6%[3],但湿地是大气CH4的主要来源,约为全球CH4总排放的32%—52%[1],从而湿地在调控大气CH4浓度变化中发挥着重要作用[4-5]。于是,湿地CH4排放大小和方向越来越受到全球日益的关注[3,6-8]。
然而,由于人类活动的加剧,诸如湿地排水、放牧、垦殖和采伐,湿地遭受严重的破坏[9-10]。放牧作为山区草地和湿地的主要人类活动之一,引起了一系列的生态环境因子变化[9,11-12]。放牧通常降低地上植物生物量[6]和影响植物群落组成[11,13],例如,放牧使得莎草草甸和湿地优势苔草植物群落(Carexnebrascensis)向早熟禾植物群落(Poapratensis)演替[14]。另外,蹄类动物(如牦牛)践踏土壤地表,压实土壤,增加土壤容重[15],可能降低地表水的渗透率和增加地表径流[12,15],这将可能影响生态系统地上与地下的水文过程[12]。同时放牧也影响土壤性质[16],诸如土壤有机质含量[17]和土壤氮矿化[11]。由于放牧改变了湿地生物和非生物环境因子,可能改变湿地CH4排放通量[3,10,18-19]。
目前国际上有关湿地放牧对CH4排放通量的影响研究较多。如Bodelier等[20]研究浅滩湖滨湿地(Shallow lakes)小天鹅(CygnuscolumbianusbewickiiYarrell)觅食对湿地CH4排放的影响指出:小天鹅觅食减少植物生物量,随后减少CH4生成量和增加CH4氧化量,进而降低了CH4排放;Falk等[7]研究刈割和移除维管植物来模拟放牧降低产CH4有机底物的输入和植物传输CH4的功能,结果也表明放牧减少CH4排放;而Hirota等[6]和Ward等[21]通过放牧样地与未放牧样地的田间对比试验指出放牧增加了CH4排放,原因可能是放牧缩短CH4排放的氧化路径距离或者改变植物组成;Sjögersten等[19]和Ford等[22]的研究则表明,食草动物或者放牧并无显著地影响湿地CH4排放,可能原因是湿地具有高土壤水分含水率、更低土壤温度,以及放牧地和围栏地优势植物组成并未发生改变。综上所述,放牧对湿地CH4排放的影响并未取得一致的结论。我国有关放牧对CH4排放通量的影响主要集中在草地生态系统[23-24],且表明草地生态系统放牧后,草地生态系统为大气的CH4汇;Hirota等[6]通过生长季2d(8月15日和9月15日)研究放牧对我国青藏高原湿地CH4排放的影响结果表明,放牧增加了CH4排放为100%—300%,但其影响机制不明确,研究结果也难以准确预算放牧对我国高原湿地CH4排放的影响程度。此外,长期放牧,降低植被生产力[6,21],可能减少湿地产CH4所需的碳源有机底物,进而长期放牧减少CH4排放[6- 7]。因此,继续研究放牧对湿地CH4排放的影响规律和机制具有重要意义。
若尔盖高原是世界上高原湿地面积最大,海拔最高的湿地[25]。然而,若尔盖高原泥炭沼泽草场存在过度放牧,沼泽湿地载畜量超载了60%—150%[26-27]。这种过度放牧已经改变植物群落组成与结构[28]、群落物种生活型组成和演替模式[29],可能改变CH4排放特征和排放量。因此,本文选择具有代表性的若尔盖高原泥炭沼泽湿地作为研究对象,基于静态箱法,通过快速温室气体分析仪测量CH4排放,旨在揭示放牧对若尔盖高原湿地CH4排放的影响特征,探讨其影响因子,量化放牧对若尔盖高原湿地生长季CH4排放的影响效果,为我国高原湿地保护与管理提供决策支撑。
1 研究点概况与研究方法
1.1 研究点概况
本研究点(33°55′ 8″ N,102° 49′ 8″ E,海拔为3441 m)位于青藏高原东部边缘的若尔盖湿地。若尔盖湿地属于青藏高原寒冷气候区,气候特点为寒冷潮湿,年均气温为0.6—1.2℃,最暖和最冷气温为7月和1月,平均温度分别为10.8℃和-10.6℃[25,28]。区内年均降水量650 mm,降水主要集中在5—9月,占全年降水量的80%[25,27]。研究点主要植物为西藏嵩草(Kobresiatibetica)、木里苔草(Carexmuliejsis)、花葶驴蹄草(Calthascaposa)和鹅绒委陵菜(Potentillaansrina),伴生稀少的矮金莲花(Trolliusfarreri)和矮火绒草(Leontopodiumnonum)等。植物群落盖度接近100%,土壤类型为泥炭沼泽土。
1.2 研究方法
1.2.1 实验设计
于2013年5月选择一片典型的泥炭沼泽湿地,在围栏外自由放牧苔草塔头上(Ghk- 2013)和围栏内禁牧苔草塔头上(Fhk- 2013)分别安装3个静态箱,围栏外自由放牧,集中放牧时间为7月下旬至9月底,围栏时间为5—10月(10月,部分牦牛和羊进入围栏内啃食草),围栏内和围栏外的植物群落高度季节性变化如图1。研究期间内,本研究点,放牧强度估计每公顷约3.13个羊单位。另外,在2014年4月下旬,于2013年同一观测点围栏面积1 hm2内,通过刈割塔头上植物(两个处理组,植物群落高度保持为8 cm和4 cm的两种刈割强度,标注为Chk- 8 cm- 2014和Chk- 4 cm- 2014)和未刈割塔头上植物(对照组,标注为Fhk- 2014),且各自安装3个静态箱(n=3)。静态箱底座共安装15个。由于6月12日之前植物群落高度约为4—6 cm,刈割时间从6月21日开始操作,具体刈割时间为每次测量气体的前1天,刈割植物保留在箱底。
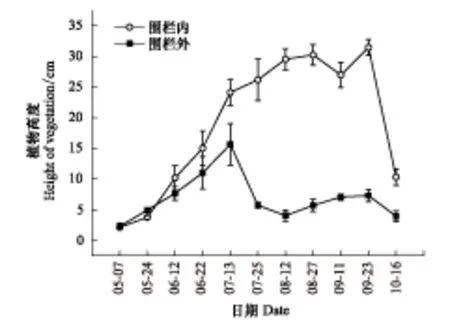
图1 围栏内和围栏外的植物高度季节性变化 Fig.1 Seasonal variation of vegetation height in the fencing and grazing sites
1.2.2 CH4气体数据采集
采集方法通过静态箱法,静态箱由底座(50 cm × 50 cm × 20 cm)和顶箱(50 cm × 50 cm × 50 cm)组成。静态箱底座由不锈钢制作,上口周围有5 cm高度的水槽,防止气体泄漏;底座插入土壤为15 cm,整个实验期间保持于原位土壤中。顶箱由薄的铝材料制成,为了稳定箱内温度,箱外包装着塑料泡沫,箱内顶部有2个5 cm × 5 cm风扇,箱顶上部中央附有直径为2 cm的2个橡皮塞小圆孔,连接着快速温室气体分析仪器(DLT- 100,Los Gatos Research,USA)的2根附有橡皮塞的透明导气管,导气管长度为4 m(内径为4 mm)[30-31],仪器通过12 V蓄电池供电,数据采集设置为1 Hz[30]。箱内空气通过仪器内置泵伴随着以上2根导气管在仪器内无破坏的循环分析。每次气体测量之前,底座水槽注满水,启动温室气体分析仪,等待仪器启动显示的箱内顶部内大气CH4浓度稳定到当地环境气体浓度后(体积分数为1.80×10-6),将静态箱扣在底座上,密闭测量5 min,然后揭开静态箱置于开放状态,继续开放状态约2 min,然后密闭测量下一个静态箱底座样点,循环执行以上操作过程。测量时间为2013年6—10月和2014年5—10月的北京时间9:30—11:30,观测频率为每月2次。CH4排放通量是以封闭箱内顶部的CH4浓度随时间变化的直线斜率计算[30-31]。CH4排放通量计算公式[4,31]如下:
式中,F为CH4排放通量(mg m-2h-1),dc/dt代表箱内CH4浓度随单位时间变化的直线斜率,M为被测气体的摩尔质量,P为采样点的大气压,V0、P0、T0分别为标准大气压下的标准摩尔体积、标准大气压和绝对温度,T为箱内的绝对温度,H为箱子高度。
1.2.3 环境生物因子和非生物因子测量
两个生长季的8月中旬收割地上生物量,而地下生物量测量深度为0—20 cm,带回实验室恒温箱70℃下烘干48 h至恒重,并称重,计算生物量。每个样点重复测量3—6个样方(50 cm ×50 cm)。测量CH4气体时,同步监测土壤温度(5、15 cm和30 cm)和样点水位。为了尽量少破坏湿地生态系统,2013年围栏内和围栏外的样点土壤水位采用同一水井记录;由于两种刈割样点相距2 m左右,2014年两种刈割样点水位采用同一水井记录。同时,采集土壤0—10 cm、10—20 cm和20—30 cm深度样品,实验室内分析其土壤理化性质(表1),每个土壤因子均重复3次。
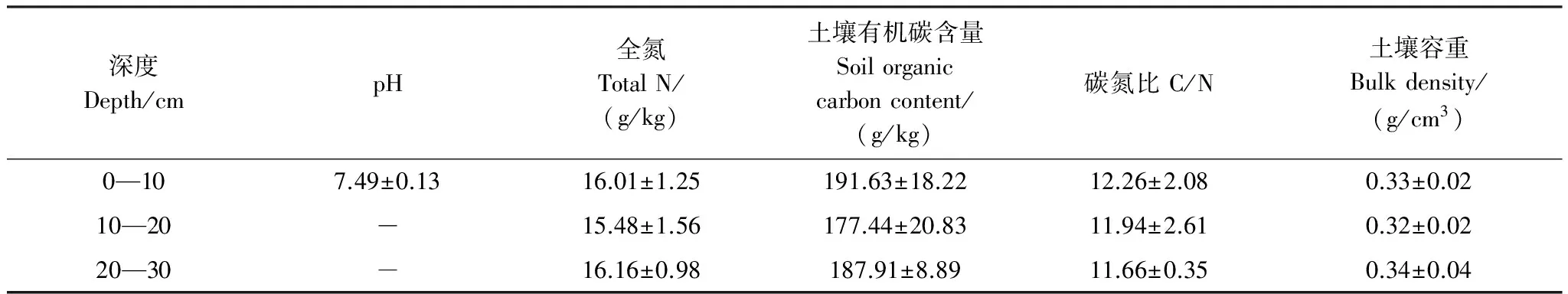
表1 研究样地土壤理化性质
表中数值为平准值±标注差
1.3 数据处理
环境生物因子、非生物因子生长季的时间变化和CH4排放通量的时间变化差异采用SPSS18.0单因素多重配对方差(Duncan)分析,而环境因子和CH4排放通量的不同处理水平之间差异采用配对-t检验。环境因子与CH4排放通量之间的相关性采用Pearson相关系数检验。统计显著水平P=0.05。作图软件采用Origin 8.6。
2 结果与分析
2.1 环境生物因子和非生物因子
生长季期间,不同处理之间(放牧样地与围栏内或者刈割与未刈割样地)同一层土壤温度(5 cm、15 cm 和30 cm)不存在差异显著(P>0.05)(图2)。基于2013年和2014年对应月份水位分析(6—10月)表明两个生长季水位无差异显著(P>0.05),但是基于夏季期间(6—8月)的水位分析表明2014年夏季期间水位平均值较2013年显著降低了46.6 cm(P<0.05)(图2)。
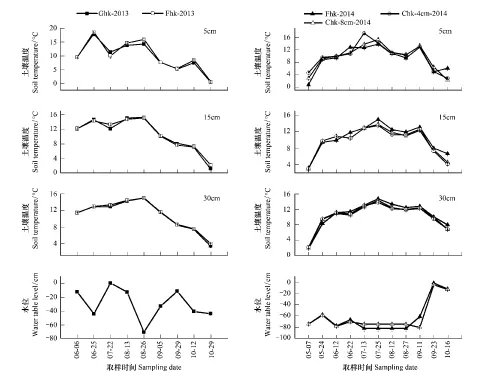
图2 研究点的土壤温度和水位Fig.2 Soil temperature and water table level in study site符号Ghk- 2013和Fhk- 2013,代表围栏外和围栏内的样点;Fhk- 2014、Chk- 8 cm- 2014和Chk- 4 cm- 2014分别代表2014年围栏内、刈割植物保持高度8 cm和4 cm的样点
2013年围栏外放牧样地地上植物生物量为(525.88±103.47)g/m2,较围栏内样地地上生物量(886.09±124.46)g/m2显著降低了37.5%(P<0.05),而两者地下生物量无差异显著(P>0.05)。2013年和2014年围栏内样地地上生物量无差异显著(P>0.05),而两个生长季地下植物生物量同样无差异显著(P>0.05)(图3)。
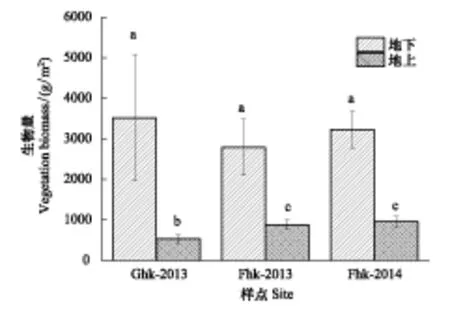
图3 放牧对湿地植被生物量的影响Fig.3 Effects of grazing on the vegetation biomass in study site
2.2 放牧和刈割对湿地CH4排放的影响
CH4排放存在显著时间变化格局,两个生长季CH4排放范围为-0.42—18.06 mg m-2h-1(图4)。2013年生长季(6—10月)围栏内(对照地Fhk- 2013)表现为夏季(6月25日和8月25日)和秋季(10月12日)具有较高CH4排放(13.20—18.06 mg m-2h-1),进入冬季之前(10月29日)CH4排放降低(2.04 mg m-2h-1);而放牧样地(Ghk- 2013),CH4排放表现为夏季(8月13日和26日)和秋季(9月5日)具有较高CH4排放(11.48—16.28 mg m-2h-1),进入冬季之前(10月29日),CH4排放最低(2.10 mg m-2h-1)(图4)。2014年生长季(5—10月中旬),未刈割样地(Fhk- 2014)表现为春季5月至秋季9月观测到非常小的CH4排放(0.07—0.52 mg m-2h-1),甚至出现一个CH4吸收汇现象(-0.42 mg m-2h-1),秋季10月中旬观测到CH4排放峰值(1.55 mg m-2h-1)。2014年生长季两个刈割样地(Chk- 8 cm- 2014和Chk- 4 cm- 2014)表现为夏季(6月22日和7月25日)和秋季(10月16日)具有较高CH4排放(1.68—4.31 mg m-2h-1)。

图4 放牧和刈割样地CH4排放季节性变化Fig.4 Seasonal variation of CH4 emission in the grazing and clipping sites
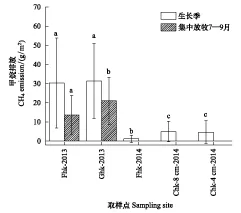
图5 放牧、围栏内和刈割样地的生长季CH4排放 Fig.5 Seasonal CH4 emission in the grazing, fencing and clipping sites图中不同字母表示同一观测期间不同处理之间甲烷排放显著差异(P<0.05)
放牧和刈割影响CH4排放量如图5。2013年生长季(165 d),放牧样地(Ghk- 2013)和围栏内样地(Fhk- 2013)CH4排放量(±标准差)为(31.32±19.57)g/m2和(30.31±23.46)g/m2,它们之间无差异显著(P>0.05)。而集中放牧时间7—9月,放牧样地Ghk- 2013和围栏内样地Fhk- 2013 CH4排放量为(21.01±12.35)g/m2和(13.61±10.14) g/m2,放牧样地Ghk- 2013 CH4排放量较围栏内无放牧地显著地增加了54.3%(P<0.05)。2014年生长季,未刈割样地(Fhk- 2014)、刈割样地Chk- 8 cm- 2014和Chk- 4 cm- 2014生长季CH4排放量依次为(1.15±1.89)g/m2、(5.01±5.37)g/m2和(4.69±5.99)g/m2,刈割样地Chk- 8 cm- 2014和Chk- 4 cm- 2014的生长季CH4排放量较未刈割样地Fhk- 2014显著增加了335.9%和308.0%(P<0.05)。
2.3 CH4排放与土壤温度和水位的相关关系
2013年生长季期间,围栏内样地(Fhk- 2013)CH4排放与土壤5 cm温度显著正相关(P<0.05),放牧样地(Ghk- 2013)CH4排放与土壤温度和水位无显著相关关系(P>0.05)。2014年生长季,围栏内(Fhk- 2014)CH4排放与水位存在显著线性正相关(P<0.05),而两个刈割样地(Chk- 8 cm- 2014和Chk- 4 cm- 2014)CH4排放与土壤温度和水位无显著相关关系(P>0.05)。8月份,湿地CH4排放通量(n=9)与地上生物量存在显著负相关关系(表2)。

表2 CH4排放与土壤温度、水位和地上生物量的相关关系
a:8月CH4排放通量;*显著差异水平P<0.05
3 讨论
本研究点湿地生长季CH4排放范围(-0.42—18.06 mg m-2h-1)与其他在若尔盖高原研究CH4排放范围吻合(-1.0—90 mg m-2h-1)[8,32- 33]。本研究点湿地CH4排放存在明显的季节性变化,CH4排放峰值出现在夏季或者秋季,这与其他研究结果类似[4,8,34-35]。夏季CH4排放速率高,其原因可能是温度较高,植物生长最旺盛,有机底物供应充足,分解速率快,有机底物的分解促进还原过程,降低了氧化还原电位,促进CH4排放[35-36],因此,夏季CH4排放速率快;而秋季CH4排放速率高,可能与新鲜底物碳输入有关,此时,正是当年生长的根或者地表落叶增加了碳输入[34],使可利用活性有机底物增加,同时秋季水位增加(图2),从而促进产CH4菌产生CH4,CH4排放速率升高。温度是影响草丛沼泽湿地CH4排放季节性变化的重要影响因子,这一结论已被其他研究所证实[8,37],但是CH4排放季节性变化与温度的关系通常是在土壤水位接近地表或者水淹条件下被发现它们之间存在显著正相关[37-38]。而本研究仅发现对照地围栏内(Fhk- 2013)CH4排放与土壤5 cm温度存在显著线性正相关,其它样点无显著相关(表2),这可能是由于本研究样点2013年和2014年围栏内对照地、2014年刈割样地生长季平均水位远离地表[各自为(-29.8±22.5)cm、(-61.7±28.6)cm和(-61.6±26.7)cm]。当水位远离土壤地表之后,温度对CH4排放的影响作用可能减弱[38],其它影响因子(水位和植物)的作用增强,这可能是2014年生长季围栏内(Fhk- 2014)发现CH4排放与水位存在显著正相关的原因,但是放牧或刈割后的CH4排放几乎很难观测到CH4排放与温度或水位存在显著相关,可能是由于放牧或者刈割后改变了它们之间的相互关系,据Turetsky等[39]综述表明干扰湿地的CH4排放很难通过自然湿地CH4排放与水位和温度的函数关系去量化CH4排放。
生长季期间,放牧并无显著影响CH4排放(图5),这与其他研究结果类似[19,22]。其原因可能是水位和土壤温度是影响CH4排放的两大主控因子[10,39-40],而本研究点植物群落盖度接近100%,短期内放牧活动很难显著影响到土壤温度或者水位(图2)。然而,集中放牧时间(7—9月),放牧活动显著增加了CH4排放量为54.3%(图5),这与Hirota等[6]通过2d(8月15日和9月15日)研究的青藏高原湿地放牧显著地增加CH4排放的结果一致,认为部分原因可能是植物的通气组织传输CH4的垂直路径距离缩短导致的。而Paz-Ferreiro等[41]通过室内孵化试验研究放牧对湿地CH4排放的影响结果表明当放牧样地土壤温度位于15—20℃范围内时,提高放牧样地CH4排放对温度的敏感性,促进CH4排放。为了鉴别这两种影响因素的不同,根据Hirota等[6]研究的放牧样地CH4排放增加的原因推测得知,刈割植物同样会增加我国高原湿地CH4排放;同时,刈割排除放牧提高CH4对温度敏感性的影响。因此,2014年生长季采取原位的植物刈割技术,物理地降低植物群落高度,研究刈割对高原湿地CH4排放的影响,结果表明刈割技术增加湿地CH4排放量超过300%(图5)。另外,我国若尔盖高原地区生长季最热的月份为7月,多年7月份的平均气温为10.8℃,而本研究观测期间的土壤温度唯有2个数值(15.0和15.2℃)略高于15℃。反之,通过分析8月份湿地CH4排放通量与地上生物量(类似于植物高度变化)的关系,则表明它们之间存在显著线性负相关(表2),这与放牧或刈割后,植物高度降低(图1),可能促使CH4排放量增加的结果吻合(图5)。因此,短期内放牧显著增加高原湿地CH4排放是通过放牧(牦牛和绵羊)减少地上植物生物量(图3),缩短了植物传输CH4被氧化的路径距离,促进CH4排放。而从长期放牧后,放牧会降低植物生产力,减少产CH4的有机底物,并降低CH4排放[7];另外,放牧改变植物群落组成,使得具有通气组织的维管植物向其它旱生植物演替[14],进而改变CH4传输方式,影响CH4排放[7]。因此,继续长期定位研究放牧对湿地CH4排放的影响具有重要意义。
4 结论
生长季期间,放牧并无显著地影响CH4排放通量,但是集中放牧期间(7—9月),放牧地CH4排放量较围栏内(对照地)显著增加了54.3%;同时,通过刈割植物,刈割后,湿地CH4排放量较未刈割的样地显著增加了300%以上,这种CH4排放通量的增加,可能是由于湿地放牧或者刈割后,降低了植物传输CH4排放被氧化的路径距离,促进CH4排放。
致谢:本实验依托若尔盖高寒湿地生态系统定位研究站,得到若尔盖湿地国家级自然保护区管理局的支撑和帮助,特此致谢。
[1] IPCC. Climate Change 2013: The Physical Science Basis // Stocker T F, Qin D, Plattner G K, Tignor M, Allen S K, Boschung J, Nauels A, Xia Y, Bex V, Midgley P M, eds. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge, United Kingdom and New York, NY, USA: Cambridge University Press, 2013.
[2] IPCC. Climate Change 2007: The Physical Science Basis // Solomon S, Qin D, Manning M, Chen Z, Marquis M, Averyt K B, Tignor M, Miller H L, eds. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge, United Kingdom and New York, NY, USA: Cambridge University Press, 2007.
[3] Kayranli B, Scholz M, Mustafa A, Hedmark Å. Carbon storage and fluxes within freshwater wetlands: A critical review. Wetlands, 2010, 30(1): 111- 124.
[4] Sun X X, Mu C C, Song C C. Seasonal and spatial variations of methane emissions from montane wetlands in Northeast China. Atmospheric Environment, 2011, 45(10): 1809- 1816.
[5] 周文昌, 牟长城, 刘夏, 顾韩. 小兴安岭天然森林沼泽生态系统碳汇功能. 东北林业大学学报, 2012, 40(7): 71- 75, 127- 127.
[6] Hirota M, Tang Y H, Hu Q W, Kato T, Hirata S, Mo W H, Cao G M, Mariko S. The potential importance of grazing to the fluxes of carbon dioxide and methane in an alpine wetland on the Qinghai-Tibetan Plateau. Atmospheric Environment, 2005, 39(29): 5255- 5259.
[7] Falk J M, Schmidt N M, Ström L. Effects of simulated increased grazing on carbon allocation patterns in a high arctic mire. Biogeochemistry, 2014, 119(1): 229- 244.
[8] Ding W X, Cai Z C, Wang D X. Preliminary budget of methane emissions from natural wetlands in China. Atmospheric Environment, 2004, 38(5): 751- 759.
[9] 赵魁义, 何池全. 人类活动对若尔盖高原沼泽的影响与对策. 地理科学, 2000, 20(5): 444- 449.
[10] Oleszczuk R, Regina K, Szajdak L, Höper H, Maryganova V. Impacts of agricultural utilization of peat soils on the greenhouse gas balance // Strack M, eds. Peatlands and climate change. Saarijärven Offset Oy, Saarijärvi, Finland: International Peat Society Press, 2008: 70- 97.
[11] Middleton B A, Holsten B, Van, Diggelen R. Biodiversity management of fens and fen meadows by grazing, cutting and burning. Applied Vegetation Science, 2006, 9(2): 307- 316.
[12] Clay G D, Worrall F, Clark E, Fraser E D G. Hydrological responses to managed burning and grazing in an upland blanket bog. Journal of Hydrology, 2009, 376(3/4): 486- 495.
[13] Martin D W, Chambers J C. Effects of water table, clipping, and species interactions onCarexnebrascensisandPoapratensisin riparian meadows. Wetlands, 2001, 21(3): 422- 430.
[14] Middleton B. Nonequilibrium dynamics of sedge meadows grazed by cattle in southern Wisconsin. Plant Ecology, 2002, 161(1): 89- 110.
[15] Donkor N T, Gedir J V, Hudson R J, Bork E W, Chanasyk D S, Naeth M A. Impacts of grazing systems on soil compaction and pasture production in Alberta. Canadian journal of soil science, 2002, 82(1): 1- 8.
[17] Luan J W, Cui L J, Xiang C H, Wu J H, Song H T, Ma Q F. Soil carbon stocks and quality across intact and degraded alpine wetlands in Zoige, east Qinghai-Tibet Plateau. Wetlands Ecology and Management, 2014, 22(4): 427- 438.
[18] 郝庆菊, 王跃思, 江长胜, 王长科, 王明星. 湿地甲烷排放研究若干问题的探讨. 生态学杂志, 2005, 24(2): 170- 175.
[19] Sjögersten S, Van der, Wal R, Loonen M J J E, Woodin S J. Recovery of ecosystem carbon fluxes and storage from herbivory. Biogeochemistry, 2011, 106(3): 357- 370.
[20] Bodelier P L E, Stomp M, Santamaria L, Klaassen M, Laanbroek H J. Animal-plant-microbe interactions: Direct and indirect effects of swan foraging behaviour modulate methane cycling in temperate shallow wetlands. Oecologia, 2006, 149(2): 233- 244.
[21] Ward S E, Bardgett R D, McNamara N P, Adamson J K, Ostle N J. Long-term consequences of grazing and burning on northern peatland carbon dynamics. Ecosystems, 2007, 10(7): 1069- 1083.
[22] Ford H, Garbutt A, Jones L, Jones D L. Methane, carbon dioxide and nitrous oxide fluxes from a temperate salt marsh: Grazing management does not alter Global Warming Potential. Estuarine, Coastal and Shelf Science, 2012, 113: 182- 191.
[23] 王艳芬, 纪宝明, 陈佐忠, Ojima D. 锡林河流域放牧条件下草原CH4通量研究结果初报. 植物生态学报, 2000, 24(6): 693- 696.
[24] 周培. 不同放牧强度对内蒙古草原温室气体通量影响[D]. 呼和浩特:内蒙古农业大学, 2011.
[25] Xiang S, Guo R Q, Wu N, Sun S C. Current status and future prospects of Zoige Marsh in eastern Qinghai-Tibet Plateau. Ecological Engineering, 2009, 35(4): 553- 562.
[26] 王长科, 王跃思, 张安定, 吕宪国. 若尔盖高原湿地资源及其保护对策. 水土保持通报, 2001, 21(5): 20- 22, 40- 40.
[27] 郑群英, 泽柏, 李华德, 陈明胜. 若尔盖沼泽草甸载畜量变化. 草业与畜牧, 2009, (6): 14- 16.
[28] 李珂, 杨永兴, 杨杨, 韩大勇. 放牧胁迫下若尔盖高原沼泽退化特征及其影响因子. 生态学报, 2011, 31(20): 5956- 5969.
[29] 韩大勇, 杨永兴, 杨杨, 李珂. 放牧干扰下若尔盖高原沼泽湿地植被种类组成及演替模式. 生态学报, 2011, 31(20): 5946- 5955.
[30] Mastepanov M, Sigsgaard C, Dlugokencky E J, Houweling S, Ström L, Tamstorf M P, Chrisensen T R. Large tundra methane burst during onset of freezing. Nature, 2008, 456(7222): 628- 630.
[31] McEwing K R, Fisher J P, Zona D. Environmental and vegetation controls on the spatial variability of CH4emission from wet-sedge and tussock tundra ecosystems in the Arctic. Plant and Soil, 2015, 388(1): 37- 52.
[32] 王德宣, 吕宪国, 丁维新, 蔡祖聪, 高景福, 杨福明. 若尔盖高原沼泽湿地CH4排放研究. 地球科学进展, 2002, 17(6): 877- 880.
[33] Chen H, Wu N, Yao S P, Gao Y H, Zhu D, Wang Y F, Xiong W, Yuan X H. High methane emissions from a littoral zone on the Qinghai-Tibetan Plateau. Atmospheric Environment, 2009, 43(32):4995- 5000.
[34] Kang H, Freeman C. The influence of hydrochemistry on methane emissions from two contrasting northern wetlands. Water, Air, & Soil Pollution, 2002, 141(1): 263- 272.
[35] 孙晓新, 牟长城, 石兰英, 程伟, 刘霞, 吴云霞, 冯登军. 小兴安岭森林沼泽甲烷排放及其影响因子. 植物生态学报, 2009, 33(3): 535- 545.
[36] Sugimoto A, Fujita N. Characteristics of methane emission from different vegetations on a wetland. Tellus B, 1997, 49(4): 382- 392.
[37] 牟长城, 石兰英, 孙晓新. 小兴安岭典型草丛沼泽湿地CO2、CH4和N2O的排放动态及其影响因素. 植物生态学报, 2009, 33(3): 617- 623.
[38] Heikkinen J E P, Maljanen M, Aurela M, Hargreaves K J, Martikainen P J. Carbon dioxide and methane dynamics in a sub-Arctic peatland in northern Finland. Polar Research, 2002, 21(1): 49- 62.
[39] Turetsky M R, Kotowska A, Bubier J, Dise N B, Crill P, Hornibrook E R C, Minkkinen K, Moore T R, Myers-Smith I H, Nykänen H, Olefeldt D, Rinne J, Saarnio S, Shurpali N, Tuittila E S, Waddington J M, White J R, Wickland K P, Wilmking M. A synthesis of methane emissions from 71 northern, temperate, and subtropical wetlands. Global Change Biology, 2014, 20(7): 2183- 2197.
[40] Whalen S C, Reeburgh W S. Methane oxidation, production, and emission at contrasting sites in a boreal bog. Geomicrobiology Journal, 2000, 17(3): 237- 251.
[41] Paz-Ferreiro J, Medina-Roldán E, Ostle N J, McNamara N P, Bardgett R D. Grazing increases the temperature sensitivity of soil organic matter decomposition in a temperate grassland. Environmental Research Letters, 2012, 7(1): 014027, doi:10.1088/1748- 9326/7/1/014027.
Effects of grazing on the emission of CH4flux in the Zoige Plateau wetland
ZHOU Wenchang1,2, CUI Lijuan1,*, WANG Yifei1, LI Wei1
1BeijingKeyLaboratoryofWetlandServicesandRestoration,InstituteofWetlandResearch,ChineseAcademyofForestry,Beijing100091,China2HubeiAcademyofForestry,Wuhan430075,China
Wetland ecosystems, as the main source of atmospheric methane (CH4), could seriously affect the concentration of atmospheric CH4and further climate change. Presently, wetland ecosystems have been severely affected by human actives (i.e., drainage, grazing, and harvesting). However, the effects of grazing on the CH4emission of wetland ecosystems have not been well investigated. Therefore, to evaluate the effects of grazing on the emission of CH4flux, we performed the field experiments in the Zoige Plateau wetland, southwestern China, from June to October 2013. We also performed field experiments to investigate the effects of simulated increased in sheep or yak grazing by the clipping on CH4emission in the same studied sites from May to October 2014. CH4emission was measured using a dark static chamber and the fast greenhouse gas analyzer (FGGA) during the two growing season. We observed an obvious seasonal variation in CH4emission at the studied sites. The CH4emission varied from -0.42 to 18.06 mg m-2h-1and its maximum value occurring in summer and/or autumn. These results showed that the CH4emission in the grazing and fencing plot was (31.32±19.57) g/m2and (30.31±23.46) g/m2, respectively, during the growing season, and there were no significant differences in CH4emission between grazing and fencing plots (P>0.05).However, the CH4emission in the grazing plot was (21.01±12.35) g/m2during heavy grazing periods (from July to September 2013), which was 54.3% higher than that in the fencing plot (un-grazed plot). Moreover, the results revealed that the CH4emission in the two clipping plots with 8 cm and 4 cm of vegetation height after clipping were (5.01±5.37) g/m2and (4.69±5.99) g/m2, respectively, during the growing season, which were significantly higher in the 8 cm vegetation height in the clipping plot (335.9%) than that in the non-clipping plot (1.15±1.89) g/m2(P<0.05), and 308.0% higher in the 4 cm vegetation height in the clipping plot than that in the non-clipping plot. Furthermore, we also measured the aboveground biomass in both the grazing and clipping plots. The results indicated that grazing decreased the aboveground biomass, which was 37.5% lower than the control plot ((525.88±103.47) g/m2vs. (886.09±124.46) g/m2) (P<0.05). We also found a significantly negative correlation between aboveground biomass and CH4emission in August (P<0.05), which may imply that CH4flux emissions decrease due to the reduced height of herbaceous vegetation. In summary, the results of the present study suggested that the sheep or yak grazing and clipping disturbance increased CH4emission in plateau wetland, via the reduction of the transporting distance from soil to the atmosphere due to significantly decreased aboveground biomass. This result provides the basic date for habitat protection and management in the plateau wetland in China.
grazing; clipping; CH4emission; Zoige Plateau wetland
国家林业公益性行业科研专项(201204201, 201304315);国家林业局“948”项目(2014- 4- 67);国家科技支撑项目(2011BAC02B03)
2015- 08- 31;
日期:2016- 06- 13
10.5846/stxb201508311798
*通讯作者Corresponding author.E-mail: lkyclj@126.com
周文昌,崔丽娟,王义飞,李伟.放牧对若尔盖高原湿地CH4排放的影响.生态学报,2017,37(3):851- 859.
Zhou W C, Cui L J, Wang Y F, Li W.Effects of grazing on the emission of CH4flux in the Zoige Plateau wetland.Acta Ecologica Sinica,2017,37(3):851- 859.
