Fisher判别分析法区分MRI中乳腺病灶性质的研究
2017-04-10张营周浩徐志宾
张营 周浩 徐志宾
1)河南新安县第二人民医院 新安 471800 2)河南洛阳市中心医院MR室 洛阳 471000 3)河南科技大学第一附属医院CT室 洛阳 471000
Fisher判别分析法区分MRI中乳腺病灶性质的研究
张营1)周浩2)徐志宾3)
1)河南新安县第二人民医院 新安 471800 2)河南洛阳市中心医院MR室 洛阳 471000 3)河南科技大学第一附属医院CT室 洛阳 471000
目的 基于磁共振成像(MRI)指标建立乳腺病灶性质的Fisher判别函数,为MRI诊断乳腺病灶性质提供理论依据。方法 对临床触诊乳腺肿块、可疑乳腺肿块,或超声检查、钼靶照相发现病灶但不能明确病灶性质的164例患者行MRI检查,分析病灶的形状(规则、不规则),边界(清晰、模糊)、信号强度(低、等、高、混杂信号)、内部强化特征(均匀强化,不均匀强化,环形强化或间隔强化),早期强化率(<50%、50%~100%和>100%)和时间-信号强度曲线(TIC)类型(Ⅰ型,Ⅱ型,Ⅲ型),并与组织学分级的良性、高危、恶性结果进行对照。结果 (1)164例患者MRI共发现178个病灶,组织学确诊良性病灶93个(52.25%),高危病灶28个(15.73%),恶性病灶57个(32.02%)。(2)单变量分析显示:形态、边界、内部强化特征、早期强化率和TIC在良性、高危、恶性乳腺病灶中差异有统计学意义(P<0.05)。(3)Fisher判别分析显示:形态、边界、内部强化特征、早期强化率和TIC入选以组织学分级为结果变量的判别函数:Function 1=0.914形态+0.737边界+0.930内部强化特征+0.963早期强化率+0.701TIC-2.892;Function 2=1.198形态+0.918边界+0.677内部强化特征-1.191早期强化率-0.373TIC-0.039,函数有统计学意义(P<0.05)。(4)函数区分良性、高危、恶性乳腺病灶的敏感性分别是77.42%、60.71%和82.46%,总体正判率76.41%,Kappa=0.625。结论 基于MRI显示的病灶形态、边界、内部强化特征、早期强化率和TIC建立的Fisher判别函数可以很好地区分乳腺病灶良性、高危和恶性特征,这对指导乳腺病灶的处理方式有借鉴意义。
乳腺肿瘤;磁共振成像;鉴别诊断;Fisher判别
乳腺病灶的性质是制订治疗方案、预后评估的依据。磁共振成像(MRI)能够提供乳腺病灶的形态学、血流动力学等方面的大量诊断信息,在乳腺病灶良、恶性的诊断和鉴别诊断中起到了非常重要的作用。然而,多数研究仅将病灶从病理分级的良、恶性方面进行分类,也缺乏MRI定量参数以区分良、恶性病灶的可行性。研究发现,当前病理确诊的某些交界性肿瘤具有双向分化的生物学特性[1-2]。因此,病理上采用恶性、高危和良性的分级方式,并融合多项MRI参数,建立乳腺病灶性质定量模型更加符合临床实际,而国内尚缺乏该方面的研究。我们基于Fisher判别分析法推演出乳腺病灶性质判别模型,旨在提高病灶性质术前或活检前诊断的精准性。
1 对象和方法
1.1 研究对象 选择新安县第二人民医院2013-11—2016-04间临床触诊乳腺肿块、可疑乳腺肿块,或乳腺超声检查、钼靶照相发现病灶但不能明确病灶性质推荐MRI检查的乳腺病变患者164例,其中女163例、男1例;年龄19~80岁,平均48.25岁。排除乳腺手术史,MRI检查前2周内穿刺活检者。
1.2 MRI成像 患者俯卧位,双乳自然悬垂于线圈的空洞内,肘正中静脉建立输液通道。采用美国GE公司的1.5T MRI系统,4通道乳腺专用线圈,扫描序列包括:(1)常规MRI平扫:层厚5 mm,层距1 mm,视野(field of view,FOV)320 mm×320 mm,横断位T1WI与矢状位快速自旋转回波(FSE)T2W脂肪抑制序列平扫。(2)动态增强:采用动态增强乳腺容积成像(VIBRANT)技术,重复时间(TR)4.7 ms,回波时间(TE)2.2ms,翻转角15°,数据矩阵416×320,层厚1.0 mm。注射对比剂前预双乳动态增强扫描一期(7个动态,每个动态120 s)作为蒙片。以Gd-DTPA(马根维显,Mag-nevist)作对比剂,以0.1 mmol/kg、2 mL/s团注,随后以同流率注入生理盐水20 mL,注射造影剂前采集图像1次,注射后随即启动增强扫描,连续无间隔重复扫描6次。
1.3 图像处理 由2名工作5 a以上的MRI室医师对感兴趣区域(region of interest,ROI)进行分析解读。参照美国放射学会提出的乳腺影像报告和数据系统磁共振成像标准[3],评价的内容包括:(1)形态学指标:形状分为规则(边缘光滑的圆形、卵圆形、线形、分叶状)和不规则(边缘不光滑、树枝状、蟹足样、卫星灶、毛刺征等)。边界分为清晰和模糊(病灶与周边临近组织相结合无明确界限或呈广泛炎症渗出性改变)。(2)平扫信号强度:以周围正常乳腺信号为参照,将病灶信号分为低、等、高、混杂信号。(3)内部强化特征:分为均匀强化,不均匀强化,环形强化或间隔强化。(4)早期强化率:分为<50%、50%~100%和>100%。(5)时间-信号强度曲线(time-signal intensity curves,TIC)类型 参照文献[4-5]将TIC分为3型。Ⅰ型(流入型):信号强度持续上升,在2 min以内出现峰值;Ⅱ型(平台型):早期信号强度快速上升,2~4 min内出现峰值,随之保持一平台状态;Ⅲ型(流出型):信号强度迅速上升后即迅速下降,无明确峰值出现。
1.4 组织学诊断 MRI检查后穿刺活检或乳腺病灶局部切除后病理检查,参照文献[6-7]将病灶性质分为3级:(1)恶性病变:乳腺浸润性导管癌,导管内癌,黏液癌,混合型癌,未分类癌。(2)高危病变:不典型导管增生、不典型小叶增生,乳头状瘤,肌上皮肿瘤,交界性乳腺叶状肿瘤,小叶原位癌。这些类型的病灶有发展为恶性的可能。(3)良性病变:乳腺囊肿,乳腺纤维瘤,脂肪瘤,乳腺炎,硬化性乳腺腺病,乳腺良性叶状肿瘤,乳腺导管上皮扩张,乳腺导管扩张等。
1.5 统计学方法 单变量分析的计数资料的比较采用χ2检验,Fisher判别分析法建立判别函数,绘制二维边际领域图和投影图,回代法评价函数的区分效能,Kappa法一致性检验,统计软件为SPSS16.0。
2 结果
2.1 组织学结果 164例患者共确诊178个病灶,其中,良性病灶93个(52.25%),高危病灶28个(15.73%),恶性病灶57个(32.02%)。
2.2 乳腺病灶的MRI指标单变量分析 MRI显示的形态、边界、内部强化特征、早期强化率和TIC在恶性、高危、良性乳腺病灶中差异有统计学意义P<0.05,3类病灶的信号强度差异无统计学意义(P>0.05),见表1。
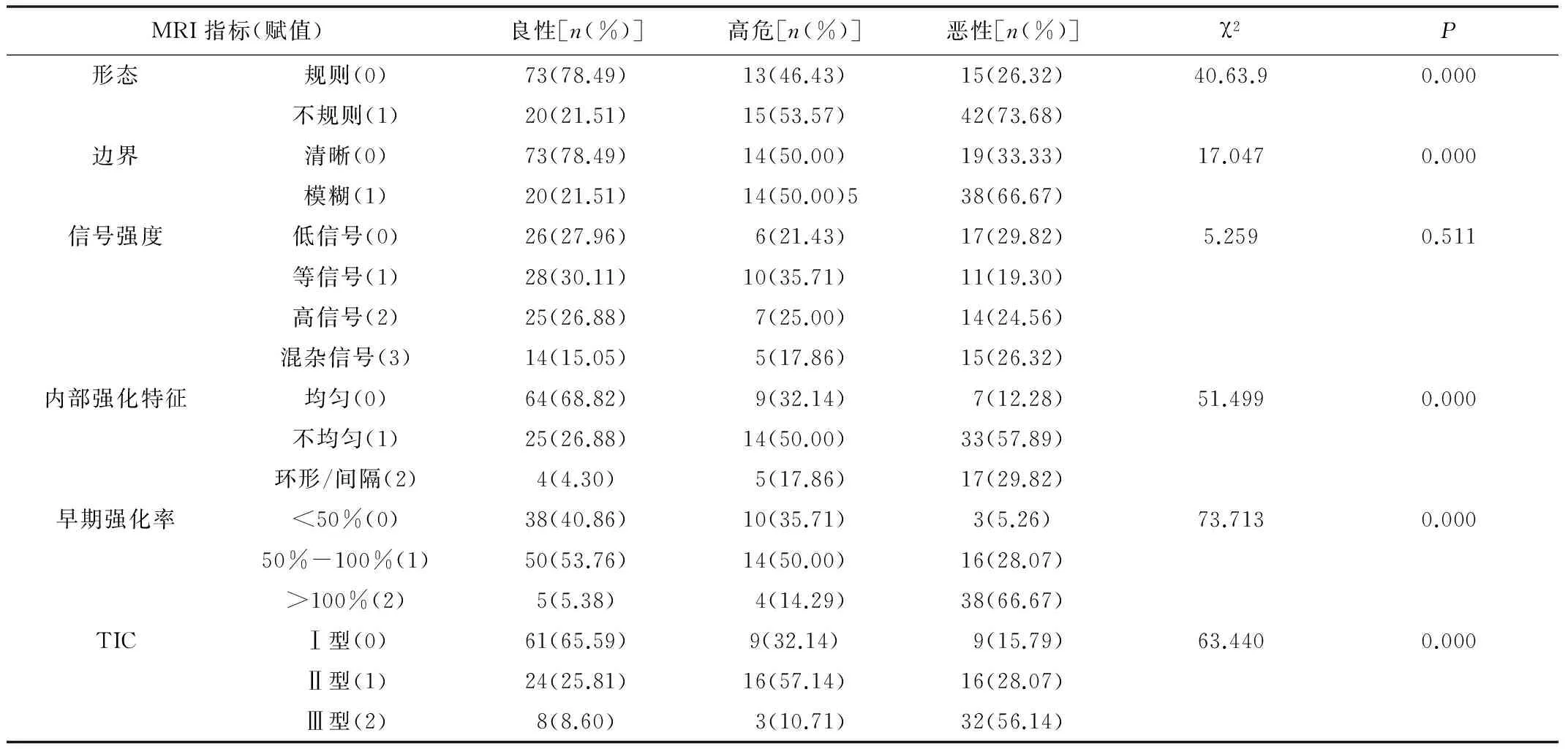
表1 良性、高危和恶性乳腺病灶MRI指标的单变量比较及赋值
2.3 Fisher判别 将组织学定性为良性、高危、恶性乳腺病灶作为结果变量,以单变量分析中P<0.05的形态、边界、内部强化特征、早期强化率和TIC 5个指标为解释变量,赋值见表1,在entry=0.05,removal=0.10水准上逐步法(StepwiseStatistics)判别分析。结果5个指标全部入选,见表2。建立判别函数:Function 1=0.914形态+0.737边界+0.930内部强化特征+0.963早期强化率+0.701TIC-2.892;Function 2=1.198形态+0.918边界+0.677内部强化特征-1.191早期强化率-0.373TIC-0.039。Function 1和Function 2分别解释了方差变异的97.1%和2.9%,函数有统计学意义(P<0.05),Wilks' Lambda=0.320、0.944,χ2=197.381、9.900,P=0.000、0.042。边际领域分布,见图1。
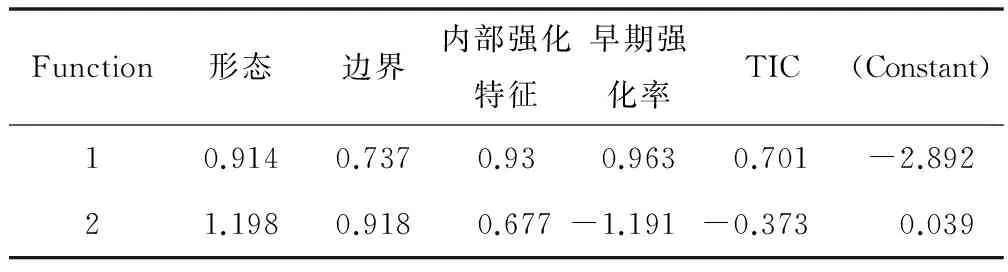
表2 Fisher判别非标化系数
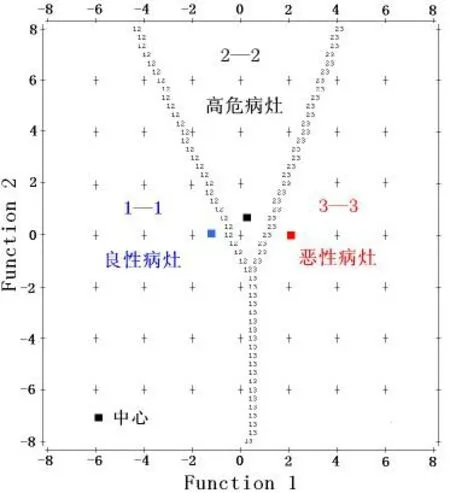
图1 良性、高危、恶性乳腺病灶的Fisher判别边际领域分布
2.4 函数的区分效能评价 回顾性评价函数的判别效能,良性、高危、恶性3类乳腺病灶的二维投影基本可辨,但存在部分交叉重叠现象,见图2。病灶的组织学诊断与判别函数预测结果的对应关系见表3,函数区分良性、高危、恶性乳腺病灶的敏感性分别是77.42%(72/93)、60.71%(17/28)和82.46%(47/57),总体正判率76.41%(136/178)。一致性检验,Kappa=0.625。
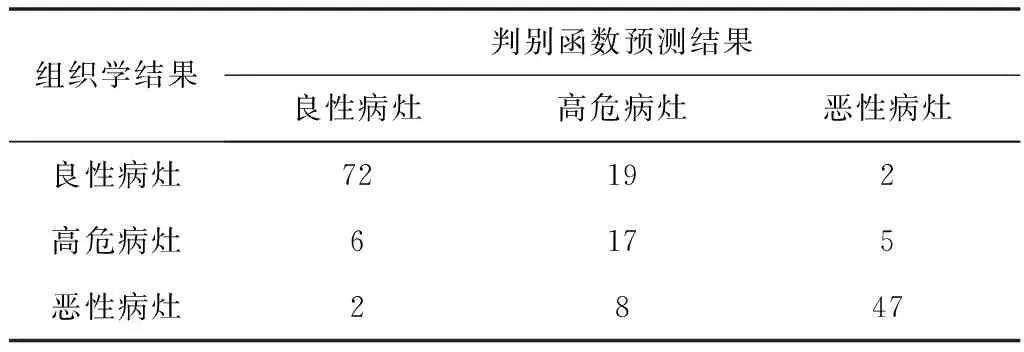
表3 乳腺病灶性质的组织学诊断与函数判别结果的对应关系(n)
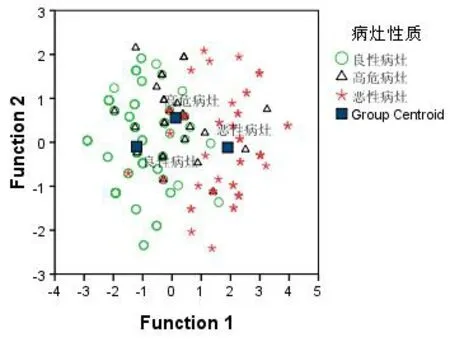
图2 178个乳腺病灶的Fisher判别投影
3 讨论
乳腺病灶的组织学分级对于治疗方案的制订、预后评估至关重要,以往研究的组织学分级多采取良、恶性的二分类方式[7],这种分级方式过于简单,其弊端在于不能反映乳腺病灶的生物学行为及其演变过程。事实上一些乳腺病灶可表现为起初良性,逐渐过渡到高危再到恶性的动态进展过程,如起源于乳腺终末导管小叶单位的良性增生,进展为高危的乳腺导管原位癌(DCIS,2003年WHO将其定义为非浸润性癌前病变),最后发展为恶性的浸润性导管癌。再如乳腺叶状肿瘤(PTB)具有纤维/上皮双向分化的生物学行为,有良性、交界性和恶性的组织学分型[8-9]。故本研究采用良性、高危和恶性的分级方式,这符合病灶由良性逐渐向恶性发展的过程,对治疗有很好的指导价值。
乳腺病灶的形态特征可在一定程度上反映其病理学性质。病灶的形态不规则、凸凹不平,蟹足样改变,边界模糊,毛刺征,内部不均匀增强,环形或间隔增强是典型的恶性征象。形态规则,边缘清晰,无毛刺,内部均匀强化是典型良性表现[10]。但是良、恶性病灶的形态学表现存在交叉重叠,如病灶直径小、分化较好的浸润性导管癌、髓样癌、黏液腺癌等形态常较规则或原发灶极其隐蔽,其形态学常为良性表现。同样,脂肪坏死、慢性乳腺炎、导管内乳头状瘤等良性病灶形态不规则,其内信号不均匀或者与周围腺体分界欠清,常有恶性征象[10]。中、后期乳腺腺病内则有明显的纤维组织增生及硬化,其强化特点也可呈现无强化、显著强化、延时强化、快速强化等,此时MRI形态学表现与乳腺癌相似[11]。所以,单凭形态的某一指标预判病灶的性质会产生一定的假阴性和假阳性。
早期强化率反映了病灶内血管密度和血流灌注情况,通常恶性病灶早期强化率高是因为恶性组织的代谢率高,新生血管丰富,管壁通透性大,动-静脉瘘形成使对比剂快速渗入组织间隙,而良性病灶血管密度低,管壁较完整,对比剂达到峰值时间相对延迟,故表现为较低的早期强化率[12]。诚然,恶性病灶早期亦可出现新生血管较少,良性病灶也会诱发新生血管形成,其原理与恶性病灶血管生成相似,只是血管异生程度低,血管数量少。有研究显示早期强化率诊断乳腺恶性病灶敏感性高(88.9%),但特异性低(54.5%)[13],如乳腺纤维瘤、硬化性腺病等良性病灶,MRI图像也显示边界模糊,内部不均匀强化,早期强化率较高等恶性特征[14],容易造成误诊。
乳腺病灶动态增强MRI(DCE-MRI)中应用较为普遍的指标是TIC,通常将TIC分为三型:Ⅰ型又称渐近型,多提示良性病灶;Ⅱ型又称平台型,良、恶性病灶均有可能;Ⅲ型又称流出型,恶性的概率大[15]。本组93个良性病灶中有61个(65.59%)病灶符合Ⅰ型曲线,28个高危病灶中有16个(57.14%)符合Ⅱ型曲线,57个恶性病灶中有32个(56.14%)符合Ⅲ型曲线。由此提示大部分良性病灶表现为Ⅰ型曲线,Ⅱ型曲线高危病灶的可能性大,恶性病灶以Ⅲ型曲线多见。但血管化程度低的恶性病灶的TIC亦可表现为平台型或流入型曲线,生长活跃的良性病灶也会使增强幅度升高,伴有炎症反应的囊肿也常表现为环形增强[16]。TIC类型虽然被认为是鉴别乳腺病灶性质的有效指标之一,但不能单独作为鉴别病灶性质的唯一依据,需参照MRI检查中的其他信息。
基于以上分析,MRI单一指标区分乳腺病灶性质的效能有限,多个指标统筹考虑能够优势互补,可提高诊断的可靠性。Fisher判别分析法是一种有效的非线性特征提取和分类高级数理统计技术,其基本思想是利用给定的观察指标构建判别函数,寻找每个类的中心点,确定投影方向,使得同类样本尽可能地聚在一起,不同类样本尽可能地远离。将高维问题降为一维问题来解决,具有直观、明了等特点。本资料利用逐步判别分析法筛选出有统计学意义的指标是形态、边界、内部强化特征、早期强化率和TIC等,说明这些参数是较好区分病灶性质的指标组合。本研究从二维投影图可以清晰地看出每类的大部分样本聚集在相同的区域,但尚有少量样本偏离中心点落入其他区域(即交叉重叠现象)。回代法考核结果显示,病理分级的93个良性病灶,函数判为良性72个(敏感性77.42%),误判为高危19个、恶性2个;28个高危病灶函数判为高危17个(敏感性60.71%),误判为良性6个、恶性5个;57个恶性病灶函数判为恶性47个(敏感性82.46%),误判为高危5个、良性2个,总体正判率76.41%。一致性检验,Kappa=0.625。这些结果提示函数有一定预判病灶性质的能力。具体应用时可将样本的综合指标代入判别函数,计算出样本在二维坐标中的位置,然后把它归属到离中心点距离最近(或落入某个边际领域中)的那一类。当判别病灶为良性时,一般不需要活检,可定期随访。当判别病灶为高危时,建议活检,并短期追踪随访,而不是盲目切除或根治的过度处理。当判别病灶为恶性时必须进行活检;明确病灶为恶性时,行乳房根治术,并加以放疗或化疗[17]。
[1] 侯伟伟,于小平.乳腺叶状肿瘤的MRI 表现特征及病理对照研究[J].中南大学学报(医学版),2015,40(4):392-397.
[2] Silverstein MJ,Recht A,Lagios MD,et al.Special report:consensus conference III.Image-detected breast cancer:state-of-the-art diagnosis and treatment[J].J Am Coll Surg,2009,209(4):504-520.
[3] American College of Radiology(ACR).ACR BI-RADS-Magnetic Resonance Imaging[M].Reston:American College of Radiology,2003:17-45.
[4] Buadu LD,Murakami J,Murayama S,et al.Breast lesions:correlation of contrast medium enhancement patterns on MR images with histopathologic findings and tumor angiogenesis[J].1996,200(3):639-649.
[5] Kuhl CK,Schild HH,Morakkabati N.Dynamic bilateral contrast-enhanced MR imaging of the breast:trade-off between spatial and temporal resolution[J].Radiology,2005,236(3):789-800.
[6] B cker W.WHO classification of breast tumors and tumors of the female genital organs:pathology and genetics[J].Verh Dtsch Ges Pathol,2002,86:116-119.
[7] 程流泉,李席如,刘梅,等.多参数MRI的BI-RADS分类对乳腺病变的诊断效能[J].中国医学影像学杂志,2015,23(3):176-182.
[8] 鲁文力,欧阳祖彬,吕富荣,等.探讨3.0T MRI动态增强联合扩散加权成像对乳腺疾病的诊断价值[J].重庆医科大学学报,2014,39(10):1 484-1 489.
[9] 刘春玲,何晖,张金娥,等.乳腺导管原位癌的MRI表现及其与组织学核级别的相关性分析[J].临床放射学杂志,2012,31(1):29-33.
[10]张静,安宁豫,程流泉,等.动态增强磁共振成像结合扩散加权成像诊断乳腺病变的多参数分析[J].中国医学影像学杂志,2012,20(10):745-749.
[11]Iglesias A,Arias M,Santiago P,et al.Benign breast lesions that simulate malignancy:magnetic resonance imaging with radiologic-pathologic correlation[J].Curr Probl Diagn Radiol,2007,36(2):66-82.
[12]李敏,金真,李功杰,等.乳腺动态增强MRI参数与肿瘤血管的相关性及其鉴别诊断价值[J].磁共振成像,2010,1(1):36-42.
[13]杜国忠,王艳玲.Vibrant磁共振动态增强联合血管成像在乳腺良恶性病变诊断中的价值[J].临床放射学杂志,2015,34(12):1 899-1 902.
[14]张丽,韩立新,曹惠霞,等.Fischer’s评分结合MRI影像报告数据系统在乳腺病灶定性中的应用价值[J].临床放射学杂志,2013,32(10):1 432-1 435.
[15]王伟,李彩英,于晨,等.3.0T MRI乳腺动态增强曲线半定量分型方法的初步研究[J].临床放射学杂志,2014,33(8):1 161-1 164.
[16]Levrini G,Nicoli F,Borasi G,et al.MRI patterns of invasive lobular breast cancer[J].Eur J Radiol,2006,59(3):472.
[17]石宇文.乳腺核磁共振成像恶性肿瘤征象的META分析[J].中国CT和MRI杂志,2015,13(1):1-4,10.
(收稿 2016-07-20)
R814.4
B
1077-8991(2017)02-0022-04
