体细胞核移植技术的研究进展
2017-04-10付茂忠方东辉
王 巍,付茂忠,唐 慧,甘 佳,方东辉,王 淮,易 军
(四川省畜牧科学研究院,成都 610066)
综述与专论
体细胞核移植技术的研究进展
王 巍,付茂忠,唐 慧,甘 佳,方东辉,王 淮,易 军
(四川省畜牧科学研究院,成都 610066)
体细胞核移植转基因法效率高、成本低,目前已经成为构建转基因动物极为重要的方法。但该项技术的成功率较低,而且许多克隆动物会出现胎儿过度生长、出生前死亡、出生后生长异常等病理反应。文章以核移植生物学理论为基础,重点探讨了改进型核移植技术(OSM)在操作方法方面的改进研究,分析了影响核移植成功率的影响因素,为核移植技术的进一步完善提供了理论基础。
体细胞核移植;供体;受体;胚胎
经历了数十年的发展,体细胞核移植技术已经成为一种较成熟的转基因手段。1952年Briggs等[1]首次进行了细胞核移植试验并获得了成功,他们将青蛙囊胚期的细胞核移入去核卵中,经过正常卵裂发育成蝌蚪。由此开辟了高等动物发育生物学研究的新思路。1983年,McGrath等[2]利用显微操作技术与细胞融合技术成功培育出克隆小鼠。该技术基本避免了传统移核针穿刺细胞膜时造成的损伤,开创了全新的哺乳动物核移植方法。此后,该技术被大量应用于哺乳动物的胚胎克隆中。1997年,Wilmut等[3]利用绵羊乳腺细胞进行核移植试验,并成功地获得了世界上第一只体细胞克隆绵羊——多利(Doly)。这一成果证明高度分化的体细胞仍具有全能性,推动哺乳动物核移植技术迈向应用领域。基因修饰与核移植技术的结合为转基因动物的生产提供了更加高效快捷的途径,通过质粒转染的方法将某基因整合到细胞核中,再将此类细胞筛选出来,把这些细胞核转入到去核卵母细胞中,建立重组胚(见图1),产生的胚胎中所有的细胞均携带这种基因。但该项技术的成功率较低,而且许多克隆动物会表现为胎儿过度生长、出生前死亡、出生后生长异常等病理反应。为了探寻影响动物克隆效率的原因,研究者们不断寻找更为简便、有效的方法对细胞核移植技术的各个环节进行改善,并且加强对细胞核移植理论的关注度,在细胞分化、核质互作、核重编程以及与动物生长发育有关的基因在克隆动物中的表达情况等相关基础理论方面开展了大量的研究。
1 核移植的理论基础
核移植所依赖的理论基础是基于同一胚胎或细胞系的所有细胞核遗传信息都与受精卵相同,应该同样具有指导个体发育的全部潜能。随着胚胎的发育与细胞分化的发生,细胞核的某些基因组发生了变化,导致这些基因组不能再恢复到原有状态,从而使得细胞核失去了全能性(见图2)。目前的核移植程序可使初步分化的胚细胞核和已分化的体细胞核发生发育程序的去分化和发育程序再分化,使其恢复到受精时的状态以重新指导胚胎发育至正常个体[5]。为了使供体核能够完全的再程序化,关于重构胚中去甲基化和再甲基化的规律及其在不同物种之间的差别,成熟的卵母细胞质中生物活性分子的种类及其对于已分化的体细胞核再程序化的作用,核质互作的原理及其对重构胚发育的影响等方面的理论成为研究的重点。
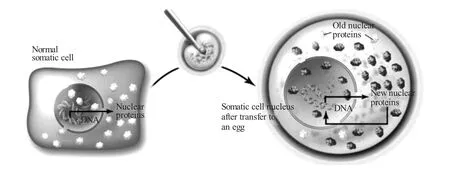
图1 克隆胚胎的构建过程[4]
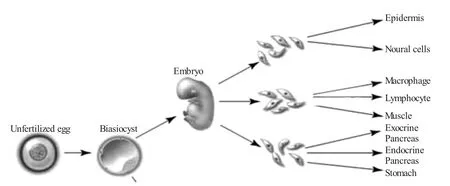
图2 胚胎细胞分化过程[4]
2 OSM核移植方法
通常在进行核移植时,影响核移植的主要因素为核重编程[6]、培养条件、卵母细胞的质量[7]以及去除卵母细胞染色质的技术[8]。传统的体细胞核移植(SCNT)的技术难点在去核时,清空处于减数分裂阶段卵母细胞的中心体蛋白和染色质,并使其接受来自供体细胞的不完全的有丝分裂结构,这使得大部分重构胚因不能由母源控制过渡到胚胎控制阶段而停止卵裂[9-11]。OSM一步微注射法在卵母细胞活化前将外源性有丝分裂细胞核注射到未激活的卵母细胞中,再用微操作仪去除减数分裂中期的卵母细胞核[12]。该技术避免了卵母胚胎暴露于Hoechst33342核染色剂和UV照射,减少了卵母胚胎的化学和物理损伤,其去除的卵母细胞胞质极少,保证了胞质内参与核重编程因子的效应[13],该技术操作步骤少、时间短、降低了卵母细胞在移核时活化的可能性,提高了核移植成功率。Zhou等[14]比较了电融合法和一步微操作法,发现一步微操作法获得的重组胚发育到囊胚的比例较电融合法高,且囊胚的发育更为正常。根据重组胚发育情况,不同核供体细胞优先选择的转核方法各不相同。羊膜上皮细胞作为核供体细胞时用电融合方法建立的重组胚发育情况较好,而胚胎成纤维细胞作核供体细胞时用一步微注射方法建立的重组胚发育情况更好[15]。
3 重构胚的激活
重构胚最常见的激活方法为点激活,该方法能够通过瞬间的高电压刺激,迫使细胞膜形成大量微孔,从而极大程度地增大了Ca2+的通透性,使细胞内Ca2+呈现脉冲式升高[16]。通过控制电刺激参数,产生正常受精过程Ca2+的节律性脉冲升高,可模拟出正常受精过程中一系列生理学和形态学变化,启动MII期卵母细胞继续成熟分裂,进入正常发育轨道。
乙醇激活法主要的作用通径为水解细胞膜上4,5-二磷酸磷脂酰肌醇(PIP2)产生1,4,5-三磷酸肌醇(IP3),诱发细胞内源Ca2+释放到细胞质中,提高了胞质内的Ca2+浓度,模拟受精过程中Ca2+的变化模式[17]。通常情况下,哺乳动物MII期卵母细胞在含有7%乙醇的培养液中培养5~7 min,就能激活卵母细胞并形成原核,直至发育到囊胚。
离子霉素(ionomycin)是一种近年来发现的高效Ca2+载体,已被广泛地应用于哺乳动物卵母细胞的激活[18]。离子霉素可以动员细胞内的Ca2+依次触发Ca2+内流。但离子霉素激活的卵母细胞无原核形成。
4 核移植的影响因素
4.1 供体与受体细胞周期的协调
供体与受体细胞的细胞周期发育同步化是影响核移植成败的一个重要因素。一个处于正常分裂周期的细胞包括分为间期与分裂期(M期)两个阶段,间期又分为3期,即G1期、S期与G2期(见图3)。从有丝分裂到DNA复制前的一段时期,称为G1期,此期主要合成RNA和核糖体为下阶段S期的DNA复制作好物质和能量的准备。S期为DNA合成期,在此期,除了合成DNA外,同时还要合成组蛋白。G2期为DNA合成后期,为M期做准备。M期则进行细胞分裂。此外,体细胞还可以暂时离开细胞周期,停止细胞分裂进入静止期(G0期)。G0期供体细胞处于细胞的静止期,移入卵细胞质后能够与卵母细胞的DNA复制同步,减少了核移植细胞发育过程中染色体畸变的可能性。同时G0期细胞的染色质结构更容易发生调整和改变,以适应基因表达程序重编的需要,并且G0期细胞的染色质由于浓缩而使原来的转录因子脱落,在去浓缩时卵母细胞中控制基因表达的胞质信号分子更容易与供体细胞DNA结合。另外,G0期细胞含有二倍体的染色体,G0期核重构胚胎的染色体倍性能维持正常。因此诞生的多种克隆动物其供体细胞都在体外进行培养,使其进入G0期。但是,1998年Cibelli等[19]使用牛胎儿非静止期成纤维细胞进行核移植并获得了成功,表明让细胞处于静止期并不是必须的。1998年,Wakayama等[20]用处于G0/G1期的鼠卵丘细胞也获得了成功。Kasinathan等[21-22]通过研究发现,G0期细胞不如G1期作供体效果好。目前,关于G0期对供体细胞核移植的必要性仍不能给予有利证明。
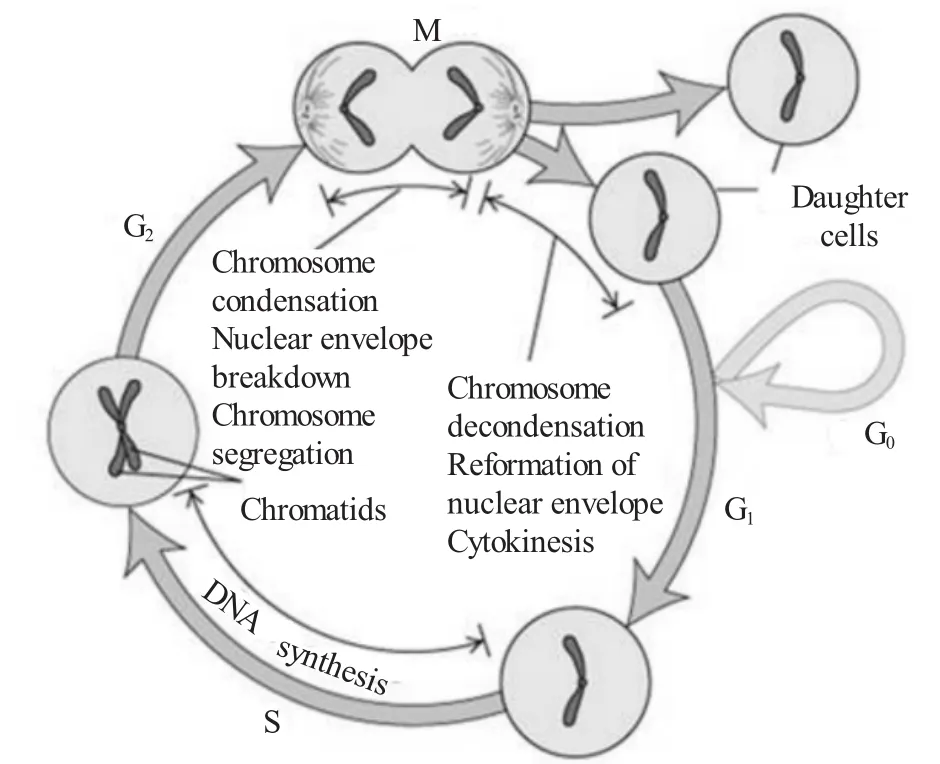
图3 细胞分裂周期
在核移植研究中普遍采用去核的MⅡ期卵母细胞作为受体胞质,从细胞周期角度来看,MⅡ期卵母细胞含有高水平的M期促进因子(MPF)。该细胞因子主要由周期素B(cyclin)和p34cdc2组成的复合物。MPF作为一个蛋白激酶,MPF的活性受自身磷酸化/去磷酸化的状态所调控,其含量水平在细胞周期和成熟的不同阶段也会发生变化。在所有动物中,MPF水平在G2期过渡到M期时升高,而在后期和末期降低。MPF水平在第二次减数分裂中期显著增高,使成熟的卵母细胞静止于MⅡ期,在受精或卵细胞激活时,MPF活性急剧下降,导致细胞减数分裂,第二极体排出。高水平的MPF,可以诱导移入核的核膜破裂和早熟染色体凝集的发生,从而保证供体核DNA的正确复制和重编程。Manandhar等[23]通过比较体细胞分别移入去核的MⅠ和MⅡ期卵细胞后形成的猪重构胚胎在体外的发育能力,发现MⅠ期卵细胞同样可以作为核移植的受体,这可能与MⅠ期是卵细胞成熟过程中MPF的高峰期有关。然而欲使核移植后细胞正常活动,核移植过后必须降低MPF水平,否则染色体损坏或异倍体化率将会很高[24-25]。协调供体细胞与受体细胞的周期对维持重构胚胎的正确染色体倍数和阻止DNA损伤是必要的。不同周期阶段的供体与受体细胞组合能够阻止DNA损坏以及不协调复制导致的假原核现象。另外,研究发现用M期卵细胞能促进供体遗传物质的重编程,因为核膜破裂,早期染色体凝聚的出现,将供体染色质暴露在与早期发育有关的受体细胞质因子之中[26]。
4.2 卵母细胞和胚胎的质量
卵母细胞是核供体细胞重编程的场所,为克隆胚胎发育提供了充足的物质基础,它的来源以及成熟质量直接影响到克隆效率的高低。近年来,为提高卵母细胞与克隆胚胎的质量,研究人员进行了大量的尝试。有研究表明,在克隆猪胚胎的培养中添加一定剂量的维生素C可以显著提高克隆胚的质量,一些干细胞因子(Oct4、Klfl4、Sox2)的mRNA表达量明显上升,其表达量可达到IVF胚胎水平,使用维他命C处理过的胚胎进行胚移后,其产仔率明显升高[27]。使用CBHA(一种去组蛋白乙酰化抑制剂)处理小鼠的克隆胚胎后,胚胎克隆效率明显提高,并且还源于克隆胚胎的干细胞质量也明显提升[28]。
4.3 胚胎移植方法与动物后期管理
根据不同动物的特点选择配套的胚胎移植方法,通常猪、羊选择腹腔镜微创手术方法进行移植,移植的部位为子宫和输卵管;牛、马选择非手术的方式进行胚胎移植,移植部位为子宫。妊娠的受体动物的后期管理非常重要,因为转基因克隆动物会存在很大比例的发育异常,极有可能导致无故流产、胎儿巨大难产、出生动物存活率低等现象。
[1]Briggs R,King T J Proc.Transplantation of living nuclei from blastula cells into enucleated frogs’eggs[J].Natl Acad Sci USA,1952,38:455-463.
[2]McGrath J,Solter D.Structure and organization of the human Ki-ras proto-oncogeneandarelated processed pseudogene[J].Science,1983,220:1300-1302.
[3]Wilmut I,Beaujean N.Somatic cell nuclear transfer[J].Nature,2002,419:583-585.
[4]J B Gurdon,D A Melton.Nuclear reprogramming in cells[J].Science,2008,322(5909):1811.
[5]Welts D N,Mislca P M,Day A M J,et al.Production of cloned lambs from an established embryonic cell line:a comparison between in vivo and in vitro-matured cytoplasts[J].Biol of Reprod,1997,57(2):385-393.
[6]Mitalipov S M,Yeoman R R,Nusser K D,et al.Rhesus monkey embryos produced by nuclear transfer from embryonic blastomeres or somatic cells[J].Biol Reprod,2002,66:1367-1373.
[7]Gao S,McGarry M,Priddle H,et al.Effects of donor oocytes and culture conditions on development of cloned mice embryos[J].Mol Reprod Dev,2003,66:126-133.
[8]Wakayama T,Yanagimachi R.Mouse cloning with nucleus donor cells ofdifferent age and type[J].Mol Reprod Dev,2001,58:376-383.
[9]Simerly C,Dominko T,Navara C,et al.Molecular correlates of primate nuclear transfer failures[J].Science,2003,300:297.
[10]Simerly C,Navara C,Hwan Hyun S,et al.Embryogenesis and blastocyst development after somatic cell nuclear transfer in nonhuman primates:overcoming defects caused by meiotic spindle extraction[J]. DevBiol,2004,276:237-252.
[11]Ng S C,Chen N,Yip W Y,et al.The first cell cycle after transfer of somatic cell nuclei in a non-human primate[J].Development,2004,131:2475-2484.
[12]Zhou Q,Renard J P,Friec G L,et a1.Generation of fertile cloned rats byregulatingocyte activation[J].Science,302(5648):l179.
[13]Wolf D P.Assisted reproductive technologies in rhesus macaques[J]. Reprod Biol Endocrinol,2004,2:37.
[14]Zhou Q,YangS H,DingC H,et a1.A comparative approach tosomatic cel1nucleartransferintherhesusmonkey[J].HumReprod,2006,21(10):2564-2571.
[15]Okahara Narita J,Tsuchiya H,Takada T,et a1.Cloned blastocysts produced by nuclear transfer from somatic ceils in cynomolgus monkeys(Macaca fascicularis)[J].Primates,2007,48(3):232-240.
[16]Styliani M,Alexander M,Rudolf J.Somatic cell nuclear transplantation and derivation ofembryonic stemcells in the mouse[J].Methods,2008,45:101-114.
[17]Devreker F,Harey K.Effects of glutamine and taurine on preimplantation development and cleavage of mouse embryos in vitro[J]. BiologyofReproduction,1997,57:921-928.
[18]Campbell K D,Reed W A,White K L.Ability of integrins to mediate fertilization,intracellular calcium release,and parthenogenetic development in bovine oocytes[J].Biology of Reproduction,2000,62(6):1702-1709.
[19]Cibelli J B,Stice SL,Golucke P J,et a1.Cloned transgenic calyes produced from nonquiescent fetal fibroblasts[J].Science,1998,280:l256-1258.
[20]Wakayama T,Perry A C,Zuccotti M,et a1.Full term development of mice from enucleated oocytes injected with cumulus cell nuclei[J]. Nature,1998,394:369-374.
[21]Kasinathan P,Knott J G,Moreira P N,et a1.Effect of fibroblast donor cell age and cell cycle on development of bovine nuclear transfer embryos in vitro[J].Biol Reprod,2001,64(5):1487-1490.
[22]Kasinathan P,Knott J G,Wang Z,et a1.Production of calves from G1 fibroblasts[J].Nat Biotech,2001,19(12):1176-1178.
[23]Manandhar G,Simerly C,Schatten G.Centrosome reduction during mammalian spermiogenesis[J].Curr Top DevBiol,2000,49:343-363.
[24]Campbell K H,Loi P,Otaegui P J,et a1.Cell cycle co-ordination in embryocloningbynuclear transfer[J].Rev Reprod,1996,1:40-46.
[25]Campbe U K H.Nuclear equivalence,nuclear transfer and the cell cycle[J].Cloning,1999,1:3-15.
[26]Polejaeva I A,Chen S H,Vaught T D,et a1.Cloned pigs produced by nucleartransferfromadultsomaticcells[J].Nature,2000,407:86-90.
[27]HuangY,TangX,Xie W,et al.Vitamin Cenhances in vitro and in vivo development of porcine somatic cell nuclear transfer embryos[J]. BiochemBiophys Res Comun,2011,411(2):397-401.
[28]Dai X,HaoJ.Somatic nucleus reprogrammingis significantlyimproved by m-carboxycinnamic acid bishydroxamide,a histone deacetylase inhibitor[J].J Biol Chem,2010,285(40):31002-31010.
Progress in Somatic Cell Nuclear Transfer
WangWei,Fu Maozhong,Yi Jun,et al
(Sichuan Animal Science Academy,Chengdu 610066,China)
The somatic cell nuclear transfer(SCNT)has been widely applied in production of transgenic animal due to the high performance and the lowcost.However,cloningbysomatic cell nuclear transfer(SCNT)is still inefficient.This paper summarized some important aspects ofOSM,and alsoanalyzed the factor that related tothe OSM.
somatic cell nuclear transfer;donor cell;receptor cell;embryo
Q813.7
A
2095-3887(2017)02-0044-04
10.3969/j.issn.2095-3887.2017.02.015
2017-01-17
四川省基本科研项目(2015JY0181);“十二五”农村领域国家科技计划课题(2015BAD03B04-3);四川省科技支撑项目(2015NZ0020);四川省育种攻关项目(2016NYZ0050);四川省公益类科研院所基本科研项目(SASA2014A05)
王巍(1984-),男,蒙古族,副研究员,博士。
易军(1971-),男,研究员,本科。研究方向:动物营养与饲料加工。
