共生菌系TSH06连续发酵生产丁醇
2017-04-07李冬月李祥龙林樟楠刘宏娟张建安
李冬月,李祥龙,林樟楠,刘宏娟,张建安
(1清华大学核能与新能源技术研究院,北京 100084;2昆明理工大学国土资源工程学院,云南 昆明 650093)
共生菌系TSH06连续发酵生产丁醇
李冬月1,2,李祥龙2,林樟楠1,刘宏娟1,张建安1
(1清华大学核能与新能源技术研究院,北京 100084;2昆明理工大学国土资源工程学院,云南 昆明 650093)
传统的产丁醇生产菌均为严格厌氧,本实验室分离出一株兼性厌氧共生菌系TSH06,可在微氧条件下发酵生产丁醇。本文研究了共生菌系TSH06微氧条件下的丁醇连续发酵,考察了稀释率对TSH06细胞生长及丁醇合成的影响。结果表明,低稀释率有利于丁醇的生成,高稀释率有利于酸的积累,丁醇浓度随着稀释率的增大而减小,而生产强度随稀释率的增大而增大。当稀释率大于0.2h–1时,生产强度呈下降趋势。最优化的稀释率为0.2h–1,丁醇生产强度可达1.06g/(L·h)。研究结果可为微氧条件下丁醇连续发酵的进一步优化提供理论依据。
丁醇;微氧发酵;连续发酵;稀释率;生产强度
近年来,随着石油资源的日渐枯竭和环境问题的持续加剧,新能源的研究越来越受到重视,生物质能源作为可持续发展的可再生能源,已成为研究和关注的重点[1-2]。丁醇是优良的有机溶剂和重要的化工原料,广泛应用于化工、医药、塑料、油漆、有机合成等行业[3-5]。作为生物能源与传统的生物乙醇相比,丁醇具有和汽油相当的热值和辛烷值、较低的管道腐蚀性和挥发性,能与汽油以任意比混合、蒸汽压低和安全性高等优良特性[6-8]。因此生物丁醇被认为是一种非常具有研究潜力的新型生物质能源。传统丁醇发酵通常采用批次发酵,由于产物抑制,往往存在终产物浓度低、生产强度低等问题,严重制约了生物丁醇的生产。连续发酵方式与其他发酵方式相比缩短了发酵时间,提高了设备利用率和生产强度,便于自动化控制。目前我国的丙酮丁醇发酵工厂基本上采用的是连续发酵方式[9]。
稀释率是连续发酵工艺过程的一个重要指标,稀释率越低,底物在发酵罐中停留的时间越长,能更长时间与菌体接触,菌体细胞更容易生长,生产强度较低;稀释率越高,底物与菌体接触的时间越短,菌体细胞容易被洗出,生产强度会增大。ANDRADE等[10]利用Clostridium acetobutylicumATCC 824以葡萄糖和乳酸为底物,稀释率为0.05h–1时,丁醇产量为8.6g/L,丁醇的生产强度为0.42g/(L·h)。TASHIRO等[11]利用C. saccharoperbutylacetonicumN1-4以葡萄糖为底物,稀释率为0.11h–1时,丁醇产量为6.51g/L,丁醇的生产强度为0.72g/(L·h),稀释率从0.11h–1增大到0.20h–1,生产强度提高了72.2%,达到1.24g/(L·h)。ZHENG等[12]利用C. saccharoperbutylacetonicumN1-4以木糖为底物,稀释率从0.14h–1提高到0.26h–1时,丁醇生产强度从0.235g/(L·h)提高到0.529g/(L·h)。
细胞固定化技术能够提高细胞密度,增强发酵稳定性和提高溶剂耐受性,提高丁醇生产强度[13]。CHANG等[14]采用甘蔗渣作为固定化材料,利用C. acetobutyliumABE 1201以玉米秸秆汁为底物进行连续发酵,稀释率为0.16h–1时,丁醇生产强度达到1.2g/(L·h)。当采用甜高粱甘蔗渣作为固定化载体,以葡萄糖为底物进行连续发酵,稀释率为0.08h–1时,乙醇-丙酮-丁醇(ABE)产量和生产强度分别为16.5g/L和1.32g/(L·h)[15]。SURVASE等[16]采用木浆纤维素固定床反应器,利用C. acetobutylicumDSM 792以葡萄糖为底物,稀释率为0.22h–1时,丁醇的生产强度达到1.79g/(L·h)。
由于目前报道的丁醇生产菌均为严格厌氧,因此,现有的连续发酵操作均在严格厌氧条件下进行。本实验室分离到一株共生菌系TSH06,由厌氧梭菌C. acetobutylicumTSH1和兼性厌氧杆菌B. cereusTSH1组成。可以在微氧条件下进行发酵生产丁醇,无需严格厌氧,简化了实验操作,节约了厌氧设备的投入。
本文以共生菌系TSH06为出发菌株,采用葡萄糖为底物进行单级连续发酵,考察了稀释率对细胞生长及丁醇合成的影响。其研究结果有助于深入了解共生菌丁醇代谢机制,并对微氧条件下进一步的丁醇连续发酵工艺优化提供理论依据。
1 材料与方法
1.1 菌种及培养基
共生菌系TSH06为本实验室保藏菌种。
LB培养基(g/L):氯化钠10,酵母浸粉1.0,蛋白胨10,121℃灭菌15 min。
玉米培养基:质量分数为6%的玉米糊,121℃灭菌15min。
RCM培养基(g/L):酵母浸粉3.0,牛肉膏10,蛋白胨10,葡萄糖5.0,可溶性淀粉1.0,氯化钠5.0,醋酸钠3.0,半胱氨酸盐酸盐0.5,琼脂2.0,pH 8.5。
P2半合成培养基(g/L):葡萄糖60,酵母浸粉1.0,115℃灭菌15 min。
缓冲液组分(g/L):K2HPO450,K2HPO450,CH3COONH4220,过滤灭菌。
微量元素液组分(g/L):MgSO4·7H2O 20,MnSO4·H2O 1.0,NaCl 1.0,FeSO4·7H2O 1.0,对甲基苯甲酸 0.1,维生素 0.1,生物素 0.0001,过滤灭菌。
在发酵接种前,以1%的比例将缓冲液和微量元素液加入到P2半合成培养基中[17]。
1.2 实验方法
菌种活化:将甘油管保藏的TSH06接入到15mL 6%的玉米培养基中,常规培养箱中37℃静置培养24~36h。
种子培养:将充分活化的菌种以体积比7%的接种量接种到60mL P2培养基中,37℃静置培养24h。
批式发酵:2L发酵罐,P2培养基装液量为1L,接种量为7%,37℃静置发酵。
连续发酵:2L发酵罐(BIOTECH,上海)装液量为1L。发酵罐中丁醇浓度为6~8 g/L时开始连续发酵,发酵体积维持在1L左右。考察稀释率(D)对连续发酵的影响,温度37℃,转速为50r/min。
1.3 分析方法
菌体浓度:用UV 759S紫外可见分光光度计在600 nm处测定其吸光值OD600。
葡萄糖浓度:使用SBA-40D生物传感分析仪(山东省科学院生物研究所)测定。
发酵产物测定:乙醇、丙酮、丁醇(ABE)组分浓度采用气相色谱(GC)进行定量测定,以异丁醇为内标物,色谱柱为KB-5MS,25m×0.53m×1.00μm,检测器为FID,进样温度240℃,检测温度为260℃,柱温80℃。载气为氮气,流速为2.5mL/L,进样量为1μL。根据标准曲线和进样量计算发酵液中溶剂浓度[18]。
乙酸、丁酸和葡萄糖浓度采用高效液相色谱(岛津公司LC-20A)测定。色谱柱型号为AminexHPX-87柱(Bio-Red美国),柱温65℃,流动相0.005 mol/L H2SO4,流速为0.8mL/min,检测器型号为RID-10A,进样量为30uL。
2 结果与讨论
2.1 共生菌株TSH06生理代谢特性
首先研究了共生菌系TSH06生理代谢特性。分别比较了微氧和厌氧条件下,B. cereusTSH1、C. acetobutylicumTSH1、TSH06(B. cereusTSH1+C. acetobutylicumTSH1)在P2培养基、玉米培养基的细胞生长和丁醇合成情况。结果如表1和表2所示。由表1可知:共生菌系TSH06不仅在厌氧条件下生长,也可以在微氧条件下生长,C. acetobutylicumTSH1只能在严格厌氧条件下生长。
进而考查了共生菌株TSH06丁醇合成性能。分别比较了TSH1、B. cereusTSH1、TSH06微氧条件下合成丁醇的性能,初始糖浓度为22g/L,37℃静置发酵36h。其中C. acetobutylicumTSH1在厌氧条件下培养作为对照。结果如表2所示。由表2可知,在微氧条件下,B. cereusTSH1几乎不能合成丁醇,而TSH06在微氧条件下可以合成丁醇。发酵36h,丁醇浓度达到5.15g/L,这与C. acetobutylicumTSH1在厌氧条件下的丁醇发酵水平相当。TSH06丁醇得率和生产强度分别为0.22 g/g和0.14 g/(L·h),这与也C. acetobutylicumTSH1在厌氧条件下的丁醇发酵参数接近。
通过对菌株的生理特性和发酵特性对比可知,在相同发酵条件下,共生菌系TSH06可在厌氧和微氧条件下生长并发酵生产丁醇,C. acetobutylicumTSH1只能在严格厌氧条件下生长并合成丁醇。微氧条件下发酵生产丁醇无需厌氧操作,简化了实验操作,也节省了厌氧设备的投入。
2.2 共生菌TSH06批式发酵特性
TSH06不仅可以在厌氧条件下生长,也可以在微氧条件下生长,这不同于传统的严格厌氧发酵[19-20]。在2L发酵罐中考察了微氧条件下TSH06细胞生长及丁醇合成情况,初始糖浓度为60.3g/L,结果如图1所示。

表1 共生菌株系TSH06的生理特性

表2 微氧条件下共生菌系TSH06的发酵特性
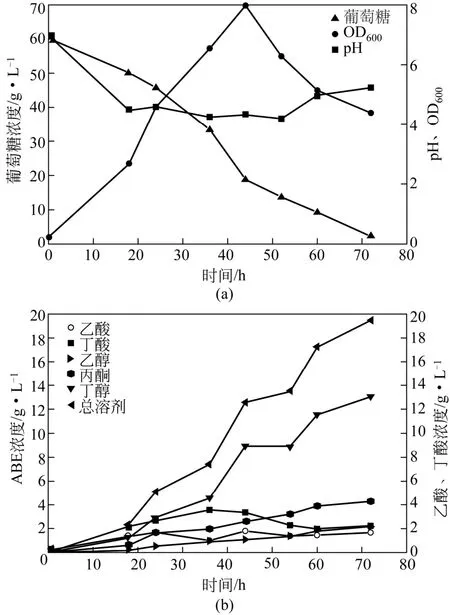
图1 共生菌TSH06批式发酵生产丁醇
由图1中可知,在微氧条件下,TSH06细胞可以正常生长并合成丁醇。随着葡萄糖的不断消耗,在12h时开始产生有机酸,同时菌体浓度逐渐上升,溶液的pH逐渐下降,此时主要代谢产物为乙酸和丁酸。发酵20h后,进入产溶剂期,溶剂乙醇、丙酮、丁醇产量迅速增加。OD600在44h达到其最大值为7.98,发酵结束后乙酸和丁酸的浓度分别为1.21g/L和2.24g/L,ABE溶剂的浓度达到19.5g/L,其中,丙酮4.21g/L、乙醇2.13g/L、丁醇13.0g/L,丁醇得率和生产强度分别达到0.22g/g和0.19g/(L·h)。
2.3 不同稀释率对连续发酵的影响
在连续发酵过程中,稀释率是影响连续发酵工艺过程的重要参数,稀释率越低,底物在发酵罐中停留的时间越多,能更长时间与菌体接触,丁醇浓度更高,但生产强度较低;稀释率越高,底物与菌体接触的时间越短,丁醇的浓度将下降,但丁醇生产强度越高[21]。本文采用单级连续发酵,考察了3个不同稀释率0.05h–1、0.2h–1、0.25h–1下连续发酵过程中的细胞生长、底物消耗和产物合成情况,结果如图2、图3所示。

图2 不同稀释率对TSH06细胞生长、底物消耗及发酵pH的影响

图3 不同稀释率对TSH06产物合成的影响
初糖浓度为60g/L,初始pH为5.98,当稀释率为0.05h–1时,溶剂产量和丁醇产量分别为14.5g/L和 9.0g/L,丁醇生产强度为0.45g/(L·h),是批式发酵生产强度的2.37倍。随着稀释率的增大,菌体浓度变化不大,丁醇浓度下降,丁醇生产强度增大。稀释率为0.2h–1时,丁醇生产强度达到1.06g/(L·h),ABE总溶剂和丁醇浓度分别为10.2g/L和5.3g/L,是批式发酵生产强度的5.58倍,与0.05h–1相比,丁醇生产强度提高了135.6%。当稀释率增大到0.25h–1时,丁醇生产强度达到0.9g/(L·h),ABE总溶剂和丁醇浓度分别为5.8g/L和3.6g/L,是批式发酵生产强度的4.74倍,与0.05h–1相比,丁醇生产强度提高了100%。
在3个不同稀释率(0.05h–1、0.2h–1、0.25h–1)下,菌体浓度、pH没有出现明显变化。OD600平均值分别为5.5、5.8和6.0,pH始终维持在4.0~5.0之间。在稀释率为0.2h–1时,丁醇生产强度达到最大,为1.06g/(L·h)。
目前已经报道的丁醇连续发酵均严格厌氧,ZHENG等[12]在稀释率为0.14h–1时,丁醇产量为1.68g/L,丁醇的生产强度为0.235g/(L·h)。TASHIRO等[10]在稀释率为0.20h–1时,丁醇产量为6.21g/L,丁醇的生产强度为1.24g/(L·h)。本实验涉及的共生菌TSH06在微氧条件下丁醇生产强度与文献报道相当。而在微氧条件下发酵生产丁醇无需厌氧操作,节省了厌氧设备的投入,简化了实验操作。
3 结论
本文研究了共生菌TSH06微氧条件下连续发酵生产丁醇的特性。共生菌TSH06不同于传统的严格厌氧菌,可以在微氧条件下发酵生产丁醇。微氧批式发酵丁醇浓度和生产强度分别达到13.04g/L和0.19g/(L·h)。考察了稀释率对TSH06丁醇合成的影响。稀释率为0.20h–1时,丁醇生产强度为达到最大1.06g/(L·h),是批式发酵生产强度的5.58倍,与稀释率0.05h–1时发酵参数相比较,丁醇生产强度提高了47.2%。共生菌TSH06微氧条件下发酵生产丁醇无需厌氧操作,节省了厌氧设备的投入,简化了实验操作。
[1]刘力强,李丽萍,李立强,等. 生物丁醇燃料产业化制造中的问题及发展趋势[J]. 生物产业技术,2008,(5):36-44. LI L Q,LI L P,LI L Q,et al. Problems and development tendency of biological butanol fuel industry manufacture[J]. Biotechnology & Business,2008(5):36-44.
[2]闫永亮,刘宏娟,张建安. 代谢工程在生物丁醇生产中的应用及研究进展[J]. 现代化工,2012,32(4):25-29. YAN Y L,LIU H J,ZHANG J A. Application and research progress of metabolic engineering in butanol production[J]. Modern Chemical Industry,2012,32(4):25-29.
[3]靳孝庆,王桂兰,何冰芳,等.丙酮丁醇发酵的研究进展及其高产策略[J].化工进展,2007,26(12):1727-1732. JIN X Q,WANG G L,HE B F,et al. Research progress and high yield strategy of acetone-butanol fermentation[J]. Chemical Industry and Engineering Progress,2007,26(12):1727-1732.
[4]陈春燕,张俊青,崔海娣,等.PDMS膜生物反应器封闭循环连续发酵生产ABE[J]. 高校化学工程学报,2013,27(3):465-475. CHEN C Y,ZHANG J Q,CUI H D,et al. ABE Fermentation in a continuous and closed-circulating fermentation system with PDMS membrane bioreactor[J]. Journal of Chemical Engineering of Chinese Universities,2013,27(3):465-475.
[5]华连滩,王义强,彭牡丹,等.生物发酵产丁醇研究进展[J].微生物学通报,2014,41(1):146-155. HUA L T,WANG Y Q,PENG M D,et al. Butanol fermentation production[J]. Microbiology China,2014,41(1):146−155
[6]黄格省,李振宇,张兰波,等.生物丁醇的性能优势及技术进展[J].石化技术与应用,2012,30(3):254-259. HUANG G S,LI Z Y,ZHANG L B,et al. Performance advantage and technology progress in biobutanol[J]. Petrochemical Technology& Application,2012,30(3):254-259.
[7]顾阳,蒋宇,吴辉,等.生物丁醇制造技术现状和展望[J]. 生物工程学报,2010,26(7):914-923. GU Y,JIANG Y,WU H,et al. Current status and prospects of biobutanol manufacturing technology[J]. Chinese Journal of Biotechnology,2010,26(7):914-923.
[8]段晓瑞,王根宇,刘宏娟,等.兼性厌氧芽孢杆菌TSH1丁醇代谢途径中关键酶的检测[J].生物工程学报,2013,29(5):620-629 DUAN X R,WANG G Y,LIU H J,et al. Key enzymes in butanol fermentation by a facultative anaerobeBacillussp. TSH1[J]. China Journal of Biotechnology,2013,29(5):620-629.
[9]NI Y,SUN Z H. Recent progress on Industrial fermentative production of acetone-butanol-ethanol byClostridium acetobutylicumin China[J]. Applied Microbiology Biotechnology,2009,83(3):415-423.
[10]ANDRADE J C,VASCONCELOS I. Continuous cultures ofClostridium acetobutylicum:culture stability and low-grade glycerol utilization[J]. Biotechnol. Lett.,2003,25(2):121-125.
[11]TASHIRO Y,TAKEDA K,KOBAYASHI G,et al. High production of acetone-butanol-ethanol with high cell density culture by cell-recycling and bleeding[J]. Journal of Biotechnology,2005,120(2):197-206.
[12]ZHENG J,TASHIRO Y,YOSHIDA T,et al. Continuous butanol fermentation from xylose with high cell density by cell recycling system[J]. Bioresource Technology,2013,129(2):360-365.
[13]CHEN Y,ZHOU T,LIU D,et al. Production of butanol from glucose and xylose with immobilized cells ofClostridium acetbutylicun[J]. Biotechnology and Bioprocess Engineering,2013,18(2):234-241.
[14]CHANG Z,CAI D,WANG Y,et al. Effective multiple stages continuous acetone-butanol-ethanol fermentation by immobilized bioreactors:making full use of fresh corn stalk[J]. Bioresource Technology,2016,205:82-89.
[15]CHANG Z,CAI D,WANG C,et al. Sweet sorghum bagasse as an immobilized carrier for ABE fermentation by usingClostridium acetobutylicumABE 1201[J]. RSC Advances,2014,4(42):21819-21825.
[16]SURVASE S A,HEININGEN A V,GRANSTRÖM T. Continuous bio-catalytic conversion of sugar mixture to acetone–butanol–ethanol by immobilizedClostridium acetobutylicumDSM 792[J]. Applied Microbiology & Biotechnology,2012,93(6):2309-2316.
[17]VIIKILÄ M,WALLENIUS J,OJAMO H,et al. Impact of varying lignocellulosic sugars on continuous solvent production in an immobilized column reactor[J]. Bioresource Technology,2013,147(11):299-306.
[18]PAREKH M,FORMANEK J,BLASCHEK HP. Development of a cost-effective glucose-corn steep medium for production of butanol byClostridium beijerinckii[J]. Journal of Industrial Microbiology & Biotechnology,1998,21(4):187-191.
[19]WANG G Y,WU P F,LIU Y,et al. Isolation and characterization of non-anaerobic butanol-producing symbiotic system TSH06[J]. Applied Microbiology & Biotechnology,2015,99(20):8803-8813.
[20]WU P F,WANG G Y,WANG G H,et al. Butanol production under microaerobic conditions with a symbiotic system ofClostridium AcetobutylicumandBacillus cereus[J]. Mcrobial Cell Factories,2016,15(1):1-11
[21]夏子义,倪晔,孙志浩,等.利用Clostridium saccharobutylicumDSM 13864连续发酵生产丁醇[J].化工进展,2013,32(1):156-160. XIA Z Y,NI Y,SUN Z H,et al. Continuous butanol fermentation byClostridium saccharobutylicumDSM 13864[J]. Chemical Industry and Engineering Progress,2013,32(1):156-160.
The continuous butanol fermentation of symbiotic system TSH06
LI Dongyue1,2,LI Xianglong2,LIN Zhangnan1,LIU Hongjuan1,ZHANG Jian’an1
(1Institute of Nuclear and New Energy Technology,Tsinghua University,Beijing 100084,China;2Faculty of Land Resources Engineering,Kunming University of Science and Technology,Kunming 650093,Yunnan,China)
The traditional butanol producing strain was strict anaerobic bacteria. A facultative anaerobic symbiotic system TSH06 was isolated in our lab,which could produce butanol under micro-aerobic conditions. This work studied the continuous butanol fermentation of TSH06 under the micro-aerobic condition. The effect of dilution rate on the cell growth and butanol production was investigeted. The test results indicated that the lower dilution rate enhanced the butanol production and the higher dilution rate was beneficial for the acid accumulation. However,the butanol productivity decreased when the dilution rate was higher than 0.2h–1. The optimized dilution rate was 0.2h–1with the butanol productivity of 1.06 g/(L·h). The results provided the theoretical basis for the further optimization of butanol continuous fermentation under micro-aerobic conditions.
butanol;micro-aerobic fermentation;continuous fermentation;dilution rate;productivity
Q815
A
1000–6613(2017)04–1418–06
10.16085/j.issn.1000-6613.2017.04.035
2016-09-21;修改稿日期:2016-10-20。
工业生物催化教育部重点实验室(清华大学)开放基金(2015301)及工业生物催化教育部重点实验室 (清华大学) 开放基金(2015302)项目。
李冬月(1989—),男,硕士研究生。联系人:张建安,副研究员。E-mail:zhangja@tsinghua.edu.cn。刘宏娟,副研究员。E-mail:liuhongjuan@tsinghua.edu.cn。
