结直肠癌周围淋巴结CK20蛋白检测的临床应用研究
2017-04-06王佳雷李霖
王佳雷,李霖
(南宁市第二人民医院胃肠外科,广西 南宁 530031)
结直肠癌周围淋巴结CK20蛋白检测的临床应用研究
王佳雷,李霖
(南宁市第二人民医院胃肠外科,广西 南宁 530031)
目的:探讨免疫组化(IHC)检测结直肠癌区域淋巴结微转移的细胞角蛋白20(CK20)对结直肠癌术后临床分期、预后判断和治疗干预的可行性和临床应用价值。方法:选取40例常规HE病理检查淋巴结转移阴性的结直肠癌患者为研究对象,术前抽取外周血行循环肿瘤细胞(CTCs)测定;术中、后沿亚甲蓝染剂标识的区域淋巴结按4站次淋巴结分别摘除、放置并标记,应用IHC技术检测淋巴结中CK20,统计淋巴结微转移患者的阳性例数及阳性率及其在各不同站次的分布情况,并对HE、CTC和IHC CK20方法检测的结果进行比较。结果:淋巴结CK20测定与HE染色法的淋巴结微转移阳性检出率间差异有统计学意义(P<0.01);不同站次间淋巴结微转移阳性检出率存在统计学差异(P<0.01或P<0.05);全组CK20检测有存在淋巴结微转移11例(11/40,27.5%);7例患者TNM分期提高,HE染色法重新分期率为17.5%(7/40)。全组CTC检测显现阳性7例,阳性表达率为17.5%(7/40),其中6例对应于IHC淋巴结CK20(+)患者,1例为IHC淋巴结CK20(-)患者,且CTCs细胞学分型表达与结直肠癌肿瘤分化程度、肿瘤浸润深度呈正相关性。结论:CK20免疫组化法是检测淋巴结微转移可靠而敏感的方法,结合亚甲蓝染色法显影淋巴结可简便、快速地发现微转移灶,与CTC检测联用可达互补效能,进一步提高微转移检出率,减少假阴性发生。
结直肠癌; 细胞角蛋白20; 淋巴结; 循环肿瘤细胞; 微转移
结直肠癌是消化道最为常见的恶性肿瘤之一,随着外科手术和辅助手段不断改进,患者总体预后得到很大改善,但目前困扰结直肠癌临床治疗的主要问题仍是肿瘤的复发和转移[1]。研究[2]表明,众多结直肠癌患者术前已发生不同程度的肿瘤微转移,淋巴结转移是其最主要的转移途径,结直肠癌淋巴结转移与否是临床最为重要的诊断治疗参考指标。然而传统组织学检查对淋巴结转移,尤其是微转移的诊断有很大的局限性。本研究通过免疫组织化学法(IHC),对结直肠癌区域淋巴结细胞角蛋白20(CK20)进行测定,并结合CanpatrolTM CTC检测方法检测外周血循环肿瘤细胞(CTCs),探讨这些因子的表达与结直肠癌复发和转移之间的关系,为提高临床分期的准确性,早期预后判断和治疗干预提供理论和临床依据。
1 资料与方法
1.1 一般资料
选取2010年4月至2014年12月收治40例常规HE病理检查淋巴结转移阴性的结直肠癌患者(术后筛选)为研究对象,均符合结直肠癌诊断标准,结直肠癌区域淋巴结常规病理苏木精-伊红(HE)染色阴性者,且术前无施行新辅助放化疗史。排除合并肝、肺、腹膜等远处转移者。其中男性28例,女性12例,年龄32~75岁,平均43.3岁;升、横结肠癌9例,降、乙状结肠癌21例,高位直肠癌10例;肿瘤分化程度:高分化腺癌4例,中分化腺癌8例,低分化腺癌28例;PTNM分期:Ⅰ期4例,Ⅱ期23例,Ⅲ期13例。
1.2 方法与试剂
1.2.1 CanpatrolTM CTC检测 全组结直肠癌患者术前抽取外周静脉血5 mL,随行血标本裂解红细胞,通过纳米技术利用CTCs与白细胞大小的差异行CTCs分离和富集,并利用多重mRNA原位分析法对富集CTCs进行特异性基因核酸定位,进而对其鉴定和分型。扫描结果:红色荧光标记为上皮型CTCs(Ⅰ型);蓝色荧光标记为上皮和间质细胞混合表型CTCs(Ⅱ型);绿色荧光标记为间质型CTCs(Ⅲ型)。
1.2.2 取材方法 全组病例全麻下腹腔镜下或开腹探查腹腔,明确无腹腔及肝脏远处转移后,距结直肠肿瘤缘1.0~1.5 cm上下左右4处,于肠壁浆膜层及黏膜下层分别注射亚甲蓝染色剂0.5 mL,共计2 mL,注射毕10~15 min后行结直肠癌根治术。术中、后沿结直肠系膜蓝染途径分别摘取、标记结肠旁淋巴结(N1)、结肠局部肠系膜淋巴结(N2)、肠系膜上动脉周围及根部淋巴结(N3)、腹主动脉周围淋巴结(N4)四站淋巴结。每站每枚淋巴结标本统一编号,福尔马林固定,石蜡包埋后切片,一半常规病理检查HE染色,另一半预留行IHC CK20测定。
1.2.3 试剂及HE染色、IHC测定 全组40例患者共396枚HE染色阴性的淋巴结纳入本研究。淋巴结标本均制成厚度4 μm石蜡切片,取HE染色阴性的另一半预留淋巴结石蜡标本,经二甲苯脱蜡、梯充酒精脱水后,柠檬酸缓冲液微波法修复抗原;3 %过氧化氢阻断内源性过氧化物酶的活性,加入抗体,4 ℃过夜;DAB显色,显微镜下观察3~10 min,阳性染色为棕褐色或黄色;蒸馏水冲洗,苏木精复染,0.1 %盐酸分化,PBS返蓝;切片经梯度酒精脱水干燥,中性树胶封固;光镜下观察结果。以PBS代替一抗作阴性对照,直肠癌组织作为阳性对照。结果判断:CK20以胞浆黄染或棕褐色为阳性;淋巴结内出现少量CK20阳性细胞认为淋巴结中存在微转移灶。
1.3 统计学分析
应用SPSS 13.0软件进行统计学分析,数据采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 40例患者淋巴结微转移与临床病理特征关系
40例结直肠癌切除的淋巴结标本共396枚,其中N168枚,N2124枚,N3148枚,N456枚。全组IHC CK20阳性淋巴结共43枚,其中N120枚,N214枚,N38枚,N41枚;CK20淋巴结微转移检出率为10.9%(43/396),N1~N4淋巴结CK20淋巴结微转移检出率分别为5.1%(20/396)、3.5%(14/396)、2.0%(8/396)、0.3%(1/396)。淋巴结CK20测定与HE染色法的淋巴结微转移阳性检出率间差异有统计学意义(P<0.01);不同站次间淋巴结微转移阳性检出率存在统计学差异(N1vsN2;N2vsN3;N3vsN4;N1vsN3;N2vsN4;N1vsN4;P<0.01或P<0.05)。见图1。
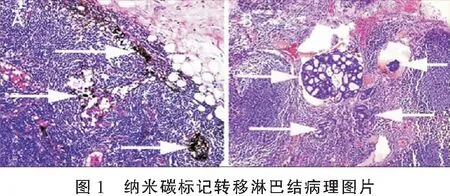
2.2 淋巴结微转移与临床病理特征关系
40例结直肠癌患者行肿瘤区域淋巴结CK20检测有11例患者存在淋巴结微转移,阳性表达率为27.5%(11/40);7例患者TNM分期提高,其中Ⅰ期→ⅢA 1例,ⅡA期→ⅢA 5例,ⅡA期→ⅢC 1例,HE染色重新分期率为17.5%(7/40)。40例患者淋巴结微转移与临床病理特征关系见表1。
2.3 CTCs细胞学分型表达与临床病理特征关系
全组40病例经CTC检测显现阳性共7例,阳性表达率为17.5%(7/40),其中6例对应于IHC淋巴结CK20(+)患者,1例为IHC淋巴结CK20(-)患者,且CTCs细胞学分型表达与结直肠癌肿瘤分化程度、肿瘤浸润深度呈正相关性。详见图2-图4,表2。
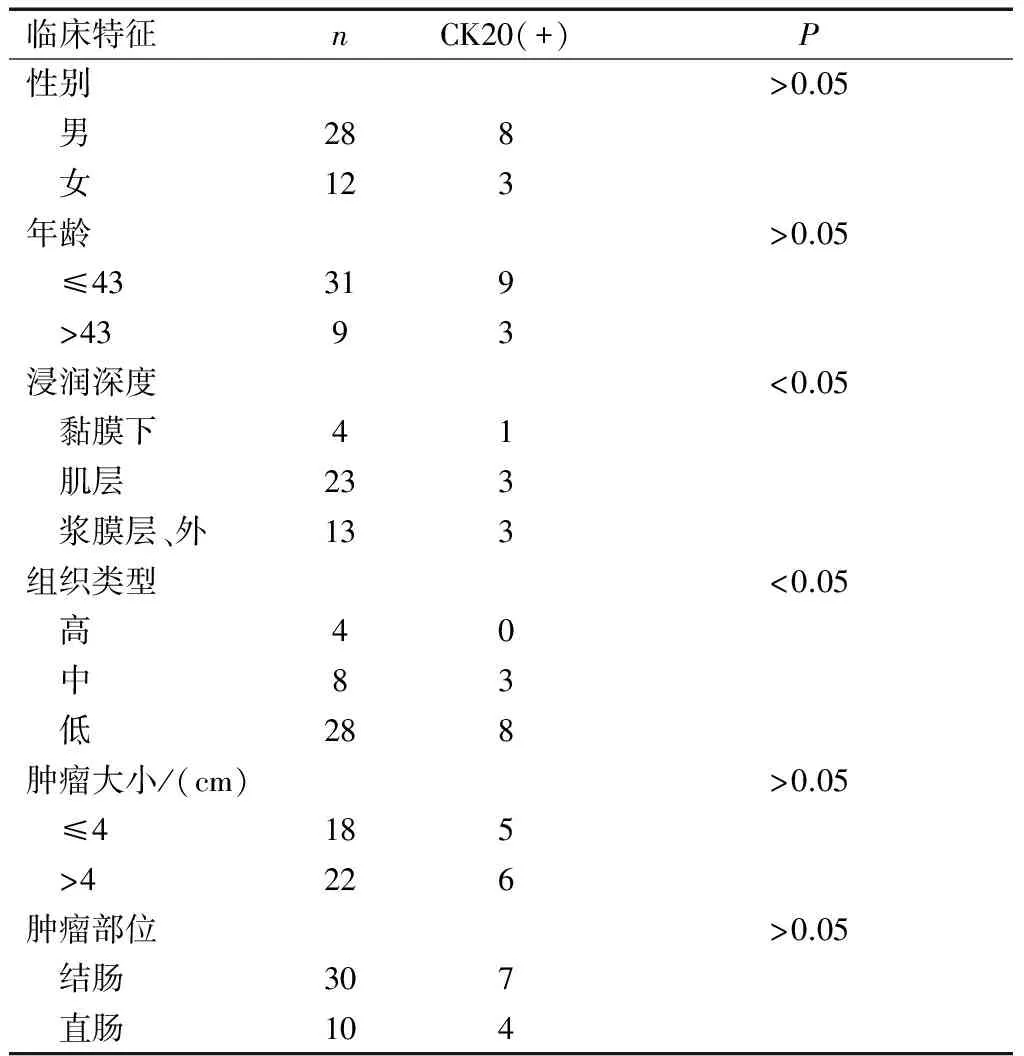
表1 40例患者淋巴结微转移与临床病理特征关系

3 讨论
尽管目前结直肠癌的治疗疗效较过去有了相当大的提高,但临床上仍有30%~50%患者术后出现复发和远处转移[3],即使在常规病理检查未发现淋巴结转移的Ⅰ、Ⅱ期患者,仍有约30%患者5年内死于局部复发和远处转移[4-5]。分析其原因可能是淋巴结、血液、骨髓中存在微小转移灶,用传统的病理检查方法很难检出,而导致临床无法及时、准确治疗[6]。目前,虽然淋巴结转移对结直肠癌预后价值已达成共识,但对于淋巴结微转移和预后的关系仍存在较大分歧。有学者认为,淋巴结微转移对预后无影响[7],但Clarke等[8-9]研究结果显示:Ⅱ期结直肠癌患者约1/4存在淋巴结微转移,且与术后复发转移相关;有淋巴结微转移的Ⅰ~Ⅱ期结直肠癌患者术后复发率更高,3年无瘤生存率更低。
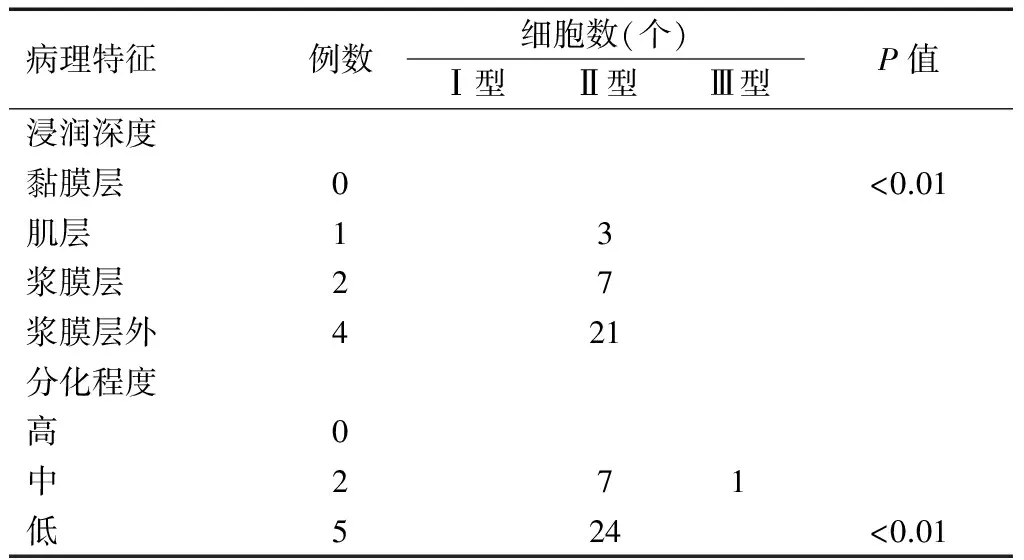
表2 CTCs细胞学分型表达与临床病理特征关系
作为传统病理学检查的HE染色法,针对淋巴结病检只是选取淋巴结具有代表性的一个切面,而不能普查淋巴结大部分组织,故有可能忽略淋巴结微转移的存在。近年来,随着组织化学和分子生物学技术的发展,利用IHC法可发现常规HE染色所不能发现的单个癌细胞和/或孤立肿瘤细胞巢。CK20属细胞角蛋白家族,其具有严格的上皮组织特异性,主要分布于胃、肠黏膜细胞及相应癌细胞中,在大肠癌中高度表达,在正常间叶组织中无表达,且侵袭、转移、扩散至其它组织器官时始终保持稳定,使之成为检测大肠癌微转移敏感而特异的肿瘤标志物。本研究运用IHC方法重新分析了结直肠癌40例396枚HE染色呈阴性的淋巴结,结果发现11例43枚淋巴结存在微转移,CK20淋巴结微转移检出率为10.9%,淋巴结微转移例数达27.5%,其中7例TNM分期提高,HE染色重新分期率为17.5%,与报道[10-11]一致。表明HE染色不能全面反映淋巴结微转移的情况,同时,也进一步表明IHC方法对淋巴结微转移检测更具可靠性和敏感性。
经淋巴转移是结直肠癌的主要转移途径,正确识别、判断淋巴结转移程度并合理清扫显得十分重要。区域淋巴结的组织病理学状态可推测肿瘤分期和预后,但临床上区域淋巴结的部位和范围往往是根据操作者的经验估计而定,受各种主、客观因素的影响其准确性不高。本研究术中首行肿瘤周缘浆膜和黏膜下注射亚甲蓝染液,充分利用亚甲蓝快速直观和在淋巴管消退缓慢、染色稳定可靠的特点,使之较清晰地标识结直肠癌区域淋巴结和淋巴回流途径,尽可能减少因淋巴结个体小、系膜组织肥厚及多向性和“跳跃性”淋巴转移等因素而影响淋巴结的全面、完整取材。研究显示:全组病例区域淋巴结取材平均达9.9枚,不同站次淋巴结CK20(+)检出率分别为N15.1%、N23.5%、N32.0%、N40.3%,组间存在统计学差异(P<0.01或P<0.05)。其中,N1更能反映结直肠癌区域淋巴结的微转移状况,间接印证了结直肠癌远处转移模式[12]。结果表明,通过蓝染法和IHC CK20检测的联合应用利于提高淋巴结微转移的检出率和准确性。
循环肿瘤细胞是指从原发或继发肿瘤脱落进入外周血循环系统的肿瘤细胞。近年来研究表明,肿瘤在发生转移前,原发灶肿瘤细胞通常会在其微环境影响下经历一种被称为上皮间质转化(EMT)的改变。EMT过程中,除了细胞形态和移动性发生改变外,细胞基因表达谱特别是上皮、间质分子标志物及其转录因子的表达也发生改变。发生EMT的肿瘤细胞被赋予干细胞特性,细胞间粘附改变,迁移和侵袭能力增强。因此,CTCs已被认为是导致肿瘤远处转移的主要根源。另外,血液中的循环肿瘤细胞的数量对肿瘤的转移有相关性,更重要的是循环肿瘤细胞的分子特性。处在EMT途径的循环肿瘤细胞具有更强的侵袭性,更能在远处形成新的肿瘤病灶。因此分析肿瘤细胞EMT分子特性,能早期发现肿瘤转移的风险和预后判断。
本研究发现结直肠癌外周血中CTCs的表达与肿瘤分化和浸润程度密切相关,表明随着癌细胞侵袭肠壁深度的加深,肿瘤发生血行转移的比例也随之增加。但微转移阳性表达率方面,CTC的17.5%(7/40)与CK20的27.5%(11/40)相比存在一定差距,推测为血循环肿瘤细胞到达肝脏后容易被肝脏Kupffer细胞所吞噬[13-14]。因此,CTCs的阳性检出率还取决于肝脏免疫系统功能。另外,CTC检测阳性表达病例中1例为IHC CK20(-)患者,术后病理证实为TNM Ⅲ期直肠浸润性癌,病灶大,与周围组织粘连融合,癌栓堵塞淋巴管,致淋巴结取材呈CK20(-)。这表明淋巴结CK20微转移检测仍存在一定的局限性和假阴性。
综上,CK20免疫组化法是检测淋巴结微转移可靠而又敏感的方法,其结合亚甲蓝染色法显影淋巴结可简便、快速地发现微转移灶;与CTC检测联用可达互补效能,进一步提高微转移的检出率,减少假阴性的发生,对进行正确的临床分期,合理的后续治疗提供了依据。但淋巴结存在微转移并不一定是真正意义上的淋巴结转移,微转移的检测可间接作为预后的监测指标,需后期加大样本进一步分析验证。
[1] 刘彦龙,杨艳梅,王锡山.314例直肠癌患者术后复发转移形式及其预后[J].中华胃肠外科杂志,2010,13(9):572-576.
[2] 徐勇超,任莹坤,张占东,等.KISS-1在早期结肠癌淋巴结微转移中的表达及其临床意义[J].中华实验外科杂志,2016, 33(7):1846-1849.
[3] 张健,彭勇,田云鸿,等.精准肝切除在结直肠癌肝转移中的临床应用研究[J].川北医学院学报,2014,29(2):133-136.
[4] Grothey A.Does stage Ⅱ colorectal cancer need to be redefined?[J].Clin Canaer Res,2011,17:3053-3055.
[5] 李国胜,颜登国,张汝一,等.外周血CK20mRNA表达与结直肠癌临床病理和预后的关系[J].世界华人消化杂志,2012,20(21):1996.
[6] 于游,王灿,彭力,等.结直肠癌淋巴结微转移检测的临床意义[J].重庆医学,2010,39(5):548.
[7] Tschmelitsch J,Klimstra DS,Cohen AM.Lymph nodmierometases do not predict relapse in stage Ⅱ colon cancer[J].Ann Surg Oncol,2000,7(8):601-608.
[8] Clarke G,Ryan E,O’Keane JC,etal.The detection of eytokerations in lymph nodes of Duke’s B colorectal cancer subjects predicts a poor outcome[J].Eur J Gastroenterel Hepatol ,2000,12(5):549-552.
[9] 张伟健,曹杰,曾山崎.结直肠癌淋巴结微转移分子诊断的初步研究[J].中华胃肠外科杂志,2010,13(11):858-859.
[10]于游,王灿,彭力,等.淋巴结微转移检测对结直肠癌病理分期的影响[J].肿瘤预防与治疗,2009,22(2):165-167.
[11]韦皓棠,李霖,董保国,等.CK20检测直肠癌系膜根部淋巴结微转移情况及其临床意义[J].中外健康文摘,2014,11(10):193.
[12]Tsioulias G,Wood TF,Morton DL,etal.Lymphaticmaping and focused analysis of sentinel lymph nodes stage gastrointestinal neoplasms[J].Arch Surg,2000,135(8):926-932.
[13]Georges R,Bergmann F,Hamdi H,etal.Sequential biphasic changes in claudin4 expression are correlated to colorectal cancer progression and liver metastasis[J].J Cell Mol Med,2012,16:260- 272.
[14]Paschos KA,Majeed AM,Bird NC.Role of Kupffer cell in the outgrowth of colorectal canaer liver metastases[J].Hepatol Res,2010,40:83-94.
(学术编辑:任亦星)
本刊网址:http://www.nsmc.edu.cn
作者投稿系统:http://noth.cbpt.cnki.net
邮箱:xuebao@nsmc.edu.cn
Study on clinical application of colorectal carcinoma peripheral lymph node CK20 protein detection
WANG Jia-lei,LI Lin
(DepartmentofGastrointestinalSurgery,NanningSecondPeople’sHospital,Nanning530031,Guangxi,China)
Objective:To explore the feasibility and clinical application value of immunohistochemical (IHC) method detecting cytokeratin 20 (CK20) of colorectal carcinoma (CRC) lymph node micrometastasis in the postoperative clinical staging,prognostic diagnosis and therapeutic interventions for patients with CRC.Methods:A total of 40 patients with negative CRC lymph node metastasis by hemotoxylin and eosin HE pathological examination,and peripheral blood circulating tumor cells (CTCs) were collected preoperatively.The lymph nodes were incised,placed and marked every 4 locations along methylene blue stain-marked regional lymph nodes during and after operation,IHC was used to detect CK20 in lymph nodes,the number of patients with positive lymph node micrometastasis and its distribution in different stations were recorded,and the detection results of HE,CTC and IHC CK20 were compared.Results:There was significant differences in the positive detection rate of lymph node micrometastasis between lymph node CK20 and HE stain (P<0.01),and the differences were also significant in the positive detection rate of lymph node micrometastasis among different locations (P<0.01 orP<0.05).According to full-set CK20 detection,11 (11/40,27.5%) patients had lymph node micrometastasis;7 patients had increased TNM stages,and the re-staging rate of HE stain was 17.5% (7/40).Full-set CTC detection showed that 7 patients were positive,with positive expression rate being 17.5% (7/40),in whom 6 were corresponding to IHC lymph node CK20(+) while 1 to IHC lymph node CK20(-).Meanwhile,CTCs cytological typing expression was in positive association with CRC tumor differentiation severity and tumor infiltration depth.Conclusion:CK20 immunohistochemical method,as a reliable and sensitive method for the detection of lymph node micrometastasis,can simply and quickly find the micrometastatic nidi combing with methylene blue stain,and has synergistic effect with CTC detection to further increase the detection rate of lymph node micrometastasis and reduce the occurrence of false negative detection.
Colorectal carcinoma;Cytokeratin 20;Lymph node;Circulating tumor cell;Micrometastasis
10.3969/j.issn.1005-3697.2017.01.023
广西南宁市科学研究与技术开发计划项目(201003045c-7)
2016-08-11
王佳雷(1980-),硕士,主治医师。E-mail:Wjl_0518@163.com
李霖,E-mail:lilin_661220@163.com
时间:2017-3-6 21∶08
http://kns.cnki.net/kcms/detail/51.1254.R.20170306.2108.046.html
1005-3697(2017)01-0082-04
R735.3
A
