右美托咪定对炎症性疼痛大鼠的超前镇痛作用
2017-04-06文松王捷肖智李瑛
文松,王捷,肖智,李瑛
(1.遵义医学院附属医院麻醉科;2.遵义医学院医学与生物学研究中心,贵州 遵义 563099)
右美托咪定对炎症性疼痛大鼠的超前镇痛作用
文松1,王捷1,肖智2,李瑛1
(1.遵义医学院附属医院麻醉科;2.遵义医学院医学与生物学研究中心,贵州 遵义 563099)
目的:观察鞘内注射右美托咪定(dexmedetomidine,DEX)对炎症性疼痛大鼠的镇痛作用以及对大鼠脊髓背角P物质(substance P,SP)表达的影响;明确DEX对炎症性疼痛大鼠具有超前镇痛效应。方法:建立福尔马林诱导的炎症性疼痛SD大鼠模型并给予鞘内注射DEX;观察大鼠疼痛行为学变化;免疫组织化学法和免疫印迹法检测大鼠脊髓背角(L4-6)SP阳性表达变化。结果:炎症性疼痛大鼠疼痛行为学评分增加,脊髓背角SP阳性表达上调;给予鞘内注射DEX可降低炎症性疼痛大鼠疼痛行为学评分以及脊髓背角SP阳性的表达(P均<0.001);鞘内预注射DEX大鼠的疼痛行为学评分和脊髓背角SP表达低于DEX后处理组(P均<0.001)。结论:鞘内注射DEX通过抑制炎症性疼痛大鼠脊髓背角SP表达产生镇痛作用,该作用具有超前镇痛效应。
右美托咪定;炎症性疼痛;超前镇痛;P物质
疼痛是组织损伤或潜在的组织损伤,或据此损伤所描述的一种不愉快的感觉和情感体验。按照国际疼痛研究学会(international association for the study of pain,IASP)的分类,疼痛包括生理性疼痛和病理性疼痛,其中病理性疼痛可进一步分为炎症性疼痛、神经病理性疼痛和癌性疼痛等。疼痛发生机制包括中枢敏化和外周敏化,进而使疼痛阈值下调,机体产生疼痛。脊髓背角在疼痛的中枢敏化机制中有重要作用,其机制包括神经元、神经胶质细胞功能的改变,神经递质释放及其受体表达变化等。P物质(substance P,SP)是经典的疼痛相关递质,多篇文献报道脊髓背角SP的改变介入炎症性疼痛的形成和维持机制[1-2]。超前镇痛是在疼痛发作之前进行的镇痛,即减少任何伤害性刺激传入中枢,从而防止或抑制中枢敏化和/或外周敏化的治疗。右美托咪定(dexmedetomidine,DEX)是α2-肾上腺素能受体激动剂,具有镇静、镇痛、抗交感等作用[3],广泛运用于临床麻醉和围手术期镇痛。本研究将观察鞘内注射DEX对足底皮下注射福尔马林引起的急性炎症性疼痛大鼠是否具有镇痛作用以及该作用是否具有超前镇痛效应,同时探讨其镇痛机制中是否有脊髓背角SP水平的改变,本研究将为拓宽DEX的临床镇痛应用提供理论依据。
1 材料与方法
1.1 动物及分组
健康成年雄性SD大鼠90只(重庆第三军医大学动物实验中心提供),体重(250±10)g,实验期间分笼饲养,3~4只大鼠1笼;大鼠置于安静,温度(25±1)℃,湿度(60±5)%,人工光照,明暗各12 h/d (8AM-8PM)周期环境中,自由进食,饮水。所有与动物饲养和操作的相关事宜都遵循IASP关于应用动物进行疼痛研究的伦理纲要进行操作,研究中尽量减少动物的使用量和动物所受的不适。所有大鼠在实验前至少在动物中心饲养1周。大鼠按照随机数字表法随机分为5组(n=18):(1)生理盐水组(NS组):鞘内注射生理盐水20 μL,10 min后左后足底注射生理盐水100 μL;(2)福尔马林组(F组):鞘内注射生理盐水20 μL,10 min后左后足底注射5%福尔马林100 μL;(3)右美托咪定对照组(DEX组):鞘内注射DEX 2 μg/20 μL,10 min后左后足底注射生理盐水100 μL;(4)右美托咪定+福尔马林组(DEX+F组):首先大鼠给予鞘内注射DEX 2 μg/20 μL,10 min后左后足底注射5%福尔马林100 μL;(5)福尔马林+右美托咪定组(F+DEX组):首先在大鼠左后足底注射5%福尔马林100 μL,10 min后鞘内注射DEX 2 μg/20 μL。观察每组大鼠在福尔马林注射后1 h内疼痛行为学变化,包括(缩腿、舔足、咬足等行为)。在足底注射福尔马林40 min时间点,每组随机取大鼠12只,采用免疫组织化学(n=6)和免疫印迹法(n=6)检测大鼠脊髓背角SP表达情况;每组剩余6只大鼠继续疼痛行为学观察至实验结束。
1.2 主要实验仪器及试剂
冰冻切片机(Leica CM1950,德国)、计时器(traceable,美国)、DEX(200 μg/ 2 mL,江苏恒瑞医药股份有限公司)、兔抗大鼠SP一抗(美国abcam公司)、兔超敏二步法免疫组织化学检测试剂盒(PV-9001)和DAB显色试剂盒(ZLI-9032)购于北京中杉金桥生物技术有限公司、抗大鼠甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体购自康成生物公司。
1.3 方法
1.3.1 炎症性疼痛大鼠模型的制备 大鼠适应环境1 h后,徒手固定大鼠后用100 μL微量进样器在大鼠左足底皮下注射5%福尔马林100 μL。
1.3.2 鞘内注射 按文献[4]的方法进行鞘内注射给药。使用25 μL微量进样器在大鼠L5-6椎间隙进针,进样器针尖与脊柱上方约成60~70°夹角,通过椎间隙接触到骨质后减少10°左右夹角继续缓慢推进,以大鼠出现轻微的甩尾反射视为穿刺成功。30 s内缓慢注射生理盐水或DEX 2 μg/20 μL,穿刺后出现运动障碍的大鼠不纳入统计数据。
1.3.3 疼痛行为学反应 大鼠足底注射福尔马林后立即用计时器记录大鼠1 h内每5 min内的缩腿和舔爪时间总和,本实验采用Abbott等[5]所推荐的以缩腿及舔爪时间之和作为疼痛行为学反应的指标。观察时,在饲养笼底以45°夹角放置一面镜子,以便观察动物后肢的活动情况。
1.3.4 二步法免疫组织化学染色 取福尔马林注射后40 min时间点的各组大鼠,每组6只,过量的4%水合氯醛腹腔注射(20 mL/kg)深度麻醉,左心室插管入主动脉升部,150 mL冷生理盐水快速灌流冲洗血液,然后给予200 mL预冷的4%多聚甲醛(多聚甲醛溶于0.2 MPB)缓慢灌流,维持3 h左右。取出脊髓组织,放入4%多聚甲醛PB溶液中4~6 h后转移到30%蔗糖溶液中48~60 h直到脊髓组织沉底。沉底的脊髓组织取出后,取L4-6脊髓节段冷冻包埋剂(OCT)包埋后-20 ℃冰冻切片机中速冻40 min,沿脊髓组织冠状位连续切片,厚30 μm,每5~6张脊髓组织切片取1张进行免疫组织化学分析,每只大鼠取10张。脊髓组织切片经PBS漂洗后在3%过氧化氢液和胎牛血清中封闭、漂洗后加入兔抗大鼠SP(1∶300稀释)一抗,在室温下反应1 h后,4 ℃冰箱中过夜;SP切片加入生物素化的山羊抗兔IgG抗体-HRP多聚体;DAB显色,常规明胶贴片于载玻片上,梯度酒精脱水,二甲苯透明后用中性树胶封片,24 h后光镜下观察并采集图像。Image-Pro Plus图像分析软件测定脊髓背角浅层(Ⅰ、Ⅱ板层,Rexed分层法)SP免疫反应阳性纤维平均光密度(average optical density,AOD),所有切片均在同一光强度下测定。
1.3.5 免疫印迹技术检测 SP 在脊髓的表达 取建模后40 min时间点各组大鼠,每组随机取6只。大鼠4%水合氯醛(20 mL/kg 腹腔注射)过量麻醉后,取脊髓组织称重,研脆后加入裂解液,进行超声波粉碎;低温离心取上清液;BCA法蛋白定量;待测样品 (蛋白含量20 μg) 加样,电泳,电转至PVDF膜。加入一抗:兔抗大鼠SP抗体(1∶400)和抗大鼠GAPDH(1∶2 000),4 ℃孵育过夜后加入二抗。化学增强发光试剂与PVDF膜共孵育后显影,定影。图像进行目标条带扫描(方正扫描仪F5600),BIO-RAD的生物图像处理系统 (PDQUEST)进行分析,以GAPDH为内参对照,对所测目标蛋白的条带光密度值(optical density,OD)进行标准化,得到各组SP蛋白相对光密度值。
1.4 统计学分析
2 结果
2.1 足底注射福尔马林对大鼠疼痛行为学影响
NS组大鼠在观察时间内未见明显缩腿、舔爪反应;F组大鼠足底注射福尔马林后,其注射足出现明显的两时相疼痛行为反应,第一时相为注射后立即开始,持续约5min;第二时相为福尔马林注射后15~60min。F组大鼠疼痛评分最高值在福尔马林注射后40min,其后疼痛评分值有少许下降但与NS组比较,差异仍有统计学意义(P<0.001)(图1)。
2.2 鞘内注射DEX对福尔马林致痛大鼠疼痛行为学影响
DEX组无明显缩腿、舔爪反应,在各观察时间点,DEX组和NS组大鼠疼痛评分差异无统计学意义;F+DEX和DEX+F组大鼠鞘内注射DEX后其疼痛评分降低,与NS组比较,差异有统计学意义(P均<0.001);F+DEX和DEX+F组比较,鞘内注射DEX预处理可降低福尔马林致痛大鼠的疼痛评分,与F+DEX组比较,差异有统计学意义(P<0.001)(图1)。
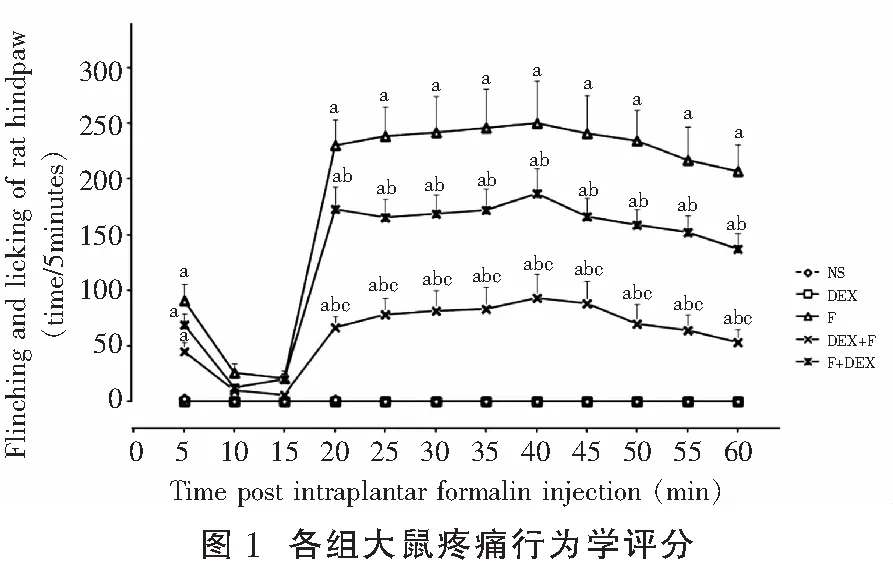
aP<0.001,与NS组大鼠比较;bP<0.001,与F组大鼠比较;
cP<0.001,与F+DEX组大鼠比较。
2.3 免疫组织化学法检测各组大鼠脊髓背角SP表达
取足底注射福尔马林后40min时间点的各组大鼠(n=6),免疫组织化学法检测SP阳性产物AOD值。SP阳性反应产物呈棕褐色颗粒状,主要表达在脊髓背角灰质浅层。DEX组SP阳性产物AOD值与NS组比较,差异无统计学意义;F组大鼠SP阳性产物AOD值显著升高,与NS组比较,差异有统计学意义(P<0.001);福尔马林致痛大鼠鞘内注射DEX后,其SP阳性产物AOD值显著降低,与F组比较,差异有统计学意义(P<0.001);F+DEX和DEX+F组比较,鞘内注射DEX预处理可降低福尔马林致痛大鼠的SP阳性产物AOD值,与F+DEX组比较,差异有统计学意义(P<0.001)(图2,图3)。
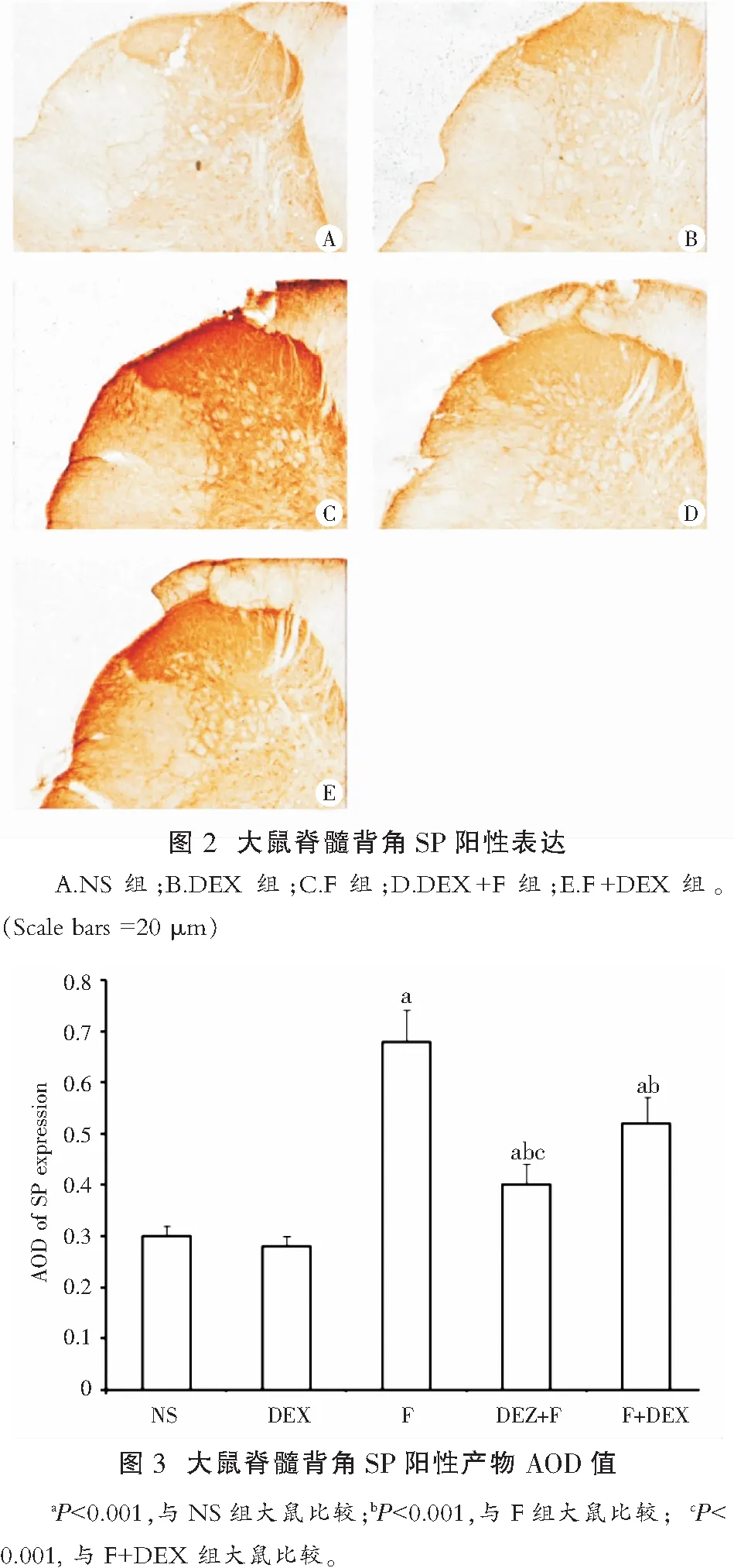
2.4 免疫印迹法检测大鼠脊髓背角SP蛋白表达
取福尔马林建模后40min时间点的各组大鼠(n=6),免疫印迹法检测脊髓背角中SP蛋白的表达情况。结果提示,各组大鼠脊髓背角中均观察到有SP免疫阳性条带。以GAPDH作为内参蛋白,采用相对光密度值定量检测结果。NS组与DEX组SP蛋白免疫阳性条带相对光密度值差异无统计学意义;F组大鼠脊髓背角SP蛋白免疫阳性条带相对光密度值升高,与NS组比较,差异有统计学意义(P<0.001);鞘内注射DEX减少炎症性疼痛大鼠脊髓背角SP蛋白免疫阳性表达,DEX+F组、F+DEX组与F组比较,脊髓背角SP蛋白免疫阳性表达水平降低,差异有统计学意义(P均<0.001);DEX+F组与F+DEX组比较,DEX+F组大鼠脊髓背角SP蛋白免疫阳性表达水平降低,差异有统计学意义(P<0.001)(图4,图5)。

3 讨论
大鼠福尔马林疼痛模型是接近临床病理性疼痛表现的持续性疼痛动物模型,模型成功复制率高,广泛应用于炎症性疼痛机制的研究。在啮齿类动物,福尔马林引起的炎症性疼痛可表现出典型的双相变化:第一时相为自发缩足反应期,在福尔马林注射后立即出现,持续约5min;随后是相对安静的间歇期,持续约10min;第二时相为持续反应期,出现在福尔马林注射后约15~60min。从疼痛发生的机制上看,第一时相为早发伤害性疼痛反应,为福尔马林直接刺激外周感觉神经末梢引起;第二时相为迟发伤害性疼痛反应,指福尔马林产生的外周局部炎性疼痛可使中枢脊髓神经元兴奋阈值降低,兴奋性增高即中枢敏化所致。但也有不同的观点,通过外周单纤维记录技术研究发现,福尔马林诱发的双相痛是由外周初级传入Aδ和C纤维双相放电所介导,即福尔马林引起的第二时相疼痛(持续痛)反应也是外周伤害部位源性而非中枢敏化[6]。本研究发现SD大鼠足底注射福尔马林后,大鼠有缩腿、舔爪及颤抖等疼痛行为学反应,同时,该反应呈现明显的两时相疼痛特点,说明本研究中炎症性疼痛大鼠模型建模成功。
DEX是一种强效、高选择性的α2肾上腺素能受体激动剂,具有镇痛、镇静、抗焦虑、交感神经阻滞等作用[7]。本研究发现鞘内注射DEX(2μg/20μL)对福尔马林所致的炎症性疼痛大鼠具有明显的镇痛作用;另一方面,鞘内注射DEX(2μg/20μL)对正常大鼠(足底皮下仅注射生理盐水的DEX组大鼠)的疼痛评分值无影响,说明鞘内注射DEX(2μg/20μL)仅对病理性疼痛大鼠产生镇痛作用而对正常大鼠的痛阈无影响。
SP作为第一个被发现的神经肽,是经典的疼痛相关神经递质。在脊髓,SP通过与其它神经递质相互作用参与对疼痛信息的调制。有研究表明[8]:鞘内应用SP可产生热痛敏,产生致痛效应。但SP在脊髓水平的作用仍有争议,Wu等[9]研究表明SP在脊髓背角具有抑制神经元动作电位产生的前馈作用,参与脊髓水平的伤害性疼痛信息处理。本实验发现,炎症性疼痛大鼠脊髓背角SP阳性表达较正常大鼠显著升高;鞘内注射DEX后,炎症性疼痛大鼠脊髓背角SP阳性表达下调,疼痛缓解,说明DEX通过抑制大鼠脊髓背角SP水平升高对炎症性疼痛的形成和维持产生抑制作用。
早在1983年Woolf[10]发表了一篇超前镇痛的动物实验研究。通过多年的临床和基础研究提示:超前镇痛的实质就是通过一些干预措施(镇痛药物和/或镇痛方法)避免或减少中枢敏感化和外周敏感化的形成,从而减轻或避免疼痛的形成和维持[11]。但至今对超前镇痛的机制缺乏深入的了解,因此对其镇痛效果及时限性仍存有争议。中枢与超前镇痛机制有关的部位包括脊髓和脊髓上结构。目前临床常用的超前镇痛药物包括阿片类药物、局部麻醉药、非甾体类消炎药、NMDA受体拮抗剂和α2受体激动剂等[12]。在脊髓水平,(1)DEX作用于脊髓背角一级神经元突触前膜及二级神经元突触后膜上的α2受体,通过激活胞内第二信使,使K+通道开放,细胞膜超极化,抑制细胞内Ca2+浓度增加,从而使SP释放减少,神经激肽-1受体内化,二级神经元的动作电位难以产生,从而在突触处抑制伤害性信息传递[13-14];(2)由于α2-肾上腺素能受体为突触前受体,激活后可抑制突触前神经元去甲肾上腺素释放,抑制疼痛信号向大脑传递;(3)DEX也可以通过增加脊髓中间神经元释放乙酰胆碱、一氧化氮、降钙素基因相关肽等神经递质参与疼痛调节。在脊髓上水平,蓝斑是延髓-脊髓下行性去甲肾上腺素能通路的起源,在伤害性神经递质的调控中起重要的作用。DEX作用于蓝斑α2-肾上腺素能受体,抑制该下行性传导通路,最终减少脊髓P物质的释放和其他伤害性肽类的释放,产生镇痛作用[15]。
本研究结果证实:鞘内注射DEX可抑制炎症性疼痛大鼠脊髓背角SP的释放,减少外周伤害性刺激向中枢的传导,避免中枢敏化,最终产生镇痛作用;炎症性疼痛大鼠预先鞘内给予DEX,其脊髓背角SP表达比后给予DEX的炎症性疼痛大鼠减少,提示DEX对炎症性疼痛的镇痛作用具有超前镇痛效应。由于本研究结果是建立在动物实验的基础上,是否能安全、有效的将鞘内注射DEX运用于临床还需进一步的研究证实。
[1]LiWW,GuoTZ,ShiX,et al.SubstancePspinalsignalinginducesglialactivationandnociceptivesensitizationafterfracture[J].Neuroscience,2015,310:73-90.
[2] Keeble JE,Brain SD.A role for substance P in arthritis?[J].Neurosci Lett,2004,361(1-3):176-179.
[3] Jessen Lundorf L,Korvenius Nedergaard H,Moller AM.Perioperative dexmedetomidine for acute pain after abdominal surgery in adults[J].Cochrane Database Syst Rev,2016,doi:10.1002/14651858.
[4] 王怀泉,郑方,李文志.清醒大鼠鞘内注射模型的制备与验证[J].中国疼痛医学杂志,2003,9(4):235-236.
[5] Abbott FV,Franklin KB,Westbrook RF.The formalin test:scoring properties of the first and second phases of the pain response in rats[J].Pain,1995,60(1):91-102.
[6] Puig S,Sorkin LS.Formalin-evoked activity in identified primary afferent fibers:systemic lidocaine suppresses phase-2 activity[J].Pain,1996,64(2):345-55.
[7] 文松,肖智,李瑛.右美托咪啶在临床麻醉与镇痛中的应用进展[J].川北医学院学报,2013,28(6):591-595.
[8] Wajima Z,Hua XY,Yaksh TL.Inhibition of spinal protein kinase C blocks substance P-mediated hyperalgesia[J].Brain Res,2000,877(2):314-321.
[9] Wu LJ,Xu H,Ko SW,etal.Feed-forward inhibition:a novel cellular mechanism for the analgesic effect of substance P[J].Mol Pain,2005,1(1):1-4.
[10]Woolf CJ.Evidence for a central component of post-injury pain hypersensitivity[J].Nature,1983,306(5944):686-688.
[11]Moiniche S,Kehlet H,Dahl JB.A qualitative and quantitative systematic review of preemptive analgesia for postoperative pain relief:the role of timing of analgesia[J].Anesthesiology,2002,96(3):725-741.
[12]卢静,兰志勋.超前镇痛机制及其临床应用进展[J].实用医院临床杂志,2013,10(6):210-212.
[13]邹鑫,王世端,冯伟.右美托咪啶的临床麻醉应用进展[J].国际麻醉学与复苏杂志,2011,32(2):201-204.
[14]Nazarian A,Christianson CA,Hua XY,etal.Dexmedetomidine and ST-91 analgesia in the formalin model is mediated by alpha2A-adrenoceptors:a mechanism of action distinct from morphine[J].Br J Pharmacol,2008,155(7):1117-1126.
[15]Funai Y,Pickering AE,Uta D,etal.Systemic dexmedetomidine augments inhibitory synaptic transmission in the superficial dorsal horn through activation of descending noradrenergic control:an in vivo patch-clamp analysis of analgesic mechanisms[J].Pain,2014,155(3):617-628.
(学术编辑:林菁燕)
Preemptive analgesic effect,dexmedetomidine in inflammatory pain rats
WEN Song1,WANG Jie1,XIAO Zhi2,LI Ying1
(1.DepartmentofAnesthesiology,AffilatedHospitalofZunyiMedicalCollege;2.TheResearchCenterforMedicine&Biology,ZunyiMedicalCollege,Zunyi563099,Guizhou,China)
Objective:To observe the analgesic effect of the intrathecal injection of the dexmedetomidine (DEX) on acute inflammatory rats induced by subcutaneous injection of the formalin,and the expression alterations of the substance P (SP) in the spinal dorsal horn on rats.The study was also designed to test the preemptive analgesic effect of DEX on the inflammatory pain rats.Methods: The formaline-induced inflammatory pain model of SD rats was established by subcutaneous injection of formalin into the plantar surface of the left hind paw of rats.The DEX was intrathecally injected and the pain-related behaviors were studied.The expression changes of substance P (SP) in the spinal dorsal horn(L4-6)were detected by using the immunohistochemistry and Western blot methods.Results: The cumulative pain scores were increased and the SP-positive expression in the dorsal horn was up-regulated after intraplantar injection of formalin.The intrathecal injection of DEX decreased the cumulative pain scores and inhibited the SP-positive expression.Additionally,the analgeic effect of the pre-injection DEX was stronger than the post-injection.Conclusion: Intrathecal injection of the DEX can attenuate the inflammatory pain in rats through inhibiting the expression of SP expression in the dorsal horn of spinal cord,and the administration of DEX has a preemptive analgesic effect at the spinal level in formalin-induced inflammatory pain.
Dexmedetomidine;Inflammatory pain;Preemptive analgesia;Substance P
10.3969/j.issn.1005-3697.2017.01.002
贵州省科学技术基金项目[黔科合J字LKZ(2011)21号] 收稿日期:2016-07-12
文松(1986-),男,硕士,住院医师。
李瑛,E-mail:zyliying1219-0321@163.com
时间:2017-3-6 21∶07
http://kns.cnki.net/kcms/detail/51.1254.R.20170306.2107.004.html
1005-3697(2017)01-0005-05
R614
A
