祁州漏芦通过下调JNK和NFκB抑制H2O2致肝细胞凋亡
2017-04-05何鑫刘春彦尹基峰金爱花尹学哲全
何鑫+刘春彦+尹基峰+金爱花+尹学哲+全吉淑

[摘要]研究祁州漏芦对H2O2所致HepG2细胞凋亡的抑制作用机制。建立H2O2诱导的人HepG2细胞损伤模型,采用MTT法检测细胞存活率;采用化学比色法检测LDH,ALT,AST活性;采用黄嘌呤氧化酶法检测细胞SOD活性,二硫代二硝基苯甲酸法检测GSH含量,采用硫代巴比妥酸法检测MDA生成量,比色法测定Caspase3,8,9的相对活性;蛋白印迹法测定Cleaved Caspase3(Casp3),细胞色素c(Cyto c)和NFκB,ERK,JNK,p38 MAPK及其磷酸化蛋白的表达。结果显示,祁州漏芦在质量浓度25~400 mg·L-1对HepG2细胞活力无显著影响。H2O2降低细胞存活率,造成细胞损伤,并上调Casp3,胞浆Cyto c,pJNK以及核NFκB蛋白水平。与模型组比较,祁州漏芦组细胞存活率升高;培养液中LDH,ALT和AST活性降低;细胞内MDA含量降低,SOD活性和GSH含量升高,Caspase3,8,9相对活性降低,细胞Casp3和胞浆Cyto c蛋白表达降低,细胞pJNK及核NFκB蛋白水平降低。提示,祁州漏芦对H2O2所致HepG2细胞凋亡具有抑制作用,其作用可能与其抑制JNK激活和NFκB核转位作用有关。
[关键词]祁州漏芦;H2O2;氧化应激;凋亡;HepG2
[Abstract]To study the inhibitory effect of Rhaponticum uniflorum on apoptosis induced by H2O2 in HepG2 cells Human HepG2 cells injury models were established by H2O2, then cell survival rate was assayed by MTT method; levels of LDH, ALT, and AST were detected by chemical colorimetric method;SOD activity was detected by xanthine oxidase method; GSH content was detected by dithiobisnitrobenzoic acid(DTNB); MDA level was detected by thiobarbituric acid (TBA) method;and the relative activities of Caspase3, 8 and 9 were measured by Colorimetry The expression levels of Cleaved Caspase3(Casp3), cytochrome(Cyto c), NFκB, ERK, JNK, p38 MAPK, as well as the phospharylated proteins were determined with Western blotting method The results showed that R unifloru had no significant effect on cell viabilities of HepG2 cells at the concentrations of 25400 mg·L-1 However, H2O2decreased the cell viabilities, increased the cellular oxidative stress, and upregulated the protein expressions of Casp3, cytoplasmic Cyto c, pJNK and nuclear NFκB As compared with the model group,R unifloru could increase the cell viability, reduce LDH, ALT and AST leakage, reduce the MDA formation, increase the SOD and GSH levels,reduce the relative activities of Caspase3, 8 and 9, downregulated the protein expressions of Casp3 and cytoplasmic Cyto c, and downregulate the pJNK and nuclear NFκB levelsThe results indicated that R unifloru had the inhibitory effect on apoptosis induced by H2O2in HepG2 cells, and the mechanism maybe associated with inhibiting JNK activation and NFκB nuclear translocation
[Key words]Rhaponticum unifloru; H2O2; oxidative stress; apoptosis; HepG2
近年來肝病发生率的逐年上升已经引起社会的关注,而活性氧引发的肝细胞氧化应激是多种肝病发生的重要机制之一,因此,探讨如何有效缓解氧化应激损伤对肝病的防治具有重要意义[1]。祁州漏芦是菊科植物Rhaponticum uniflorum (L) DC的干燥根,是一味常用中药。广泛分布于我国内蒙古、东北、山东等地区,药源丰富。它性味咸、苦、寒,能清热解毒,消肿排毒,通乳汁;主治于乳汁不通、淋巴结结核、风湿性关节炎、痔疮等[23]。近年来研究发现,祁州漏芦具有提高机体免疫、抗动脉硬化、抗脂质过氧化、抗衰老、抗炎等作用[46]。课题组研究还发现,祁州漏芦具有良好的保肝作用,能预防多种因素引起的肝损伤,如,可抑制四氯化碳、氨基半乳糖所致化学性肝损伤以及对乙酰氨基酚所致药物性肝损伤等[79]。本实验通过建立H2O2致HepG2细胞损伤模型,预防性给药后观察祁州漏芦水提物对氧化损伤所致凋亡以及凋亡相关蛋白表达的变化,以便探讨祁州漏芦肝细胞损伤的保护作用机制,为祁州漏芦的保肝作用研究提供参考。
1材料
11药物与试剂将祁州漏芦切碎后加水煎煮,滤液经减压蒸馏即得祁州漏芦提取物(RU)干品,主要成分为多糖(81%)和甾酮(12%)[6];用无血清培养液配成所需浓度,过滤除杂除菌备用。人HepG2肝癌细胞购自南京凯基生物有限公司。DMEM培养基、胎牛血清购自Gibco公司;MTT购自SigmaAldrich公司; LDH,ALT,AST,MDA,GSH,SOD试剂盒购自南京建成科技有限公司;Caspase3,8,9检测试剂盒、线粒体/细胞核制备试剂盒购自江苏凯基生物技术股份有限公司;兔NFκB p65多克隆抗体、兔pNFκB p65多克隆抗体、小鼠ERK多克隆抗体、兔pERK多克隆抗体、兔JNK多克隆抗体、兔pJNK多克隆抗体、兔p38多克隆抗体、兔pp38 MAPK多克隆抗体购自Abcam公司;兔Cleaved Caspase3(Casp3)单克隆抗体、兔细胞色素c(Cyto c)单克隆抗体购自Cell Signaling公司。
12仪器二氧化碳培养箱(美国Shellab公司);台式高速冷冻离心机(德国Eppendorf公司);酶标仪(深圳雷杜公司);垂直版电泳仪及转印槽(美国BioRad公司);凝胶成像分析仪(美国UVP公司)。
2方法
21细胞培养及传代细胞培养和传代按常规方法进行,含10%胎牛血清的DMEM高糖培养基,37 ℃,5%CO2的饱和湿度培养箱中培养,取对数生长期细胞用025%胰蛋白酶溶液消化进行传代[10]。
22RU试验剂量的确定细胞接种于96孔板中培养12 h后,正常组换成无血清培养液;其余6组为药物组,加RU溶液使其质量浓度分别为25,50,100,200,400,800 mg·L-1。继续培养24 h,吸出培养液,加入MTT溶液,MTT法检测细胞存活率。另设空白孔(只加RU溶液)以排除药物干扰[10]。以细胞存活率(100±5)%为标准确定RU安全浓度[1011]。细胞存活率=(实验组-空白组)/(正常组-空白组)×100%。
23细胞损伤模型的建立和细胞存活率的检测细胞接种于96孔板,培养12 h细胞全部贴壁后,分为正常组、模型組及RU高、中、低剂量组(分别为RU 200,RU 100和RU 50组,质量浓度分别为200,100,50 mg·L-1)。RU组加入相应的含药培养液,孵育24 h;正常组和模型组加入无血清培养液继续孵育24 h;除正常组外,其余组加入300 μmol·L-1 H2O2造模[12]。MTT法检测细胞存活率。
24细胞培养液中LDH,ALT,AST释放的检测细胞分组、造模和给药按23项方法。按试剂盒说明书检测培养液中LDH,ALT,AST的活性。
25细胞MDA,GSH生成和SOD活性的检测按23项方法将细胞在6孔板中分组、造模和给药。细胞用025%的胰酶消化,收集细胞并裂解,离心取上清。按照试剂盒说明书检测细胞MDA,GSH水平和SOD活性。
26细胞Caspase3,8,9的相对活性的测定裂解细胞,离心取上清,并按照试剂盒说明书测定细胞Caspase3,8,9的相对活性。
27细胞Casp3,Cyto c,NFκB,ERK,JNK,p38蛋白及其磷酸化蛋白水平的检测收集和裂解细胞,并提取细胞总蛋白。每组以20 μg蛋白进行SDSPAGE电泳分离,转移至PVDF膜上。用脱脂奶粉封闭,加一抗孵育过夜,加HRP标记二抗孵育1 h,加ECL试剂显色,采集图像并进行灰度比值分析[67]。
28统计学处理数据以±s表示,采用SPSS 190统计软件,采用单因素方差分析及t检验进行数据处理。
3结果
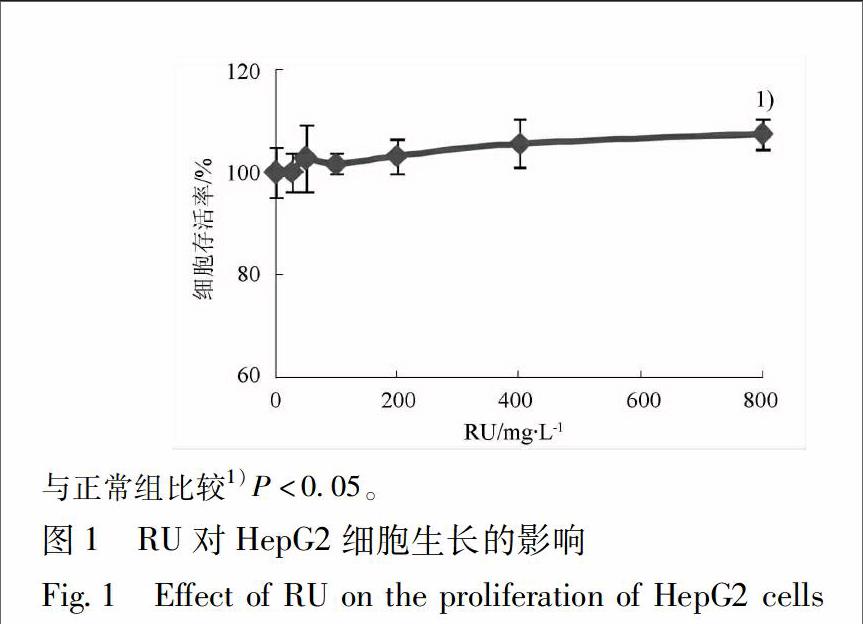
31RU对HepG2细胞生长的影响随着RU浓度的升高,细胞存活率呈升高趋势;质量浓度介于50~400 mg·L-1时,HepG2细胞存活率为100%~105%,对细胞生长无显著影响;当质量浓度为800 mg·L-1时,细胞存活率为107%,与正常组比较差异显著(P<005),有促细胞生长作用,见图1。因此,本研究选50,100,200 mg·L-1为RU干预剂量进行后续研究。
32RU对细胞存活率以及LDH,ALT,AST释放的影响正常组的HepG2细胞生长良好,培养液中3种酶活性不高,说明正常组细胞没有受到损伤;H2O2损伤后HepG2细胞存活率仅为正常组的54%,与正常组比较显著降低(P<005);细胞培养液中LDH,ALT,AST活性分别增高372%,226%,219%,与正常组比较显著升高(P<005)。与模型组比较,RU各组细胞存活率显著增高(P<005),培养液中LDH,ALT,AST活性显著降低(P<005)。表明,RU干预降低H2O2所致细胞损伤,见表1。
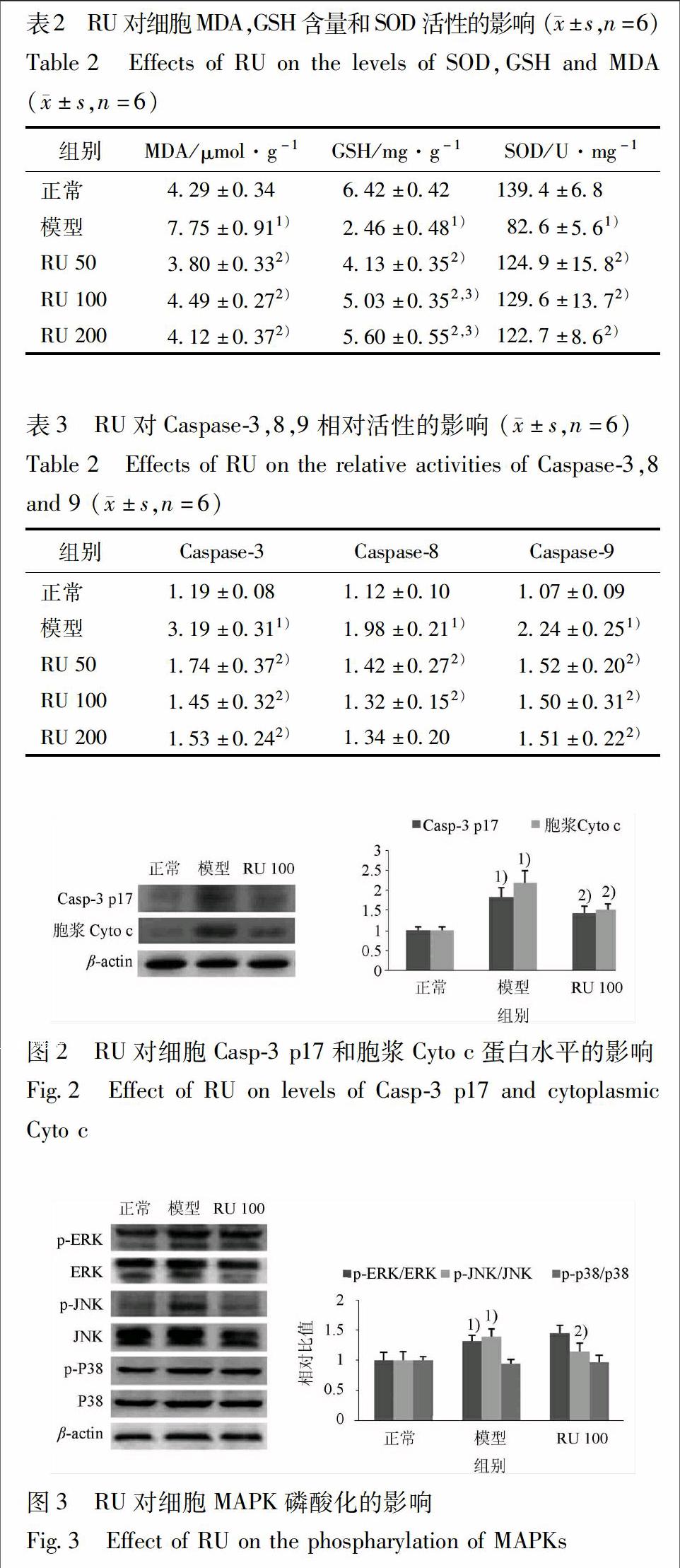
33RU对细胞MDA,GSH水平和SOD活性的影响与正常组比较,模型组细胞SOD活性和GSH含量显著降低(P<005),MDA含量显著升高(P<005)。与模型组比较,RU各组细胞SOD活性与GSH含量显著升高(P<005),MDA含量降低(P<005),表明RU干预使细胞抗氧化能力增高,氧化应激降低,见表2。
34RU对Caspase3,8,9相对活性的影响与正常组比较,模型组细胞Caspase3,8,9的相对活性显著增高(P<005);与模型组比较,RU各组细胞Caspase3,8,9的相对活性显著降低(P<005),表明RU抑制H2O2所致肝细胞凋亡,见表3。
35RU对细胞Casp3 p17和胞浆Cyto c蛋白水平的影响蛋白印迹结果显示,与正常组比较,模型组细胞Casp3 p17和胞浆Cyto c蛋白水平显著增高何鑫等:祁州漏芦通过下调JNK和NFκB抑制H2O2致肝细胞凋亡
36RU对细胞MAPK磷酸化的影响H2O2不影响3种MAPK总蛋白水平,对p38磷酸化水平也无显著影响,但上调ERK和JNK磷酸化水平(P<005)。与模型组比较,RU组细胞JNK磷酸化水平显著降低(P<005),但ERK磷酸化水平无显著变化,见图3。
37RU对细胞NFκB磷酸化和核转位的影响
4讨论
在肝损伤发生发展过程中,氧化应激是重要环节。因此,寻找对抗肝脏氧化应激的药物,可作为治疗肝损伤关键途径之一[11]。祁州漏芦为传统中药,其保肝作用研究已有一定积累[79]。本试验以人HepG2肝癌细胞构建H2O2诱导的氧化应激损伤模型,研究祁州漏芦的抗肝细胞损伤作用,为阐明祁州漏芦保肝机制提供参考。
当肝细胞受到H2O2诱导的氧化应激损伤时,细胞存活率和细胞毒性是反映细胞受损程度的重要指标。而LDH,ALT,AST作为肝细胞稳定的胞内酶,培养液中其活性升高是检测肝细胞毒性的重要指标之一[1113]。本实验结果显示,祁州漏芦干预可降低细胞毒性,提高细胞存活率,对H2O2诱导的肝细胞损伤具有保护作用。
在H2O2诱导的细胞损伤中,氧化应激是重要损伤机制。肝细胞受损后产生的过量活性氧自由基,攻击生物膜,引发脂质过氧化,使过氧化物水平增高,因此MDA可以反映组织细胞受自由基攻击的严重程度[1113]。本实验结果表明,祁州漏芦干预可升高细胞SOD活性和GSH含量;降低细胞MDA生成,提示,祁州漏芦可通过减轻H2O2诱导的肝细胞氧化应激而达到抑制肝细胞损伤。
氧化应激损伤同样会诱导肝细胞发生凋亡。氧化应激损伤中产生的过量活性氧会损伤功肝细胞线粒体,使其释放Cyto c,继而活化Caspase家族,并最终导致细胞凋亡[14]。Caspase级联反应是推动细胞凋亡程序的核心事件,其中Caspase9为内源性的线粒体凋亡途径的关键酶,Caspase8为外源性的死亡受体途径的关键酶,二者分别在细胞凋亡的2条主要途径中起作用,而Caspase3则为凋亡的执行者,是2条凋亡通路的共同环节,因此是凋亡发生的标志酶[1314]。本研究显示,H2O2上调Casp3和胞浆Cyto c蛋白表达,增高肝细胞Caspase3,8,9相对活性,而祁州漏芦干预可下调Casp3和胞浆Cyto c蛋白表达,降低肝细胞Caspase3,8,9相对活性。提示,祁州漏芦抑制H2O2诱导的肝细胞凋亡,至少与Cyto c释放引起的线粒体途径相关,死亡受体途径的参与还需进一步探讨。
氧化应激还可通过多个通路增强MAPK磷酸化而导致细胞凋亡或壞死基因的激活或改变[15]。MAPK通路是细胞外信号到细胞内的主要信号通路,ERK普遍认为是“细胞生存”通路,JNK通路则形成调控细胞增殖和凋亡的一个复杂网络,存在协同和拮抗的现象,p38调控炎症反应,调节NFκB活化[16]。NFκB是一种具有多向转录调节作用的蛋白因子,其与肝细胞损伤的关系一直是肝脏疾病研究中的热点[17]。研究证实,活性氧可以直接激活NFκB转移入细胞核,诱导靶基因的转录,促进各种炎症介质释放而导致肝细胞炎症,诱发肝细胞凋亡[17]。本研究结果显示,H2O2上调ERK,JNK和NFκB磷酸化以及NFκB核转位水平,而祁州漏芦干预可下调JNK磷酸化和NFκB核转位水平,对ERK和NFκB磷酸化水平无显著影响。提示,祁州漏芦可能是通过抗JNK激活和NFκB核转位作用而抑制肝细胞凋亡的。祁州漏芦抗细胞凋亡作用中NFκB和JNK之间的关联、以及线粒体凋亡通路之间的关系需进一步研究。
综上所述,祁州漏芦对H2O2所致HepG2细胞凋亡具有抑制作用,其作用可能与其抗JNK激活和NFκB核转位作用有关。
[参考文献]
[1]韩延忠,周永峰,桑秀秀,等 氧化苦参碱对H2O2诱导L02细胞损伤的抑制作用及其机制的研究[J] 中国中药杂志,2016, 41(7):1302
[2]全国中草药汇编编写组 全国中草药汇编. 下册[M] 2版.北京:人民卫生出版社,1996:919
[3]金爱花 漏芦对小鼠H22肝癌皮下移植瘤的抑制作用及机制研究[D] 延吉:延边大学,2011
[4]邹莉波,于庆海,蔡虹 祁州漏芦抗氧化作用的实验研究[J]. 沈阳药学院学报,1992, 9(1): 73
[5]张学武,李天洙,孙权 漏芦提取物抗炎、镇痛、耐缺氧及抗疲劳作用的研究[J] 四川中医,2005, 23(7): 45
[6]李勇,金明,全吉淑 漏芦水提取物抗脂质过氧化活性分析[J] 中国公共卫生,2011, 27(10): 1338
[7]宋昊,赵文玺,王玉娇,等 祁州漏芦对四氯化碳所致肝脏氧化应激和DNA损伤的影响[J] 中国药学杂志,2013, 48(22):1915
[8]宋昊,朱璟,金梅花,等 祁州漏芦不同溶剂提取物对急性肝损伤模型小鼠的保护作用[J] 中国药房,2014, 25(3):205
[9]金明,高峰,金梅花,等 祁州漏芦对D氨基半乳糖所致小鼠急性肝损伤的保护作用[J] 食品研究与开发,2016, 37(2):1
[10]刘春彦 漏芦对H2O2诱导的HepG2细胞损伤的保护作用[D] 延吉:延边大学,2012
[11]韩林,李健,林欣,等 黄芪甲苷对Chang Liver细胞酒精性和非酒精性氧化损伤的保护作用[J] 中国中药杂志,2014, 39(22):4430
[12]金明,王玉娇,金梅花,等 两种细胞建立肝细胞氧化损伤模型比较[J] 中国公共卫生,2015, 31(3):324
[13]贺兰芝,孟雅坤,韩延忠,等 木犀草素对对乙酰氨基酚诱导的L02肝细胞损伤的保护作用[J] 中国中药杂志,2016, 41(22):4234
[14]董曦,孙桂波,罗云,等 异鼠李素对H2O2引起的H9C2细胞氧化应激损伤的保护作用研究[J] 中国药理学通报,2015, 31(6):853
[15]吴娜,蔡光明,何群 氧化应激与肝脏损伤[J] 世界华人消化杂志,2008, 16(29):3310
[16]尹学哲,王玉娇,尹基峰,等 草苁蓉提取物对HepG2细胞氧化应激损伤的保护作用[J] 食品科学,2015, 36(15):173
[17]尹学哲,王玉娇,尹基峰,等 草苁蓉多糖对过氧化氢损伤HepG2细胞NFκB表达的影响[J] 中国老年学杂志,2016, 36(13):3108[责任编辑张宁宁]
