三七皂苷R1通过雌激素受体调节ATF6/Akt信号通路减轻OGD/R所导致的神经元损伤
2017-04-05侯倩伶王岩李英博胡雪莲王莎莉
侯倩伶+王岩++李英博++胡雪莲+王莎莉


[摘要]三七皂苷R1(notoginsenoside R1,NGR1)是傳统中药三七的重要活性成分,也是雌激素受体激动剂。因其蕴含抗炎、抗氧化、抗凋亡等多种功能,故在疾病治疗中被普遍运用。为阐明NGR1在缺血缺氧性脑病(hypoxicischemic brain damage,HIBD)中的潜在神经保护作用机制,该研究采用原代皮层神经元建立氧糖剥夺再灌注(oxygenglucose deprivation/reoxygenation,OGD/R)损伤模型,并且给予NGR1及雌激素受体阻断剂ICI182780处理,然后分别采用MTT,LDH和Hochest 33342染色检测神经元存活率、细胞膜完整性和凋亡,Western blot检测抗凋亡通路ATF6α,pAkt,Akt蛋白及凋亡相关蛋白Bax,Cleaved Caspase3的表达。结果显示:神经元在OGD/R损伤后,其细胞存活率明显下降(P<005)、细胞膜相对完整性显著降低(P<005)、细胞凋亡加重(P<005),ATF6α,pAkt表达下调且促凋亡蛋白Bax,Cleaved Caspase3表达增加(P<005)。NGR1处理后能够减轻OGD/R造成的神经元细胞损伤,上调ATF6α表达、促进Akt磷酸化并且减少Bax,Cleaved Caspase3蛋白的表达(P<005),但是,NGR1的这些神经保护性作用能够被雌激素受体阻断剂ICI182780阻断。研究结果证实:NGR1在缺血缺氧情况下对神经元具有保护性作用,该保护作用可能是NGR1通过雌激素受体调控ATF6/Akt信号通路实现的。
[关键词]三七皂苷R1; 原代皮层神经元细胞; 缺血缺氧性脑病; 凋亡; 氧糖剥夺再灌注; ATF6; Akt
[Abstract]Notoginsenoside R1(NGR1),a critical compound in traditional herb Panax notoginseng, is a kind of estrogen receptor agonistIt is reported to exhibit antiapoptotic,antioxidative and antiinflammatory properties activity, so it is widely used for treatment of various diseasesIn order to investigate the potential neuroprotective effect of NGR1 in hypoxicischemic brain damage(HIBD), primary cortical neurons were used in this study to establish oxygenglucose deprivation/reoxygenation(OGD/R) injury models They were treated with NGR1 and estrogen receptor inhibitor ICI182780 respectively, then the neuronal survival, cell membrane integrity and apoptosis were assessed by MTT assay,lactate dehydrogenase test(LDH) and Hoechst 33342 stain respectively, while the protein expression levels of ATF6α,pAkt,Akt,Bax and Cleaved Caspase3 were measured by Western blotting Results indicated that as compared with the blank control group,OGD/R could induce cell injury and apoptosis(P<005), reduce relative integrity of cell membrane(P<005), decrease protein expression of ATF6α,pAkt(P<005), and increase protein expression of Bax and Cleaved Caspase3(P<005) in the primary cortical cells After NGR1 treatment, the expression levels of ATF6α,pAkt were obviously increased, and the expression levels of Bax and Cleaved Caspase3 and the apoptosis of neuron were decreased(P<005) However, these neuroprotective properties of NGR1 against ODG/Rinduced cell damage could be blocked by ICI182780 This finding indicated that NGR1 may protect the primary cortical neurons against OGD/R induced injury,and the mechanism may be associated with accelerating the activation of the ATF6/Akt signaling pathway via estrogen receptors
[Key words]notoginsenoside R1; primary cortical neurons; hypoxicischemic brain damage; apoptosis; oxygenglucose deprivation/reoxygenation; ATF6; Akt
缺血缺氧性脑病(hypoxicischemic brain damage,HIBD)是常见的神经系统疾病,其病理过程包含炎癥反应,兴奋性神经毒性反应以及神经元的凋亡和坏死现象等[12],且神经细胞凋亡在疾病发生过程中占重要作用[3]。三七皂苷R1(notoginsenoside R1,NGR1)是从三七中提取的皂苷类化合物,也是一种天然雌激素受体激动剂,它具有抗凋亡、抗炎、抗氧化、抗内质网应激等多种保护作用[46]。研究发现:NGR1能够以抑制细胞凋亡的方式来对抗缺血再灌注后心肌细胞损伤以及糖尿病肾病中肾小球足细胞损伤[78];可以通过雌激素受体减轻HIBD中的内质网应激,发挥其脑保护功能[9]。但NGR1对抗HIBD中神经元凋亡的报道很少,具体机制也不明确。本研究是为了验证NGR1在HIBD中的保护作用并探讨其相关机制。
1材料和方法
11材料
SpragueDawley(SD)孕鼠(重庆医科大学实验动物中心)。NGR1,3(4,5二甲基噻唑2)2,5二苯基四氮唑溴盐(MTT) (SigmaAldrich);Neurobasal、无糖Neurobasal、B27supplement、高糖DMEM、胰蛋白酶、胎牛血清、青链霉素、HBSS(GIBCO公司);乳酸脱氢酶活性测定试剂盒(南京建成生物工程研究所);ICI182780(TocrisBioscience公司);Hoechst 33342(碧云天生物技术研究所);ATF6抗体(Abcam公司);PhosphoAkt 抗体、Akt抗体(Cell Signaling Technology公司);Bax抗体、Cleaved Caspase3抗体(Santa Cruz公司);小鼠抗βactin抗体(Sigma公司);Hochest 33342,RIPA裂解液(碧云天生物技术研究所);BCA蛋白浓度测定试剂盒(Thermo Fisher Scientific公司);蛋白印记二抗辣根过氧化物酶标记羊抗兔IgG、羊抗小鼠IgG、兔抗山羊IgG(博士德生物工程有限公司);酶标仪(BioRad公司)。
12分组
实验分为对照组(Control组)、模型组(OGD/R组)、OGD/R+NGR1(05,1,2,5,10,20 μmol·L-1)组,以判断不同浓度NGR1对OGD/R神经元的作用;DMSO组(溶剂对照组);OGD/R+NGR1(10 μmol·L-1)+ICI182780(01 μmol·L-1)组,用ICI182780阻断雌激素受体后,以判断NGR1是否通过雌激素受体发挥保护性作用;OGD/R+ICI182780(01 μmol·L-1)组。NGR1 在缺氧及复糖氧过程作用于细胞,ICI182780于缺氧前2 h 预处理细胞且在缺氧及复糖氧过程作用于细胞。
13细胞培养及药物处理
超净工作台内无菌条件下断头取脑并分离孕18 d的SD胎鼠大脑皮层脑组织,其后放置在预冷的DHank′s液中。组织剪碎后用025%的胰蛋白酶(002%EDTA)37 ℃消化8 min,含10%胎牛血清的高糖DMEM终止消化,过滤,离心(1 000 r·min-15 min),分离所得细胞重悬于Neurobasal(2%B27)的种植培养液,种植在预先以多聚L赖氨酸(100 mg·L-1)包被的培养瓶或培养皿中(37 ℃,5%CO2,饱和湿度),每2~3 d半量换液1次。NGR1于OGD/R过程中加入培养液,雌激素受体阻断剂ICI182780(01 μmol·L-1)在细胞OGD/R模型制备前2 h加入。
14细胞OGD/R模型制备
将培养5~7 d的海马神经元细胞用于建立OGD/R模型,将模型组各组细胞液换为含相应药物的无糖Neurobasal液体,放置于三气培养箱(37 ℃,5%CO2,1%O2)内培养15 h,复糖氧时换使用Neurobasal(2%B27)培养液,培养箱中复糖氧24 h。
15细胞存活率检测
各组种于96孔板的神经元细胞复糖氧24 h后,每孔分别加入5 g·L-1MTT磷酸缓冲液10 μL,常规培养4 h,弃置上清液保留孔底沉淀物,每孔分别加入100 μL的DMSO,于570 nm波长处检测各孔吸光度,换算吸光度比值分别求出各组相对细胞存活率。
16细胞膜完整性检测
各组神经元细胞复糖氧培养24 h后,收集每组的细胞培养液,同时将相应各组剩余贴壁细胞用100 μL 025%Triton100以裂解,收集裂解液。以LDH试剂盒说明书步骤方法分别检测各组的培养液及裂解液的LDH漏出率,分别换算培养液中的LDH漏出与总LDH漏出的比值来表示各组的LDH相对漏出率(培养液LDH/培养液LDH+裂解液LDH)。
侯倩伶等:三七皂苷R1通过雌激素受体调节ATF6/Akt信号通路减轻OGD/R所导致的神经元损伤17细胞凋亡检测
神经元细胞种于24孔培养板内细胞爬片。OGD/R 24 h后,弃培养液后用PBS清洗,4%多聚甲醛固定,再次PBS清洗后滴加Hochest 33342工作液染色并放置于暗处30 min,吸出工作液并用PBS清洗,甘油以封片并使用倒置荧光显微镜观察细胞核形态后各组分别采图。
18Western bolt检测蛋白表达情况
各组神经元细胞添加有磷酸酶抑制剂及蛋白酶抑制剂RIPA裂解液冰上吹打裂解,12 500 r·min-14 ℃离心20 min,分别取其上清液后以BCA法检测蛋白量浓度,100 ℃电热浴变性5 min,SDSPAGE凝胶电泳(5%浓缩胶+10%分离胶,80 V,100 min),电转至PVDF膜,TBS洗膜10 min后5%封闭蛋白干粉稀释液封闭2 h,分别孵育ATF6,pAkt,Akt,Bax,Cleaved Caspase3一抗4 ℃过夜,TBST轻摇洗膜30 min,室温采用相应二抗孵育1~2 h,TBST洗膜30 min后ECL液显色,凝胶成像仪成像采图,ImageLab软件灰度值定量分析。
19统计学分析
用SPSS 170统计软件对数据进行分析。数据以±s的形式表示,各组数据通过正态分布检验及组间方差齐同检验符合标准后,采用单因素方差(OneWay ANOVA)分析组间差异性,P<005表明数据差异具有统计学显著性。
2结果
21NGR1对OGD/R诱导的神经元细胞损伤具有保护作用
211NGR1能够增加OGD/R神经元存活率采用不同剂量NGR1分别干预OGD/R神经元后,MTT检测各组细胞存活率(n=5)。实验显示,在OGD/R后,相比对照组OGD/R组细胞存活率显著下降(P<005),加入NGR1后,OGD/R+NGR1组细胞与OGD/R组相比存活率升高,且呈浓度依赖性,NGR1浓度为10 μmol·L-1时细胞存活率最高(P<005)。说明适宜浓度的NGR1能够增加OGD/R神经元存活率。见图1。
212NGR1可以缓解OGD/R神经元细胞膜损伤采用不同剂量NGR1分别干预OGD/R神经元后,LDH试剂盒对各组细胞LDH漏出率进行检测(n=5)以判断细胞膜完整性。实验显示,在OGD/R后神经元细胞LDH漏出率相比对照组明显增加(P<005),加入NGR1后OGD/R+NGR1组与OGD/R组相比细胞膜损伤显著减轻(P<005),并具有浓度依赖性,在浓度为10 μmol·L-1时,神经元膜相对完整性最好(P<005)。提示一定浓度的NGR1对于OGD/R造成的细胞膜损伤有保护性作用,见图1。
在使用MTT法和LDH试剂盒分别检测细胞存活率情况及细胞膜完整性情况的试验中,得出当浓度为10 μmol·L-1时NGR1对神经元细胞的保护作用最佳,故后续实验确定为此浓度。
213NGR1可以缓解OGD/R神经元凋亡在NGR1干预OGD/R神经元后,Hochest 33342染色法分别检测各组细胞凋亡情况(n=5)。实验显示,正常情况下对照组可见少量凋亡细胞,OGD/R情况下神经元凋亡增多(P<005),大量细胞核出现破裂、固缩及核边缘毛粗糙现象,将此类细胞核视为阳性细胞核。加入NGR1干预后与OGD/R模型组相比其阳性细胞核显著减少(P<005)。表明一定浓度的NGR1可以缓解OGD/R导致的神经元细胞凋亡,见图1。
22NGR1对OGD/R神经元的保护作用与雌激素受体调节ATF6/AKT信号通路调控相关
221ICI182780阻断雌激素受体后NGR1保护性作用被减弱用MTT,LDH漏出率及Hochest 33342染色分别检测NGR1及ICI182780对神经元的作用。相比对照组,神经元OGD/R损伤后存活率下降,LDH漏出率增高,凋亡阳性细胞及异常形态细胞核增多(P<005)。NGR1干预后,检测显示神经元存活率及细胞膜完整性增加,其凋亡情况明显减轻。但OGD/R+NGR1+ICI182780组与OGD/R+NGR1组相比,雌激素受体阻断剂ICI182780能够阻断NGR1的这些作用。提示NGR1对神经元的保护作用可能是通过雌激素受体发挥的,见图2。
222NGR1通过雌激素受体调节ATF6/Akt信号通路Western blot方法分别检测各组ATF6α,
A与OGD/R组相比,OGD/R+NGR1组的细胞存活率呈NGR1浓度依赖性增高;B细胞膜完整性呈NGR1浓度依赖性增强。A和B图中,均为NGR1浓度10 μmol·L-1和20 μmol·L-1时P<005。C与OGD/R组相比,OGD/R+NGR1组Hochest 33342染色阳性细胞和形态异常细胞核减少,P<005。与对照组比较1)P<005;与OGD/R组相比2)P<005;与OGD/R+NGR1组相比3)P<005(n=5,Bar=20 μm)。
Akt蛋白表达。实验显示,与对照组相比OGD/R组ATF6α,pAkt表达明显下调(P<005);各组Akt表达不变。在OGD/R+NGR1组,ATF6α,pAkt表达与OGD/R组相比明显升高(P<005)并接近对照组水平,提示NGR1可以上調ATF6α,pAkt的表达;使用ICI182780阻断雌激素受体后,OGD/R+NGR1+ICI182780组与OGD/R+NGR1相比,ATF6α,pAkt表达降低(P<005),提示:NGR1对ATF6α,pAkt的调节作用被抑制,见图3。
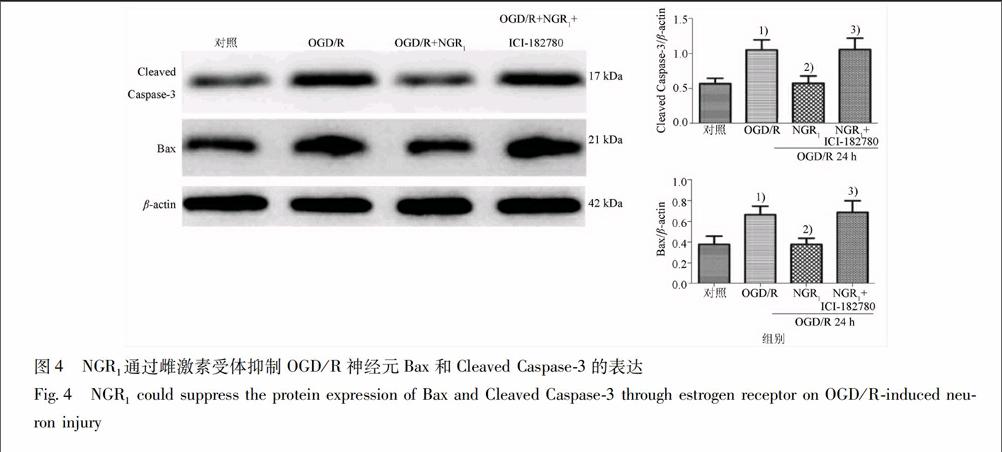
223NGR1通过雌激素受体影响促凋亡相关蛋白的表达Western blot方法检测各组凋亡相关蛋白Bax,Cleaved Caspase3蛋白表达。实验显示,OGD/R组与对照组相比Bax,Cleaved Caspase3蛋白表达量上调(P<005);给予NGR1处理后Bax,Cleaved Caspase3蛋白表达水平下调,相比OGD/R组其差异有统计学显著性(P<005);使用ICI182780阻断雌激素受体后,OGD/R+NGR1+ICI182780组与OGD/R+NGR1相比Bax,Cleaved Caspase3表达明显升高(P<005),提示:NGR1对Bax,Cleaved Caspase3的调节作用被抑制,见图4。
3讨论
缺血缺氧性脑病(hypoxicischemic brain damage,HIBD)是复合性原因造成的脑缺氧、脑血流减少或停歇所致的脑损害,可能造成中枢神经系统永久性损伤乃至威胁患者生命。由于HIBD病理生理过程极为复杂,所以对于其损伤机制的研究以及有效药物的寻找目前依然是脑血管疾病研究的热点之一。
NGR1是我国传统中药三七的皂苷类有效成分,也是一种天然的雌激素受体激动剂,具有广泛的药理作用。如三七通过抑制活性氧、调控丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)缓解Aβ在神经元沉积所致的神经退行性病理改变[10];通过减少细胞凋亡、抑制炎症反应治疗缺血再灌注所导致的肾功能损伤[11];通过减轻血管内皮细胞损伤和"活血化淤"预防心脑血管疾病[1213]。有研究阐明缺血再灌注所导致神经元细胞继发性死亡以凋亡方式为主[14],所以抑制细胞凋亡一直被认
AOGD/R+NGR1组细胞存活率较OGD/R组增高,但OGD/R+NGR1+ICI182780组细胞存活率低于OGD/R+NGR1组,P<005;B与OGD/R组相比,OGD/R+NGR1组LDH漏出率降低,ICI182780预处理后OGD/R+NGR1+ICI182780组LDH漏出率高于OGD/R+NGR1组,P<005;COGD/R+NGR1+ICI182780组核异常细胞增多,与OGD/R+NGR1组相比P<005。与对照组比较1)P<005;与OGD/R组相比2)P<005;与OGD/R+NGR1组相比3)P<005(n=5,Bar=20 μm)。
与对照组比较1)P<005;与OGD/R组相比2)P<005;与OGD/R+NGR1组相比3)P<005(n=4,图4同)。
为是治疗缓解HIBD造成神经系统损伤的关键途径。研究发现,NGR1可以通过抑制线粒体相关的凋亡通路改善Aβ124所诱导的神经元凋亡[15],通过对抗凋亡和氧化应激在脑缺血性损伤疾病中发挥神
经保护性作用[1617]。但目前对于在HIBD过程中,NGR1在抗神经元凋亡的机制报道很少。
本实验选择体外培养SD胎鼠皮层神经元并建立氧糖剥夺再灌注(oxygenglucose deprivation/reoxygenation,OGD/R)模型,以模拟缺血缺氧所致的神经细胞损伤[9],以ATF6/Akt信号通路为主要线路,探讨NGR1抗OGD/R神经元凋亡的机制。实验发现在OGD/R损伤24 h后,模型组与对照组相比神经元内LDH大量外释,凋亡明显增加。NGR1可以剂量依赖性的减轻OGD/R所诱导的细胞损伤和凋亡,提高神经细胞生存率。本结果与本课题组的前期实验结果一致。实验均证实,无论是在体外实验(OGD/R神经元模型)还是体内实验(SD大鼠新生鼠脑缺血缺氧模型)中,NGR1能够有效对抗缺血缺氧造成的损伤、发挥神经保护性作用[9]。但NGR1的作用机制复杂,本研究针对NGR1对HIBD保护性作用的分子机制进行了进一步探讨。
激动雌激素受体可以发挥脑保护作用。雌二醇通过细胞膜上雌激素受体激活ERK及PI3K/Akt信号通路,活化转录因子CREB并增添神经营养因子BDNF表达,从而增加脑缺血再灌注损伤大鼠海马CA1区域神经元存活能力、改善其认知功能障碍[18]。激动雌激素受体可抑制过量谷氨酸释放所诱导的兴奋性神经毒性作用,抗细胞凋亡[19];可增加大脑海马区神经营养因子BDNF表达,改善由于原发性高血压和抑郁症造成的神经系统功能障碍[2021];可诱导PI3K/Akt与MAPK/ERK信号通路活化,用减轻细胞凋亡方式改善脊髓损伤后的运动障碍[22]。作为植物雌激素受体激动剂的NGR1能否通过雌激素受体抗OGD/R神经元凋亡,发挥其神经保护作用是本实验关注的重点内容。
近期研究发现,在细胞凋亡过程中活化转录因子ATF6(activating transcription factor 6,ATF6) 也起着重要作用。ATF6最初是作为血清反应因子(serum response factor,SRF)的结合蛋白而被发现的,其在细胞的增殖调控中起辅助激活因子的作用[23]。ATF6 定位于内质网膜,是未折叠蛋白反应(unfolded protein response,UPR)过程中转导应激信号的关键性转录激活因子,它在内质网应激介导的细胞凋亡和生成的过程中占据关键性地位[9,2427]。在转基因小鼠模型中,过表达ATF6能够减轻缺血再灌注所造成的小鼠心肌细胞损伤[28]。慢性间歇性缺氧(chronic intermittent hypoxia,CIH)能够促进ATF6的表达并进而增加心肌对急性缺血/再灌注损伤(ischemia/reperfusion,I/R) 的耐受性[29]。同时急性脑缺血再灌注损伤中,ATF6可以通过抑制促凋亡蛋白CHOP的表达并且激活转录GRP78基因来缓解内质网应激造成的细胞损伤,促进细胞存活[3031]。由此可见ATF6是一个在多个信号传导系统中发挥转录因子或转录辅助因子的多功能蛋白,具有细胞保护及促进细胞生存的特性。更为重要的是,雌激素受体可以上调ATF6α的表达[32]。Akt又被称为蛋白激酶B(PKB),是Caspase3上游的重要激动分子。Akt磷酸化后不但激活自身活性,还促进其下游信号通路参与到细胞凋亡、生长、分化及损伤保护等过程中[3334]。ATF6信号通路可以通过改变Akt的活化来干預细胞存活[29,3536]。Karali E等在近期研究中证实,ATF6被活化后将诱导Akt在Ser473位点的磷酸化反应,从而使Akt完全活化。pAkt通过促进神经细胞存活、抑制凋亡,施展对细胞保护性作用[3738]。但缺乏在HIBD时NGR1通过ATF6α影响Akt从而调控神经元凋亡的文献,特别是NGR1是否通过雌激素受体发挥其保护作用的相关报道。故本实验检测了雌激素受体拮抗剂ICI182780干预前后,NGR1对OGD/R神经元和ATF6α,Akt,pAkt表达的影响。通过对OGD/R神经元预处理ICI182780后,与OGD/R+NGR1组相比,OGD/R+NGR1+ICI182780组细胞存活率明显降低;LDH释放和细胞凋亡增多,提示:NGR1对神经元的保护性作用被雌激素阻断剂ICI182780抑制;Western blot结果也显示OGD/R损伤后,ATF6α,Akt表达下调,使用NGR1干预治疗后能明显上调ATF6α,Akt的磷酸化pAkt蛋白表达,但是NGR1的作用又能够被ICI182780阻断雌激素受体后翻转。提示NGR1的保护作用,与上调ATF6α,Akt蛋白相关。
Caspase3作为凋亡执行蛋白在凋亡信号通路中占据关键地位。在一般状态下,Caspase3作为32 kDa的无活性形式存在,当受到上游的凋亡调节蛋白激活后,其断裂为17 kDa和11 kDa片段,进而特异性剪切PARP等底物蛋白、参与DNA片段化及染色质固缩等凋亡相关过程[39],故Caspase3多用于鉴定细胞是否发生凋亡。而Bax作为促凋亡蛋白,一旦其表达上调,能够损伤线粒体膜电位,并使细胞色素C释放至胞浆,激发关联的Caspase活化[40]。有研究发现,低浓度的H2O2可以引起Akt的活化,并由此导致Bax的磷酸化,同时维护Bax在胞浆内的稳定性,减少线粒体内细胞色素C的释放,进而减少细胞凋亡[41]。Akt同样可以通过抑制Caspase9的剪切活化来减少Caspase3的表达和激活[42]。为此又检测了这2个凋亡的关键蛋白。研究结果证实,NGR1干预降低OGD/R神经元促凋亡蛋白Bax和Cleaved Caspase3的表达,抗凋亡作用仍然能够被雌激素受体阻断剂ICI182780所阻断。
綜上,本研究认为NGR1对HIBD中神经细胞损伤的保护性作用可能是通过雌激素受体调节ATF6及其下游的Akt信号通路,抑制促凋亡蛋白Bax和Caspase3的表达实现的。
[参考文献]
[1]AlvarezDiaz A,Hilario E,de Cerio F G,et alHypoxicischemic injury in the immature brainkey cascular and cellular players[J].Neonatology,2007,92(4):227
[2]Peng J H,Feng Y,Le Blane M H,et alApoptosis and necrosis in developing cerebellum and brainstem induced atter focal cerebral hypoxic ischemic injury[J]Brain Res Dev Brain Res, 2005,156(1):87
[3]Beilharz E J,Williams C E,Dragunow M,et alMechanisms of delayed cell death following hypoxicischemic injury in the immature rat: evidence for apoptosis during selective neuronal loss[J].Brain Res Mol Brain Res, 1995,29(1):1
[4]Zhang H S,Wang S QNotoginsenoside R1 inhibits TNFalphainduced fibronectin production in smooth muscle cells via the ROS/ERK pathway[J]Free Radic Biol Med, 2006,40(9):1664
[5]Zhang H S,Wang S QNotoginsenoside R1 from Panax notoginseng inhibits TNFalphainduced PAI1 production in human aortic smooth muscle cells[J]Vascul Pharmacol, 2006,44(4):224
[6]Gu B,Nakamichi N,Zhang W S,et alPossible protection by notoginsenoside R1 against glutamate neurotoxicity mediated by NmethylDaspartate receptors composed of an NR1/NR2B subunit assembly[J]J Neurosci Res, 2009,87(9):2145
[7]Ge Z R,Xu M C,Huang Y U,et alCardioprotective effect of notoginsenoside R1 in a rabbit lung remote ischemic postconditioning model via activation of the TGFβ1/TAK1 signaling pathway[J] Exp Ther Med, 2016,11(6):2341
[8]Huang G, Lv J, Li T,et alNotoginsenoside R1 ameliorates podocyte injury in rats with diabetic nephropathy by activating the PI3K/Akt signaling pathway[J]Int J Mol Med, 2016,38(4):1179
[9]Wang Y,Tu L,Li Y,et alNotoginsenoside R1 protects against neonatal cerebral hypoxicischemic injury through estrogen receptordependent activation of endoplasmic reticulum stress pathways[J]J Pharmacol Exp Ther, 2016,357(3):591
[10]Ma B,Meng X,Wang J,et alNotoginsenoside R1 attenuates amyloidβinduced damage in neurons by inhibiting reactive oxygen species and modulating MAPK activation[J]Int Immunopharmacol, 2014,22(1):151
[11]Liu W J,Tang H T,Jia Y T,et alNotoginsenoside R1 attenuates renal ischemiareperfusion injury in rats[J]Shock, 2010,34(3):314
[12]Bhattacharya K,Farwell K,Huang M,et alMast cell deficient W/Wv mice have lower serum IL6 and less cardiac tissue necrosis than their normal littermates following myocardial ischemiareperfusion[J]Int J Immunopathol Pharmacol, 2007,20(1):69
[13]郭鈺琪,齐冬梅,郝钰,等三七皂苷R1调节炎性T细胞亚群保护血管内皮的实验研究[J]中国药理学通报,2012,28(2):240
[14]LopezNeblina F,Toledo A H,ToledoPereyra L HMolecular biology of apoptosis in ischemia and reperfusion[J]J Invest Surg, 2005,18(6):335
[15]马涛,辛文锋,张文生,等三七皂苷R1对Aβ142诱导的SHSY5Y细胞凋亡的保护作用[J]中国中药杂志,2015,40(2):305
[16]Meng X,Wang M,Wang X,et alSuppression of NADPH oxidase and mitochondrionderived superoxide by notoginsenoside R1 protects against cerebral ischemiareperfusion injury through estrogen receptordependent activation of Akt/Nrf2 pathways[J].Free Radic Res, 2014,48(7):823
[17]Huang X P,Ding H,Lu J D,et alEffects of the combination of the main active components of astragalus and Panax notoginseng on inflammation and apoptosis of nerve cell after cerebral ischemiareperfusion[J]Am J Chin Med, 2015,43(7):1419
[18]Yang L C,Zhang Q G,Zhou C F,et alExtranuclear estrogen receptors mediate the neuroprotective effects of estrogen in the rat hippocampus[J]PLoS ONE, 2010,5(5):e9851
[19]Lan Y L,Zhao J,Li SEstrogen receptors′ neuroprotective effect against glutamateinduced neurotoxicity[J]Neurol Sci, 2014,35(11):1657
[20]Pietranera L,Correa J,Brocca M E,et alSelective oestrogen receptor agonists rescued hippocampus parametersin male spontaneously hypertensive rats[J]J Neuroendocrinol, 2016,8(10):1111
[21]Ibrahim W W,Safar M M,Khattab M M,et al17βEstradiol augments antidepressant efficacy of escitalopram in ovariectomized rats: neuroprotective and serotonin reuptake transporter modulatory effects[J]Psychoneuroendocrinology, 2016, 74:240
[22]Cheng Q,Meng J,Wang X S G1 exerts neuroprotective effects through G proteincoupled estrogen receptor 1 following spinal cord injury in mice[J]Biosci Rep, 2016,36(4):e00373
[23]Zhu C,Johansen F E,Prywes RInteraction of ATF6 and serum response factor[J]Mol Cell Biol, 1997,17(9):4957
[24]Chen X,Shen J,Prywes RThe luminal domain of ATF6 senses endoplasmic reticulum (ER) stress and causes translocation of ATF6 from the ER to the Golgi[J]J Biol Chem, 2002,277(15):13045
[25]Han X, Zhang P, Jiang R, et alExplore on the effect of ATF6 on cell growth and apoptosis in cartilage development[J]. Histochem Cell Biol, 2014,142(5):497
[26]Guo F J, Xiong Z, Lu X, et alATF6 upregulates XBP1S and inhibits ER stressmediated apoptosis in osteoarthritis cartilage[J].Cell Signal, 2014,26(2):332
[27]Nakanishi K,Sudo T, Morishima NEndoplasmic reticulum stress signaling transmitted by ATF6 mediates apoptosis during muscle development[J]J Cell Biol, 2005,169(4):555
[28]Martindale J J,Fernandez R, Thuerauf D,et alEndoplasmic reticulum stress gene induction and protection from ischemia/reperfusion injury in the hearts of transgenic mice with a tamoxifenregulated form of ATF6[J]Circ Res, 2006,98(9):1186
[29]Jia W,Jian Z,Li J,et alUpregulated ATF6 contributes to chronic intermittent hypoxiaafforded protection against myocardial ischemia/reperfusion injury[J]Int J Mol Med, 2016,37(5):1199
[30]Urban P,Pavlíková M,Sivonová M,et alMolecular analysis of endoplasmic reticulum stress response after global forebrain ischemia/reperfusion in rats: effect of neuroprotectant simvastatin[J].Cell Mol Neurobiol, 2009,29(2):181
[31]Xin Q,Ji B,Cheng B,et alEndoplasmic reticulum stress in cerebral ischemia[J]Neurochem Int,2014,68:18
[32]Kooptiwut S,Mahawong P,Hanchang W,et alEstrogen reduces endoplasmic reticulum stress to protect against glucotoxicity inducedpancreatic βcell death[J]J Steroid Biochem Mol Biol, 2014,139:25
[33]Hou X,Zhao M,Wang T,et alUpregulation of estrogen receptor mediates migration, invasion and proliferation of endometrial carcinoma cells by regulating the PI3K/AKT/mTOR pathway[J].Oncol Rep, 2014,31(3):1175
[34]Qin J,Teng J,Zhu Z,et alGenistein induces activation of the mitochondrial apoptosis pathway by inhibiting phosphorylation of Akt in colorectal cancer cells[J]Pharm Biol, 2016,54(1):74
[35]Jiang C C,Yang F,Thorne R F,et alHuman melanoma cells under endoplasmic reticulum stress acquire resistance to microtubuletargeting drugs through XBP1mediated activation of Akt[J].Neoplasia, 2009,11(5):436
[36]Yamazaki H,Hiramatsu N,Hayakawa K,et alActivation of the AktNFkappaB pathway by subtilase cytotoxin through the ATF6 branch of the unfolded protein response[J]J Immunol, 2009,183(2):1480
[37]Endo H,Nito C,Kamada H,et alActivation of the Akt/GSK3beta signaling pathway mediates survival of vulnerable hippocampal neurons after transient global cerebral ischemia in rats[J]J Cereb Blood Flow Metab, 2006,26(12):1479.
[38]Karali E,Bellou S,Stellas D,et alVEGF Signals through ATF6 and PERK to promote endothelial cell survival and angiogenesis in the absence of ER stress[J]Mol Cell, 2014,54(4):559
[39]Snigdhe S,Smith E D,Prieto G A,et al Caspase3 activation as a bifurcation point between plasticity and cell death[J]Neurosci Bull, 2012,28:14
[40]歐阳铭,刘晓柳,张少春,等DXM对大鼠星形胶质细胞P53和Bax表达的影响[J]解剖学研究,2010(6):431
[41]Sadidi M, Lentz S I,Feldman E LHydrogen peroxideinduced Akt phosphorylation regulates Bax activation[J] Biochimie, 2009,91(5):577
[42]Suhara T, Kim H S, Kirshenbaum L A,et alSuppression of Akt signaling induces Fas ligand expression: involvement of caspase and Jun kinase activation in Aktmediated Fas ligand regulation[J]Mol Cell Biol, 2002,22(2):680
[责任编辑张宁宁]
