人参中苯甲酸胁迫响应基因WRKY7的克隆与表达分析
2017-04-05王梓李勇王蓉丁万隆
王梓+李勇+王蓉+丁万隆

[摘要]WRKY转录因子是高等植物中最重要的转录因子基因家族之一,其在植物形态建成、生长发育以及应对生物(病菌、害虫等)、非生物(干旱、盐、冷、热等)胁迫过程中发挥重要作用。该研究根据人参化感自毒物质苯甲酸诱导的人参转录组数据,设计全长扩增引物,利用RTPCR方法获得1条编码WRKY转录因子的基因,暂命名为WRKY7,并对其进行TA克隆、测序和序列分析。该基因cDNA全长1 216 bp,其开放阅读框(open reading frame, ORF)为1 014 bp,编码337个氨基酸。序列分析及系统进化分析表明,该蛋白属于WRKY家族第Ⅲ类成员,与西洋参种的WRKY6转录因子亲缘关系最近,同源性为87%。实时荧光定量PCR分析发现,苯甲酸胁迫后WRKY7的表达量显著升高,推测该基因可能参与了人参响应苯甲酸胁迫的过程,为进一步研究人参自毒胁迫响应的分子机制奠定了基础。
[关键词]人参; WRKY转录因子; 化感自毒作用; 克隆; 序列分析
[Abstract]WRKY transcription factor is one of the most important transcription factor families widely existing in higher plants, which playing critical role in plant morphogenesis, development, biotic (including phytopathogens, pests etc.) and abiotic (drought, salt, chilling, high temperature, etc.) stress. In the present work, primers used to amplify fulllength gene encoding WRKY transcription factor were designed based on the transcriptome data of P. ginseng that induced by benzoic acid, one of the most important autotoxins identified from root exudates and rhizosphere soil of P. ginseng. Then, a WRKY gene, temporarily named as WRKY7, was confirmed by RTRCR. Furthermore, sequencing and sequence analysis of WRKY7 was conducted. Results indicated that, the full length cDNA of WRKY7 was 1 216 bp, the open reading frame (ORF) of which was 1 014 bp, encodes 337 amino acids. Homologous analysis and phylogenetic tree showed that, WRKY7 belonged to the Ⅲ category of WRKY families, which showing 87% similarity to WRKY6 in P. quinquefolius. Realtime PCR results showed that the expression of WRKY7 in P. ginseng induced by benzoic acid was upregulated markedly than the control, so we speculated that WRKY7 was involved in the response to benzoic acid stress, which will be helpful for further research on the molecular mechanism of ginseng plant response to benzoic acid stress.
[Key words]Panax ginseng; WRKY transcription factors; autotoxicity; cloning; bioinformatic analysis
轉录因子是一类含有DNA结合域的蛋白质,能识别基因上游特异的核苷酸序列,形成转录复合体从而激活或抑制靶基因的表达,WRKY是植物十大转录因子家族之一。这类转录因子最早发现于甘薯[1],后相继从20余种植物中分离出WRKY转录因子[2]。WRKY蛋白的共同特点是含有60个氨基酸组成的WRKY结构域,在N端有一段高度保守的WRKYGQK多肽序列,其是WRKY结构域的核心,如果上述氨基酸发生变异,将直接影响WRKY转录因子的DNA结合活性[3]。根据WRKY转录因子结构域的数量和锌指结构,可将WRKY转录因子分为3类[4]:第Ⅰ类含有2个WRKY结构域,其锌指结构为C2H2型;第Ⅱ类含有1个WRKY结构域,其锌指结构为C2H2型;第Ⅲ类含有1个WRKY结构域,其锌指结构为C2HC型。
WRKY转录因子与植物生长发育、衰老及环境胁迫响应密切相关。当植物遭受生物胁迫时,WRKY蛋白通过多通路、多层次调控基因表达,进而调节植物对胁迫信号的转导途径[5]。例如:AtWRKY33超表达可提高拟南芥对灰霉病和黑斑病的抗病性[6]。干旱、高温、物理损伤等非生物胁迫同样可以激发WRKY基因高表达,以帮助植物抵御外界不良环境[7]。例如:拟南芥AtWRKY18,AtWRKY33,AtWRKY40,AtWRKY46表达量增加能提高植株耐热性[8];大豆GmWRKY21过量表达可增强拟南芥的抗寒能力[9]。WRKY转录因子在植物逆境信号传递过程中发挥重要作用,1个WRKY基因往往能响应多种胁迫信号,而多个WRKY基因之间则形成复杂的基因调控网络。
人参是五加科多年生药用植物,连作障碍严重影响人参产量和品质。已有研究表明,苯甲酸对人参具有明显的自毒活性[10]。本课题组前期开展了苯甲酸胁迫下的人参转录组分析,发现了多个与苯甲酸胁迫相关的转录因子基因、过氧化物酶基因、活性氧及人参皂苷合成相关基因。本文在已有研究基础上,利用RTPCR技术克隆获得1条WRKY转录因子基因,暂命名为WRKY7。进而比较了该基因与其他WRKY家族基因的序列结构差异,通过系统进化关系分析了其与已知WRKY蛋白的关系。最终,通过Realtime PCR方法检测了WRKY7在苯甲酸胁迫条件下的表达情况。本文为深入研究转录因子WRKY7的生物学功能奠定了理论基础。
1材料与方法
11植物
取三年生人参幼苗,参考李勇等[11]的配方,用营养液和石英砂培养人参幼苗直至幼苗完全展开。人参苗胁迫处理参考Wu等[12]。分别于处理后第0,1,3,5,7,9天采集对照组和处理组人参根部样品,每次取4株人参幼苗的毛根,混合保存于液氮中。
12试剂
苯甲酸(分析纯,北京化学试剂有限公司);RNA Trizol提取试剂盒(Invitrogen公司);Dnase Ⅰ(RNaseFree)酶、RTase MMLV(RNase H)逆转录酶、Premix Taq酶、2×SYBR Premix Ex Taq酶、pMD18T载体均来自TaKaRa公司;大肠杆菌(Escherichia coli)DH5α感受态细胞(TIANGEN公司);DNA凝胶回收试剂盒、质粒DNA小量提取试剂盒为Axygen公司产品;琼脂糖(Biowest公司);本实验所用引物均由Sunbio公司合成。
13仪器
3K30台式高速冷冻离心机(Sigma);紫外可见分光光度计(Nanodrop2000);基因扩增仪(BIORAD);荧光定量PCR仪(BIORAD);凝胶成像仪(BIORAD);DYY6C电泳仪(北京市六一仪器厂);台式微量冷冻离心机(Beckman);移液器(Drangonlab);高压灭菌锅(华泰医疗设备有限公司);电热恒温培养箱(泰斯特仪器有限公司);超净工作台(亚泰科隆仪器技术有限公司)。
14RNA提取和cDNA合成
取人参根部样品在液氮中研磨,用Trizol法提取人参根部总RNA,用Dnase I(RNaseFree)对产物进行处理,去除RNA中的DNA,并对其进行浓度测定。取上述提取的RNA模板1 μg,加入Random primer 1 μL,再加DEPC水至6 μL,将上述体系混匀后70 ℃孵育10 min,迅速冰浴2 min,加入5×RTase MMLV buffer 2 μL,dNTP(10 mmol·L-1)05 μL,RNase inhibitor 05 μL,RTase MMLV(RNase H)逆转录酶1 μL,25 ℃反应5 min,42 ℃反应60 min,70 ℃保温15 min,即可得到cDNA,-20 ℃保存备用。
15WRKY7基因的扩增和克隆
根据RNAseq拼接数据返回的序列,利用Primer 3(http://primer3utee/)设计引物(表1),扩增基因的完整编码区。以人参cDNA为模板,按照如下体系扩增人参WRKY7基因:cDNA模板1 μL,Premix Taq酶125 μL,10 μmol·L1上下游引物各1 μL,ddH2O 95 μL,终体积为25 μL。扩增程序:95 ℃预变性3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸90 s,30个循环;最后72 ℃延伸5 min,4 ℃保温。PCR产物用1%琼脂糖凝胶电泳检测,Axygen凝胶回收试剂盒用于目的片段的回收。将回收产物5 μL,Ligation solution Ⅰ 5 μL,pMD18T载体05 μL混匀置于4 ℃连接过夜。连接产物转化大肠杆菌DH5α感受态细胞,然后在含有氨苄的LB平板上培养,挑取单克隆,经菌落PCR检测后选择阳性克隆送Sunbio公司测序。
16WRKY7基因的生物信息学分析
用NCBI网站ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)寻找WRKY7基因的编码框。
17实时荧光定量PCR
为了检测人参WRKY7基因的表达情况,利用实时荧光定量PCR方法检测该基因经苯甲酸胁迫诱导后在人参根部的表达量。根据WRKY7基因序列设计实时荧光定量PCR引物,将人参40S核糖体蛋白基因作为内参基因设计引物(表1)。以苯甲酸处理不同时间后所提取的人参RNA反转录cDNA为模板,荧光定量PCR检测。反应体系20 μL,包括:2×SYBR Premix Ex Taq 10 μL,10 μmol·L-1上下游引物各1 μL,cDNA 2 μL,ddH2O 6 μL 。每个体系至少重复3次。扩增程序:95 ℃预变性3 min;95 ℃变性15 s,59 ℃退火15 s,72 ℃延伸15 s,40个循环;最后60 ℃延伸5 s,4 ℃保温。
2结果与分析
21人参WRKY7基因的克隆
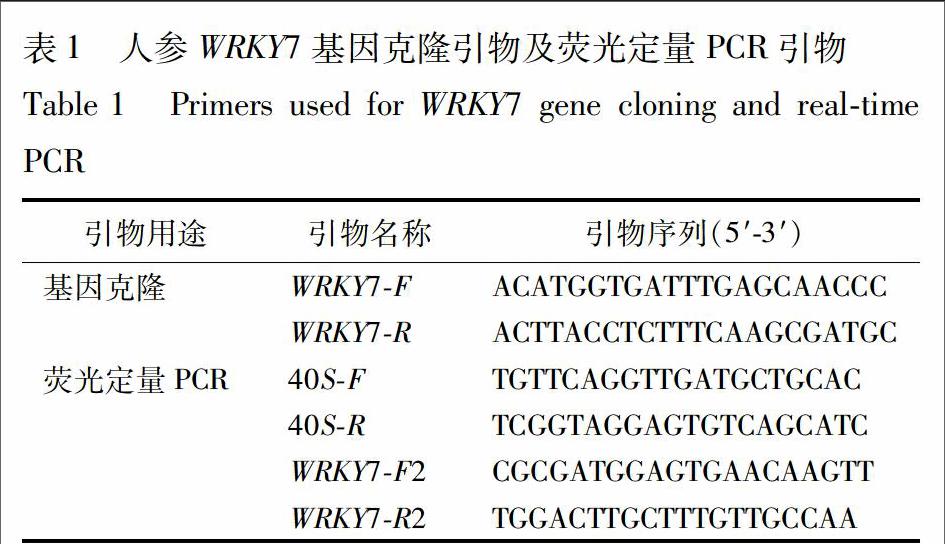
通过将处理组植物RNA送到公司建库和生物信息学分析,从人参转录组数据中发现1条2 053 bp的转录本,功能注释为WRKY转录因子,推测其与苯甲酸胁迫响应相关。分析发现,该转录本含有1个完整的开放阅读框(open reading frame,ORF)。根据ORF序列设计基因全长扩增引物WRKY7F和WRKY7R,以苯甲酸胁迫不同时间的反转录cDNA为模板,经PCR扩增得到1条长1 216 bp条带(图1)。测序结果经ORF Finder分析,确定其開放阅读框为1 014 bp,编码337个氨基酸。为区别已知人参WRKY基因,将扩增出的基因暂命名为WRKY7(GenBank登录号 KX255632)。
22人参WRKY7基因编码蛋白质特性分析
221人参WRKY7编码氨基酸序列分析通过NCBI开放阅读框分析表明其ORF为1 014 bp,蛋白质预测其编码337个氨基酸。其中第129~132位分别为色氨酸(W),精氨酸(R),赖氨酸(K),酪氨酸(Y),符合WRKY基因家族标志性结构,其下游有典型的“C2HC”型锌指结构,说明该蛋白属于WRKY家族第Ⅲ类。
222WRKY7编码蛋白理化性质分析利用ExPASy Proteomics Server提供的在线软件Protparam预测WRKY7编码蛋白的理化性质。WRKY7编码蛋白由337个氨基酸编码,分子式为C1669H2619N463O539S14,总原子数为5 304。相对分子质量38243 7 kDa,理论等电点pI为563,带正电残基(Arg+Lys)为39,带负电残基(Asp+Glu)为46。该蛋白的不稳定系数为4798,表明WRKY7编码蛋白不稳定。脂肪系数为6564,总平均亲水性系数为-0741。
223WRKY7编码蛋白二级结构分析及功能结构域分析利用SPOMA对WRKY7编码蛋白进行二级结构分析。WRKY7编码蛋白二级结构中α螺旋(alpha helix)占2255%、延伸链(extended strand)占2255%、β折叠(beta turn)占712%、无规卷曲(random coil)占4777%。InterProScan分析发现,WRKY7编码蛋白含有1个保守的WRKY结构域(WRKY domain,IPR003657),位于第114~186位氨基酸残基(图2)。
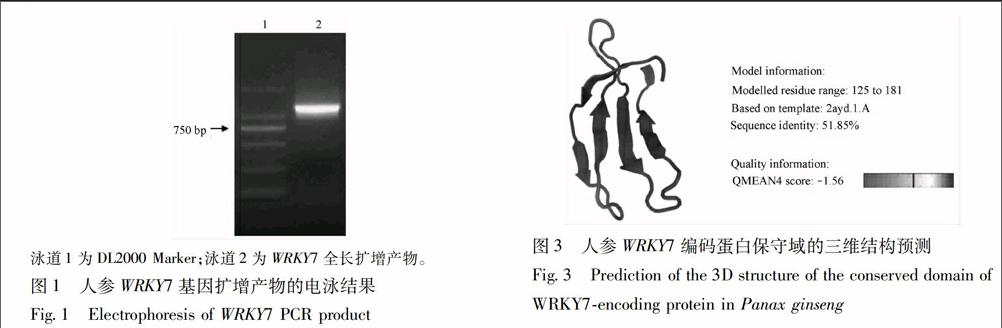
224WRKY7编码蛋白三维建模用SWISSMODEL三维建模工具作图,以拟南芥WRKY transcription factor 1为模板(PDB id:2ayd),对人参WRKY7编码蛋白进行三维结构建模,预测其空间结构(图3)。
225WRKY7编码蛋白信号肽、亚细胞定位、跨膜预测分析利用SignalP40 Server预测WRKY7编码蛋白不具有信号肽。利用在线工具WOLF PSORT预测该蛋白的亚细胞定位情况,结果显示其细胞核的定位系数为13(nucl:13),表明该蛋白最可能定位于细胞核。TMHMM Server V20预测结果表明,WRKY7编码蛋白无跨膜区。
226WRKY7基因序列相似性分析同源性分析结果显示,发现该基因序列与人参Pginseng WRKY6(KT2775471)有87%的相似度;与西洋参P quinquefolius WRKY6(JF9271621),WRKY9(JF9271651)也有87%的相似度;与杭菊Chrysanthemum morifolium WRKY3(KC2922151),WRKY9(KC6153631)有75%的相似度;与大豆Glycine max WRKY60(NM_0012517481)有75%的相似度。WRKY7编码的氨基酸序列在NCBI中分析发现,该蛋白与人参P ginseng相似性最高(82%,ALS204001),其次为西洋参P quinquefolius(81%,AEQ290191),龙眼Dimocarpus longan(51%,AEO314762),胡杨Populus euphratica(51%,XP_0110378711),葡萄Vitis aestivalis(51%,AAR924771)等。
227氨基酸多序列比对及系统进化树分析从NCBI比对结果中选出9条与WRKY7编码蛋白同源性较高的氨基酸序列,经多序列比对分析发现,其与人参、西洋参WRKY基因有着广泛的相似度,其N端含有WRKY家族标志性片段WRKYGQK,C端锌指结构为CX7CX23HX1C(图4)。说明其属于WRKY家族第Ⅲ类转录因子。上述基因的WRKY结构域高度保守,其他区域的可变性较高。
红色为相对保守的氨基酸残基;蓝色为保守度低的氨基酸残基;灰色为残基数量无法完全匹配的序列;少于50%的序列无法匹配的部分用大写字母表示,多于50%的序列无法匹配的部分用小写字母表示。
为进一步了解人参WRKY7与其他WRKY家族成员的系统进化关系,从NCBI数据库下载了其他19个物种23条WRKY家族成员的蛋白序列,Mega 70绘制的NeighborJoining系统进化树显示,人参WRKY7与西洋参PqWRKY6、PqWRKY9亲缘关系最近(图5)。这暗示着它们可能具有相似的生物学功能。
23苯甲酸胁迫下人参WRKY7基因的表达分析
为验证人参WRKY7在苯甲酸胁迫下的表达情况,对该基因进行了诱导表达分析(图6)。其中0 d样品为混样,对照组和处理组共用一个。结果显示,苯甲酸胁迫诱导后WRKY7的表达水平明显上调,在第5天和第9天时表达量最高。同时与对照相比,处理组的表达量在第3,5,9天时分别是对照组的
3讨论
植物WRKY转录因子基因以家族的形式存在,作为一种重要的诱导型调节因子,参与多种植物抗逆反应及生长发育与生理生化代谢过程。目前,WRKY转录因子已被证明参与了植物响应生物胁迫[13]、非生物胁迫[14]、生长发育[15]、衰老[16]等生理过程。当植物受到外源物质胁迫时,植物细胞膜上某些受体会被识别,进而激活促分裂原激活蛋白激酶信号通路,通过磷酸化或去磷酸化将胞外信号传导入细胞核内,抑制或激活WRKY转录因子的表达[17],进而与下游目标基因启动机子区的Wbox进行特异性结合[18],从而调控目标基因的表达。
本研究通过对苯甲酸胁迫人参转录组的生物信息学分析,从中发现了一个WRKY转录因子基因WRKY7,其与人参WRKY6基因(KT2775471)相似度为87%,所编码的氨基酸序列相似度为82%。氨基酸序列分析发现,WRKY7有一个高度保守的WRKY结构域,下端锌指结构为CX7CX23HX1C,属于′C2HC′型,为WRKY家族的第Ⅲ类。该基因与拟南芥AtWRKY53有较高的同源性,AtWRKY53被报道受到干旱[19]、机械损伤[20]等诱导,故而推测人参WRKY7基因可能也具有类似功能。研究发现,苯甲酸胁迫后人參WRKY7基因的表达水平显著上调,暗示其在人参响应自毒物质胁迫过程中扮演重要角色。WRKY7有可能进一步启动了下游抗逆基因的表达,从而提高了植物对苯甲酸胁迫的耐受性。
目前,针对人参化感自毒作用分子机制的研究尚处于起步阶段,本课题组前期通过分析化感自毒物质诱导下人参转录组数据的差异,发现了大量与人参生长发育、抗病抗逆等密切相关的差异性表达基因,但对于这些转录组数据的挖掘还不够深入,对于关键基因响应化感自毒物质的通路尚不明确。WRKY作为参与植物非生物胁迫响应的一类重要转录因子,其在响应自毒胁迫中的作用值得关注。本研究后续将构建过量表达载体,并将WRKY7基因转入拟南芥,通过重组体筛选及胁迫测验,进一步研究该基因的生物学功能。同时会继续对已获得的转录组数据进行深入分析,探究不同转录因子基因在苯甲酸胁迫下的生物调控网络,为深入阐释人参响应化感自毒物质的信号转导途径,以及自毒胁迫响应的分子机制提供理论依据。
[参考文献]
[1]Ishiguro S, Nakamura K Characterization of a cDNA encoding a novel DNAbinding protein, SPF1, that recognizes SP8 sequences in the 5′ upstream regions of genes coding for sporamin and betaamylase from sweet potato[J] Mol Gen Genet, 1994, 244(6):563
[2]Wu K L, Guo Z J, Wang H H, et al The WRKY family of transcription factors in rice and Arabidopsis and their origins[J] DNA Res, 2005, 12(1):9
[3]Ross C A, Liu Y, Shen Q J, et al The WRKY gene family in rice (Oryza sativa)[J] J Integr Plant Biol, 2007, 220(6):827
[4]Eulgem T, Rushton P J, Robatzek S, et al The WRKY superfamily of plant transcription factor[J] Trends Plant Sci, 2000, 5(5):199
[5]Eulgem T Regulation of the Arabidopsis defense transcriptome[J] Trends Plant Sci, 2005, 10(2):71
[6]Zheng Z, Qamar S A, Chen Z, et al Arabidopsis WRKY33 transcription factor is required for resistance to necrotrophic fungal pathogens[J] Plant J Cell Mol Biol, 2006, 48(4):592
[7]lker B, Somssich I E WRKY transcription factors: from DNA binding towards biological function[J] Curr Opin Plant Biol, 2004, 7(5):4919
[8]Suzuki N, Shulaev V, Mittler R Enhanced tolerance to environmental stress in transgenic plants expressing the transcriptional coactivator multiprotein bridging factor 1c[J] Plant Physiol, 2005, 139(3):1313
[9]Zhou Q Y, Tian A G, Zou H F, et al Soybean WRKYtype transcription factor genes, GmWRKY13, GmWRKY21, and GmWRKY54, confer differential tolerance to abiotic stresses in transgenic Arabidopsis plants[J] Plant Biotechnol J, 2008, 6(5):486
[10]黃小芳 人参根系分泌物及其自毒活性研究[D] 北京:北京协和医科大学, 2009
[11]李勇, 黄小芳, 丁万隆 营养元素亏缺对人参根分泌物主成分的影响[J] 应用生态学报, 2008, 19(8):1688
[12]Wu B, Long Q L, Gao Y, et al Transcriptome response of Panax ginseng roots, stems and leaves exposed to benzoic acid revealed the molecular mechanism of autotoxicity[J] BMC Genomics, 2015, 16:1010
[13]Peng X X, Tang X K, Zhou P L, et al Isolation and expression patterns of rice WRKY82 transcription factor gene responsive to both biotic and abiotic stresses[J] Agr Sci China, 2011, 10(6):893
[14]冉昆, 王少敏, 魏树伟, 等 植物非生物胁迫相关的WRKY转录因子研究进展[J] 青岛农业大学学报, 2014, 31(3):217
[15]徐文静 WRKY转录因子在水稻生长发育及与白叶枯病菌互作中的表达研究[D] 保定:河北农业大学, 2012
[16]Miao Y, Laun T, Zimmermann P, et al Targets of the WRKY53 transcription factor and its role during leaf senescence in Arabidopsis[J] Plant Mol Biol, 2004, 55(6):853
[17]Kim C Y, Zhang S Activation of a mitogenactivated protein kinase cascade induces WRKY family of transcription factors and defense genes in tobacco[J] Plant J, 2004, 38(1):142
[18]Laloi C, MestresOrtega D, Marco Y, et al The Arabidopsis cytosolic thioredoxin h5 gene induction by oxidative stress and its Wboxmediated response to pathogen elicitor[J] Plant Physiol, 2004, 134(3):1006
[19]Sun Y, Yu D Activated expression of AtWRKY53 negatively regulates drought tolerance by mediating stomatal movement[J] Plant Cell Rep, 2015, 34(8):1
[20]Yong H C, Sheng L Transcriptional profiling reveals novel interactions between wounding, pathogen, abiotic stress, and hormonal responses in Arabidopsis[J] Plant Physiol, 2002, 129(2):66
[責任编辑吕冬梅]
