质量守恒定律考点例谈
2017-04-01陈继清
陈继清

考点一考查对质量守恒定律的理解
例1以下应用守恒思想解决相关问题,推论正确的是()。
A.14 g碳与32 g氧气反应,根据质量守恒推出生成的二氧化碳的质量为46 g
B.聚乙烯燃燒生成二氧化碳和水,根据元素守恒推出聚乙烯由碳、氢、氧元素组成
C.细铁丝在氧气中燃烧后,生成物质量比细铁丝的质量大,因此这个反应不遵守质量守恒定律。
D.水电解生成H2和O2的分子数比为2∶1,根据原子守恒推出水分子中H、O原子数比为2∶1
解析A中14 g碳与32 g氧气反应,需先判断14 g碳与32 g氧气是否全部反应,根据化学方程式算出碳与氧气恰好完全反应的质量比为12∶32,对比质量比发现14 g碳只反应了12 g,剩余2 g没有参加反应,所以生成的二氧化碳的质量为44 g,不是46 g,A错误;B中聚乙烯燃烧,是聚乙烯与氧气反应,氧气由氧元素组成,生成二氧化碳和水,生成物含碳、氢、氧三种元素,消去氧元素,根据元素守恒推出聚乙烯一定含有碳、氢元素,不能推出聚乙烯由碳、氢、氧元素组成,B错误;C中根据质量守恒定律,生成物质量等于参加反应的细铁丝和氧气质量总和,所以生成物质量比细铁丝的质量大,遵守质量守恒定律,C错误;D中水电解生成H2和O2的分子数比为2∶1,而每个氢分子和氧分子分别由两个氢原子和两个氧原子构成,根据反应前后原子种类和数目不变,推出水分子中H、O原子数比为2∶1,D正确。
答案:D
点评该例题考查了对质量守恒定律的如下理解:“参加反应”是指真正参与反应的那一部分质量,如果反应物没有全部参加反应,则剩余部分不能计算在内;反应前后元素守恒,是指所有反应物所含元素与所有生成物所含元素种类相同,不是其中一种反应物所含元素与所有生成物所含元素相同;根据质量守恒定律计算时,不能漏掉任何一种反应物或生成物的质量,否则,就会出现“表面不守恒”现象;化学反应前后原子的种类、数目、质量均不变。
考点二质量总和守恒结合化学方程式计算
例2在一个密闭容器内有四种物质,在一定条件下充分反应后,测得反应前后各物质的质
可转化为碳酸氢钠:
Na2CO3+CO2+H2O2NaHCO3
2.NaHCO3转化为Na2CO3
(1)在碳酸氢钠溶液中加入适量的NaOH溶液,碳酸氢钠可转化为碳酸钠:
NaHCO3+NaOHNa2CO3+H2O
(2)将碳酸氢钠固体加热至恒重,碳酸氢钠可转化为碳酸钠:
量见表1:
表1
物质XYZQ
反应前质量/g410121
反应后质量/g01215待测
已知X的相对分子质量为n,Q的相对分子质量为2n,下列推理正确的是( )。
A. 反应后Q的质量为9 g
B. 反应后生成15 g Z
C. 反应中Y与Q发生改变的质量比为1∶1
D. 该反应方程式X与Q的化学计量数之比为2∶3
解析先根据质量总和守恒,立式,4+10+1+21=0+12+15+Q(待测),算出Q(待测)=9;然后根据反应后与反应前的质量变化,判断反应物和生成物,
X、Q质量减少是反应物,Y、Z质量增加是生成物;同时求出变化量,从而知道X、Y、Z、Q四物质间质量比为4∶2∶14∶12,Y与Q的质量比为2∶12=1∶6,C错误;利用化学方程式计算质量比的方法,可以求出X与Q的化学计量数之比为:4/n∶12/2n=2∶3,D正确。
答案:D
点评该题把根据质量守恒定律计算物质质量和利用化学方程式计算各物质间质量比结合起来考查。
考点三、质量守恒结合化学方程式、化学式计算
例3物质R在0.96 g氧气中恰好完全燃烧:
R+3O2点燃XO2+2SO2
测得XO2和SO2的质量分别为0.44 g和1.28 g。下列判断正确的是()。
A.参加反应的R的质量为0.86 g
B.R的相对分子质量为76
C.R中含有X元素、硫元素和氧元素
D.XO2和SO2都是形成酸雨的主要物质
解析根据质量守恒定律,R的质量=
0.44 g+1.28 g-0.96 g=0.76 g,A错误;同时可知R、O2、XO2、SO2四种物质间质量比为0.76 g∶0.96 g∶0.44 g∶1.28 g=76∶96∶44∶128,利用化学方程式根据质量比,R的相对分子质量:3×16×2=76∶96可以算出R的相对分子质量=76,B正确;同理,算出XO2的相对分子质量为44,并且用化学式XO2算出X的相对原子质量为12,推知X为碳元素,XO2为CO2,D错误;再利用化学式计算m(X)=0.44 g×12/44=0.12 g,m(S)= 1.28 g×32/128=0.64 g,m(X)+m(S)=0.12 g+0.64 g=0.76 g,等于R的质量,根据元素质量守恒,可以推知R中只含有X元素、硫元素不含氧元素,C错误。
答案:B
点评本题先根据质量守恒定律计算出R的质量,然后利用化学方程式和化学式计算,综合程度较高。
考点四、质量守恒结合微观模式图计算
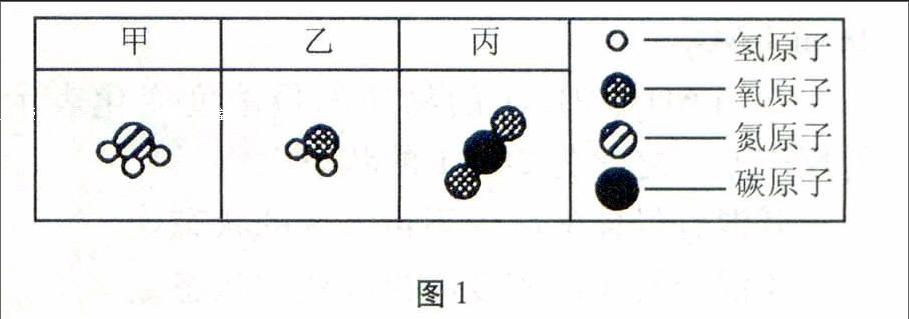
例4地球大气的演化经历了原始大气、次生大气和现代大气三个阶段,次生大气中部分成分的微观示意图如图1所示:
图1
一定条件下,3.4 g甲物质和4.8 g氧气恰好完全反应,生成5.4 g乙物质和另一种物质X,下列判断不正确的是()。
A.物质甲的化学式是NH3
B.物质X的质量为2.8 g
C.物质X中含两种元素
D.该反应化学方程式中物质X与O2的化学计量数之比为2∶3
解析由微观示意图推知,甲物质的化学式是NH3,乙物质化学式为H2O,A正确;根据质量守恒定律,物质X的质量=3.4 g+4.8 g-5.4 g=2.8 g,B正确;通过化学式计算,甲物质中含m(H)=3.4 g×3/17=0.6 g,乙物质中含m(H)=5.4g×2/18=0.6g,含m(O)=5.4 g×16/18=4.8 g,根据元素种类和质量守恒,推知物质X中只含有氮元素,化学式为N2,C错误;利用化学方程式求各物质间质量比的方法,已知物质X与O2的质量比为2.8 g∶4.8 g=28∶48,物质X与O2的化学计量数之比=28/28∶48/32=2∶3,D正确。
答案:C
点评本题利用微观示意图提供信息,应用质量守恒定律结合化学式和化学方程式计算,复杂性明显提高。另外,用大气演化反应出题,增加了题目趣味性。
(收稿日期:2016-11-15)
