喷泉实验新花样
2017-03-31秦嵩博
秦嵩博


氨气的喷泉实验是一个很基础也很有趣的演示实验,老师上课演示时引起了我极大的兴趣。
该实验的原理为:氨气在水中溶解度很大,在短时间内使烧瓶内的气压减小,打开活塞后,大气压将烧杯内的液体压入烧瓶中,在尖嘴导管口形成喷泉。
在观察实验的同时,我也有了一些自己的思考。
1.该喷泉实验的原理与生活中见到的喷泉原理一样吗?若不一样,能否将生活噴泉的原理搬到化学实验中?
2.老师在课堂演示时会出现实验失败的情况,这是为什么?有什么方法可以提高实验的成功率?
3.除了单一的红色喷泉,能否形成其他颜色的喷泉?如果可以应选用哪些药品?能否设计出彩虹般的喷泉?
4.作为喷泉实验原料的气体的溶解度应是多少?难溶或不溶性气体能否形成喷泉?
5.如何改进和创新喷泉实验的装置?能否设计出双喷泉甚至三喷泉?
6.实验中有哪些因素会影响喷泉的效果?
由此,我进行了以下探究。
一、生活喷泉与化学喷泉
课堂上演示的喷泉实验是减小烧瓶内的气压并在外界大气压的作用下形成的喷泉,而广场上多姿多彩的喷泉是增大内部气压,在正常大气压下形成的,原理与火山喷发类似。于是,我通过以下实验模拟生活中形成的喷泉。
实验一:利用MnO2加快H2O2分解,增大烧瓶内的压强,使其在空气中形成喷泉。
1.先关闭导管上的止水夹,向烧瓶中放入MnO2,分液漏斗中装H2O2,快速塞紧胶塞,打开分液漏斗,使烧瓶中快速聚集O2,气压增大。
2.一段时间后,打开止水夹,烧瓶中的水在高压作用下喷出,在导管的出口处形成喷泉(装置如图1所示)。
实验二:加热氨水,使烧杯内压强增大,从而形成喷泉,步骤如下。
1.先关闭止水夹,给盛有浓氨水的烧瓶加热,使浓氨水分解成氨气和水。
2.待瓶内气体大量聚集后,气压增大到一定程度时打开止水夹,让液体顺着导管喷出,形成喷泉,实验装置如图2所示。
二、喷泉实验的改进和创新
课本中喷泉实验形成的喷泉只能持续一小会儿,并且只有一个喷泉,形式单一。根据该实验原理,我设计了新的装置,实验过程中能出现双喷泉,让喷泉实验更精彩。
1.持久性喷泉
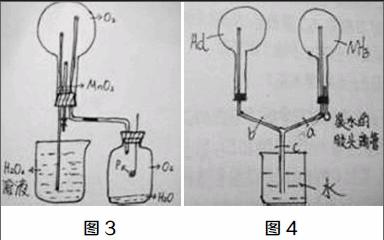
(1)制备一烧瓶O2,如图3组装装置。
(2)用放大镜聚光使磷燃烧,消耗O2。
(3)烧瓶内压强减小,H2O2溶液进入烧瓶中形成喷泉,H2O2溶液与MnO2反应再生成O2,如此不断循环。
(4)当溶液反应到一定程度时,打开止水夹,使水流下。
2.喷烟和双喷泉实验
(1)制取一烧瓶氨气和一烧瓶HCl,如图4连接装置。
(2)关闭止水夹c,挤压胶头滴管,烧瓶中氨气部分溶解,压强减小,打开a、b,HCl被压入盛有NH3的烧瓶中,形成喷烟现象。
(3)打开止水夹c,由于两个烧瓶中压强都小于大气压,因此形成双喷泉。
3.彩色喷泉
课本中利用氨气和滴有酚酞的水形成红色的喷泉,我在惊叹其美丽的同时,也因其颜色单一而感到乏味。于是我通过查阅资料,确定三种方案设计出多种颜色的喷泉。
第一种方案:烧瓶中由装一种气体改装两种或多种气体。这些气体互不反应,却能与同一种液体反应生成不同颜色的物质而形成彩色喷泉。
第二种方案:烧杯中由盛一种溶液改盛几种互不反应的溶液,而烧瓶中只盛一种气体,且这种气体能与上述几种溶液反应生成不同颜色的物质而形成彩色喷泉。
第三种方案:用烧瓶装几种互不反应的气体,烧杯中也装几种互不反应的液体,且这几种气体能与上述几种溶液反应生成不同颜色的物质而形成彩色喷泉。
选择HCl、NH3、Cl2、CO2作为实验气体,再通过选择不同的实验溶液,达到形成彩色喷泉的效果。
(1)用一个干燥的圆底烧瓶收集足量的实验用气体。
(2)用带有三根玻璃管(一端成尖嘴状,且尖嘴状一端应插入烧瓶内)的塞子塞紧瓶口,倒置烧瓶,三根玻璃管的末端分别插入盛有实验需用的三种不同试剂溶液的酸奶瓶里。
(3)三人同时挤压酸奶瓶,由于烧瓶内的气体极易溶于上述三种溶液中,使烧瓶内压强减小,酸奶瓶内溶液由玻璃管进入烧瓶,从而形成多种颜色的彩色喷泉。
(4)更换烧瓶内的气体与酸奶瓶中的溶液,以产生更多的彩色喷泉。
实验所用的气体、溶液、喷泉的颜色、变色的原因如下表。
