例谈高三化学习题课讲解策略
2017-03-31王龙耀
王龙耀
摘要:习题能巩固所学知识,检测学生学习的效果,能补救学生学习上的“漏洞”,如果教师就题论题,形式单一,教师讲得累,学生听得烦,學生疲劳做题,练而无获。反之,将习题问题化,将问题知识化、再将知识问题化、知识综合化,能提高课堂效率,更有助于提高学生综合应用能力。
关键词:习题问题化;问题知识化;知识问题化;问题综合化
中图分类号:G633.8 文献标识码:A 文章编号:1992-7711(2017)04-044-1
习题是检测学生学习能力高低的一种重要形式,习题能考查学生对所学知识的理解和运用能力,习题课能帮助学生进行考点分析,订正错误,整合知识,反思与总结,教师虽不能简单地对答案,但习题课教师讲得太细、太碎,不利于学习能力的提高,面对精编的习题,面对同一班级不同学习层次的学生,既要关注后进生的学习程度,也要顾及学习程度较好的学生,教师的课堂讲解技巧尤为重要,高三化学习题综合性强,教师应帮助学生分析问题的切入点,帮助学生掌握最佳解题途径。
一、习题问题化
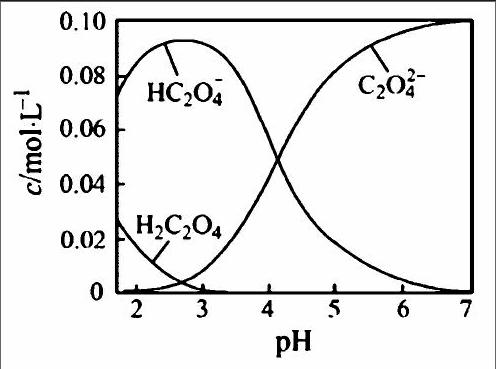
高三试题往往侧重综合能力的考查,试题思维容量大,涉及知识面广,前前后后知识点联系多,对学生能力要求高,如果教师就题论题,形式单一,教师讲得累,学生听得烦,不利于学习能力的提高,将综合性的题目分成若干小问题,即习题问题化,能增加题目的趣味性,学生能找出自己的错误,分析错误原因,提升自身的解题能力。例如:(2016江苏高考14)H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+c(HC2O-4)+c(C2O2-4)=0100mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是:
该题以NaOH溶液滴定、H2C2O4溶液的滴定为载体,考查了弱电解质的电离、溶液的酸碱性、溶液中盐的水解、离子浓度大小比较等重要知识点,综合考查了学生对电解质溶液基本原理的理解和分析解决问题的能力。剖析如此类型的综合题型,不妨将习题进行问题化,将涉及考查的知识点分成若干个小问题,化解讲解难度,分层次,由易到难,引导学生培养解题的兴趣,掌握解题的常规思路,帮助学生避免知难而退的心理的出现,该习题可设计成这么几个问题:1.怎样读图:横坐标、纵坐标的含义,曲线变化的含义,2.电荷守恒,3.水解的离子、水解规律,4.物料守恒,5.质子守恒。
二、问题知识化
所谓问题知识化,也就是将分割出的小问题进行系统分析相关的知识点,让学生储存必备的基础知识,如上题中电荷守恒,为任何电解质溶液中都一定存在的问题,原理是什么,溶液中阳离子所带正电荷的物质的量与阴离子所带负电荷的总物质的量相等,怎样列关系式,帮助学生理顺相关知识,掌握相关解题技巧,理解水解规律:有弱才水解,无弱不水解,越弱越水解,都弱双水解,谁强显谁性,同强显中性。抓住物料守恒特征,溶液中某一组分的原始浓度应该等于它在溶液中各种存在形式的浓度之和。也就是元素守恒,变化前后某种元素的原子个数守恒。熟练运用质子守恒:水电离的H+和OH-数相等。
三、知识问题化
当教师引导学生基本掌握若干知识小点,不妨设计与之相关的具有“短、平、快”特点的习题进行知识点的巩固,也就是将知识再进行问题化,为问题综合化作准备。例如:(2016江苏高考14)B选项解答,需依据溶液中电荷守恒和物料守恒分析,代入计算得到结论,设计小题时,应考虑溶液中电荷守恒和物料守恒的综合应用的小题设计,如:请写出0.1mol·L-1的Na2CO3溶液中各离子浓度的关系,溶液呈电中性可知:c(Na+)+c(H+)=2c(CO2-3)+c(OH-)+c(HCO-3),物料守恒:c(Na+)=2c(CO2-3)+2c(HCO-3)+2c(H2CO3),质子守恒:c(H+)+c(HCO-3)+2c(H2CO3)=c(OH-)。
四、问题综合化
当我们在进行课堂预设的时候,将综合习题分层次、分知识点进行讲解,虽能引导学生由易到难掌握相关知识,但不能保证知识的系统性,需要将支离破碎的问题进行重整,引导学生自己归纳,明确这些知识点在理解和运用时有哪些注意点,解题的突破口在哪里,如何从题干材料获取有用的信息,整合知识,形成自身的学科素养,解一道题,能通一类题,以不变应万变,如01mol·L-1的Na2CO3溶液中离子浓度大小关系,通过三大守恒可整合为离子浓度大小:c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3)>c(H+)。
杜威曾说:“教学绝对不仅仅是简单地告诉,教学应该是一种过程的经历,一种体验,一种感悟。”习题练、评,师生有不同的感悟,教师更多的应为学生矫正学习知识过程的错误感悟,分析错误原因,反思与总结,对某知识点从多个侧面、多个角度进行合理发散,提高学生的综合实力。
