悬浮培养与传统工艺两种方法制备猪口蹄疫疫苗的质量比较
2017-03-30贾智丽
贾智丽
(包头轻工职业技术学院, 内蒙古包头014035)
悬浮培养与传统工艺两种方法制备猪口蹄疫疫苗的质量比较
贾智丽
(包头轻工职业技术学院, 内蒙古包头014035)
为比较悬浮培养与转瓶培养生产的猪口蹄疫疫苗的质量,通过病毒含量测定、灭活检验、内毒素含量测定、成品理化性状、无菌检验、安全检验、效力检验等方面开展试验,以比较两种工艺的优缺点。根据试验结果得出,经细胞悬浮培养后获得的病毒含量、制备疫苗效价都有明显提高,中间产品内毒素含量值有大幅降低,在实际接种动物后,会大大降低副反应发生率,同时疫苗的免疫效价以及持续期均会有所升高。表明,悬浮培养工艺的疫苗质量高于转瓶培养工艺。
口蹄疫; 疫苗; 细胞悬浮培养; 转瓶培养
口蹄疫(FMD)是由口蹄疫病毒(FMDV)引起的一种动物性传染病,表现为急性、热性和高度接触性。在我国,口蹄疫属于一类动物传染病。本试验通过对转瓶培养和全悬浮细胞培养生产的猪口蹄疫疫苗进行质量检验,来比较两种工艺下疫苗质量的优缺点,从而为口蹄疫疫苗生产的升级换代提供可靠的实验依据。
1 材料与方法
1.1 毒种 制造及检验用毒种为猪口蹄疫O型病毒OZK/93株和OR/80株。疫苗制造用毒种为乳鼠毒经BHK21细胞传代适应的细胞毒;检验用毒种为OZK/93株和OR/80株乳鼠毒,均由中国农业科学院兰州兽医研究所国家口蹄疫参考实验室鉴定、保管和提供。
1.2 动物 2~3日龄健康乳鼠(清洁级),无口蹄疫抗体的30~40日龄的健康易感仔猪,体重约(18~22)g健康小鼠(清洁级),体重(350~450)g豚鼠。
1.3 试剂 内毒素检测用标准品批号为201174、鲎试剂批号为1202022,由广东湛江安度斯生物有限公司提供;ELISA检测用O型口蹄疫抗体液相阻断检测试剂盒,批号为2012031601,由中国农业科学院兰州兽医研究所提供。
1.4 方法
1.4.1 病毒含量测定 按猪口蹄疫O型灭活疫苗(OZK/93株+OR/80株)制造及检验规程,TCID50测定,用细胞维持液将生产毒液作10倍系列稀释,培养观察48~72 h,根据CPE产生情况按Reed-Muench法计算TCID50,每0.1mL病毒含量OZK/93株应不低于107.0TCID50;OR/80株应不低于107.0TCID50。LD50测定,用PBS或细胞维持液将生产毒液作10倍系列稀释,取10-6、10-7、10-83个稀释度,每个稀释度颈背部皮下接种2~3日龄乳鼠4只,每只注射0.2 mL。观察3~5 d,根据发病死亡乳鼠数按Reed-Muench法计算LD50,每0.2 mL病毒含量,OZK/93株应不低于107.5LD50;OR/80株应不低于107.0LD50。
1.4.2 灭活检验 按猪口蹄疫O型灭活疫苗(OZK/93株+OR/80株)制造及检验规程,灭活液原样接种乳鼠后,观察7 d不得出现口蹄疫症状和死亡。盲传乳鼠观察5 d不得出现口蹄疫症状和死亡。将灭活液注射仔猪2头,每头耳根后分点注射共5 mL。仔猪观察10 d,不得出现口蹄疫症状和死亡。
1.4.3 内毒素含量测定 按《中华人民共和国兽药典》2010版[1]检验,内毒素含量应≤50EU/mL。
1.4.4 成品理化性状检验 外观性状、剂型、稳定性、黏度检验,符合检验规程。
1.4.5 无菌检验 按《中华人民共和国兽药典》2010版三部[1]检验。
1.4.6 安全检验 按猪口蹄疫O型灭活疫苗(OZK/93株+OR/80株)制造及检验规程,用体重(350~450)g的豚鼠2只,皮下注射疫苗2.0 mL;用体重((18~22)g的小鼠5只,每只皮下注射疫苗0.5 mL。连续观察7 d,均不得出现因注射疫苗引起的死亡或明显的局部不良反应或全身反应。用30~40日龄的健康易感仔猪2头,各两侧耳根后肌肉分点注射疫苗2头份疫苗,逐日观察14 d,均不得出现口蹄疫症状或明显的因注射疫苗引起的毒性反应。
1.4.7 效力检验 按猪口蹄疫O型灭活疫苗(OZK/93株+OR/80株)制造及检验规程,根据免疫猪的保护数,按Reed-Muench法计算疫苗对攻毒株的免疫效力,每头份疫苗各应至少含3PD50。
2 结果
2.1 病毒含量结果 分别用10个批次的OR和OZK毒株对转瓶培养细胞和悬浮培养细胞进行接毒,收毒后,记录病毒液收获时间、CPE(致细胞病变效应)比率,经冻融2次后,分别测LD50和TCID50的数值,进行比较。结果见表1。
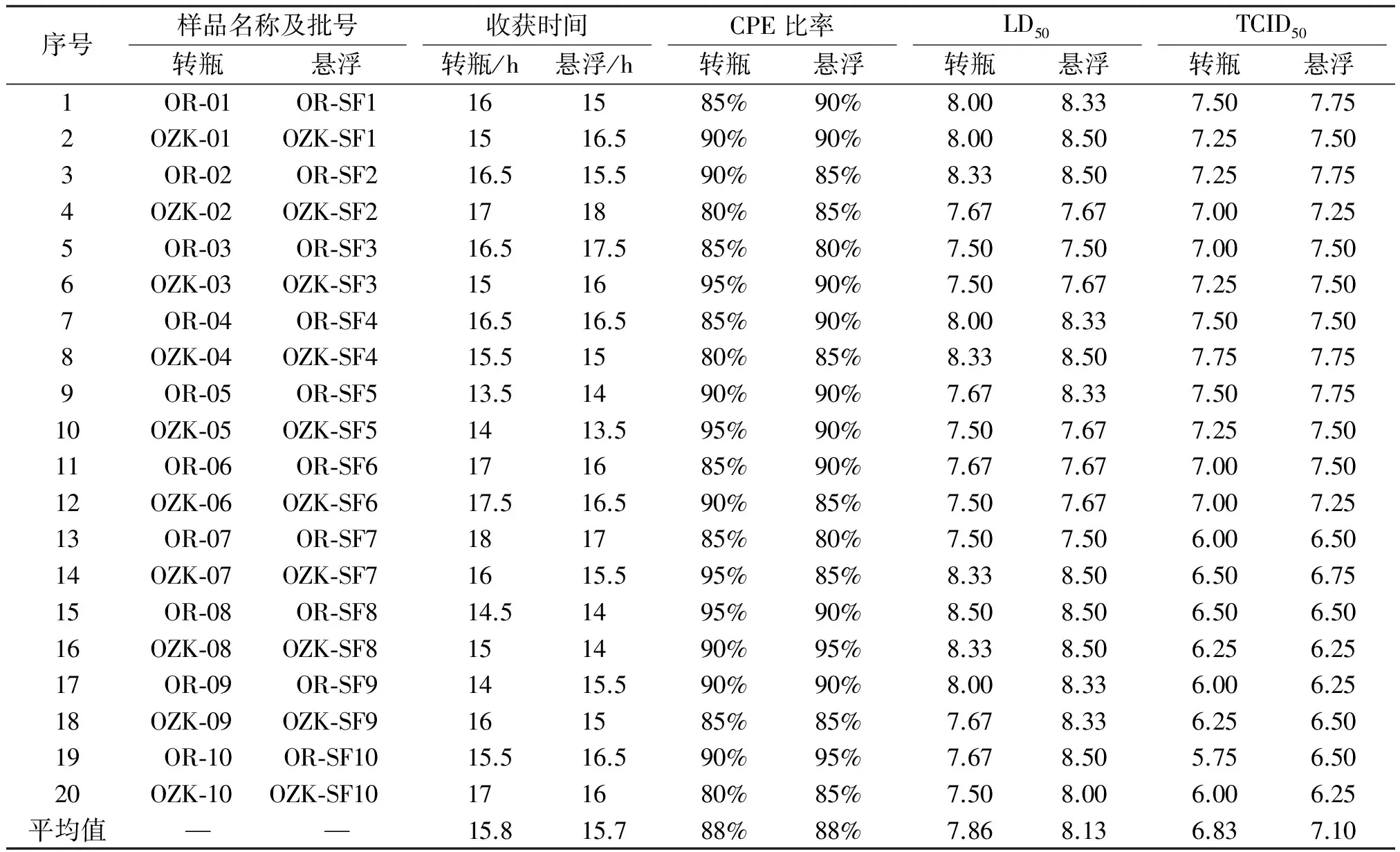
表1 病毒含量结果
在两种细胞培养方式下,病毒液的收获时间基本上一致,均保持在13.5~18 h之间,病变比率也基本一致,在80%~95%之间,LD50和TCID50则略有所变化,表现为悬浮培养后的LD50和TCID50值均比转瓶培养时高0.27。说明悬浮培养相对转瓶培养而言,总体上对毒液的毒价提升起到了一定作用。
2.2 病毒液灭活检测结果 将不同生产方式下所得灭活后的病毒液接种于乳鼠,观察72 h后再做乳鼠盲传,同时将灭活后病毒液接种于健康仔猪2头,在规定观察期内均不得出现口蹄疫症状和死亡,检测结果显示,灭活液接种乳鼠和仔猪后,在观察期内,除阳性对照全部死亡,接种原液乳鼠、盲传乳鼠及阴性对照乳鼠和仔猪均健活,说明病毒液灭活比较彻底。
2.3 病毒液灭活后内毒素含量检测结果 分别对两种工艺生产的各10批中间产品灭活样进行内毒素含量检测,转瓶培养方式下的灭活样内毒素检测值在<0.4EU/mL~48EU/mL之间,悬浮培养方式下的灭活样内毒素检测值在<0.6EU/mL~8.1EU/mL之间,结果见表2。
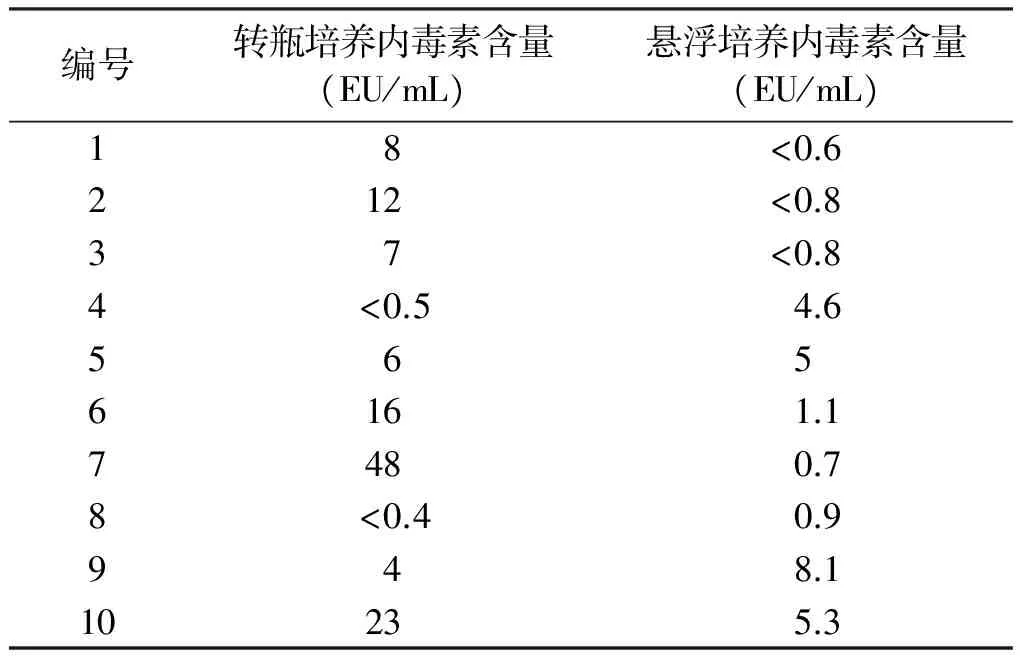
表2 不同工艺对灭活样内毒素含量的影响
经比较后得出,转瓶培养方式下,由于存在瓶间差、人为操作因素等,病毒液内毒素含量批间差大,结果不稳定,而通过在密闭容器中进行悬浮生产,内毒素含量批与批之间检测值偏差小,使内毒素含量更容易控制。
2.4 成品理化性状检验结果 分别对两种工艺生产的各10批猪口蹄疫成品疫苗进行理化性状检验,包括外观、剂型、稳定性和黏度。具体检测数据显示,改变生产工艺后,疫苗的外观由原来的粉红色变为乳白色,剂型和黏度未发生变化,稳定性表现得更为恒定。
2.5 无菌检验结果 分别对两种疫苗各10批进行无菌检验,结果显示,两种疫苗无菌检验均呈阴性。
2.6 安全性检验结果 将两种疫苗各10批,每批分别接种豚鼠和小白鼠,连续观察一定时间,豚鼠全部2/2健活,小白鼠全部5/5健活,均未出现因注射疫苗引起的死亡,但注射传统苗后的豚鼠,有个别在观察期后注射部位存在0.5~1.5 cm的未完全吸收肿块,注射悬浮苗的豚鼠则没有此现象。
每批分别接种健康仔猪2头,通过测量接种前基础体温、注苗后6 h体温和注苗后24 h体温,以及观察动物注苗后的反应等,来比较两种疫苗的安全性是否存在差异。结果显示,注射两种疫苗后,观察动物的精神状态和食欲等均无明显异常反应。
2.7 效力检验结果比较 用两种疫苗分别对健康易感架子猪进行攻毒,根据免疫猪的保护数,按Reed-Muench法计算疫苗对攻毒株的免疫效力。结果见表3。

表3 两种疫苗攻毒后毒株效力结果比较
从10批疫苗的效力检验攻毒结果看,悬浮苗攻毒结果有19个在10 PD50以上,平均值为14.03,转瓶培养疫苗中有5个在10 PD50以上,最高为13.59,最低为5.2,平均值为7.88。说明悬浮培养后疫苗的效价比转瓶培养疫苗的效价有明显的提高。
3 讨论
悬浮培养条件下,病毒增值环境稳定,其中包括温度恒定、能及时补充氧气、能随时调整pH值,使病毒在适宜的环境中大量增值,最终表现为比转瓶培养方式下病毒含量较高。
对灭活样内毒素含量检测进行比较,在生产的中间工序已经把内毒素含量控制到一定范围,说明悬浮工艺对中间产品内毒素含量的控制上起到了很好的作用。
猪口蹄疫疫苗理化性状检验显示,成品疫苗外观颜色改变,剂型和稳定性基本没发生变化。
两种疫苗的无菌检验结果全部为阴性,说明两种生产工艺在生产的各个环节都控制的比较好,从中间产品到成品,没有出现细菌污染现象,无菌检验100%合格。
疫苗的安全检验上,注射传统苗后的豚鼠,有个别在观察期后注射部位存在0.5~1.5 cm的未完全吸收肿块,注射悬浮苗的豚鼠则没有此现象;仔猪注射传统苗后的体温要略高于注射悬浮苗后的体温。出现以上问题的主要原因是,传统苗中抗原异源蛋白和杂蛋白含量高,以及抗原内毒素含量高。悬浮工艺中有效地去除了大量的异源蛋白和杂蛋白,使口蹄疫病毒的有效蛋白含量增多,最终成品接种于动物后引起的副反应降低。从效力检验可以看出,悬浮生产工艺生产的疫苗免疫效价以及持续期均比转瓶工艺生产的疫苗高。
综上所述,悬浮培养后,疫苗的质量在病毒含量、内毒素含量、效价等方面有了明显的提升,另外,悬浮培养BHK21细胞生产口蹄疫完整病毒粒子(146S)检测较转瓶培养高10倍左右[2-3],说明应用悬浮培养后,杂蛋白含量更少,口蹄疫完整病毒粒子和口蹄疫疫苗质量均提高[3]。
4 结论
4.1 从两种悬浮培养比转瓶培养工艺比较来看,悬浮工艺可以提高毒液的毒价。
4.2 转瓶培养方式下的中间产品内毒素含量有高有低,检测值不稳定,而悬浮培养后所得中间产品内毒素含量相对稳定,数值比较集中主要在0.6EU/mL~8.1EU/mL之间
4.3 悬浮培养技术生产的猪口蹄疫苗在效价上有明显的提高,悬浮苗攻毒结果效价最低为9 PD50,最高为15.59 PD50,平均值为14.03,转瓶培养疫苗最低为5.2,最高为13.59,平均值为7.88。
[1] 中国兽药典委员会.中华人民共和国兽药典:2010年版.三部[M].北京:中国农业出版社,2011.
[2] 李荣,周劲松,刘国英,等.口蹄疫疫苗的悬浮培养工艺研究[J].中国兽药杂志,2011, 45(7):14-16.
[3] 陈文庆,王建超,刘华杰,等.悬浮培养工艺与转瓶培养工艺的比较与分析[J].中国兽药杂志,2010,44(10):37-41.
2016-07-27.
贾智丽(1979-),女,讲师,硕士,研究方向为预防兽医学,E-mail:jiazhili339@163.com
S858.2
B
0529-6005(2017)02-0097-03
