MMPs和TIMPs与糖尿病心肌病心室重构的关系及糖心宁的干预作用
2017-03-29谷玉红解欣然周旭升岳改英易京红魏执真
谷玉红 李 解欣然 刘 杰 周旭升 岳改英 易京红 魏执真
(1 首都医科大学附属北京中医医院内分泌科,北京,100010; 2 首都医科大学基础医学院,北京,100069;3 北京市中医研究所,北京,100010; 4 首都医科大学附属北京中医医院心内科,北京,100010)
MMPs和TIMPs与糖尿病心肌病心室重构的关系及糖心宁的干预作用

(1 首都医科大学附属北京中医医院内分泌科,北京,100010; 2 首都医科大学基础医学院,北京,100069;3 北京市中医研究所,北京,100010; 4 首都医科大学附属北京中医医院心内科,北京,100010)
目的:探讨MMP-2、MMP-9、TIMP-2、TIMP-1在糖尿病心肌病心室重构过程中的作用,以及糖心宁的心肌保护作用及机制。方法:36只SD大鼠,其中9只作为空白对照组,27只腹腔注射链脲佐菌素(STZ)制备糖尿病心肌病大鼠模型,随机分为模型组、糖心宁高剂量组、糖心宁等效剂量组3组,糖心宁组灌服中药,模型组及空白对照组灌服等量清洁饮用水,给药8周后处死大鼠,计算左心室肥厚指数,检测血清T-SOD活性和MDA含量;Masson染色观察心肌组织中胶原,免疫组化法检测心肌组织MMP-2、MMP-9、TIMP-2、TIMP-1的蛋白表达。结果:糖尿病心肌病大鼠用药8周后,糖心宁高剂量组、糖心宁等效剂量组均能降低左心室肥厚指数,减少MDA含量,升高T-SOD水平,且同时升高MMP-9/TIMP-1和MMP-2/TIMP-2比值,降低心肌胶原含量。结论:糖心宁具有通过改善氧化应激,重新调整MMP-9/TIMP-1平衡、减弱TIMP-1对MMP-9抑制从而减轻DCM心室重构的作用。
糖尿病心肌病;氧化应激;MMPs;TIMPs;糖心宁
糖尿病心肌病(Diabetic Ardiomyopathy,DCM)是指糖尿病患者心肌细胞原发性损伤引起广泛的结构异常,最终引起左心室肥厚、舒张和(或)收缩期功能障碍的一种疾病状态。DCM主要病理改变表现为心室重构,而心室重构的形成不仅取决于心肌细胞本身,还包括心肌细胞外基质代谢失平衡导致的心肌间质重构,最终诱发心力衰竭。基质金属蛋白酶(MMPs)是降解细胞外基质的关键酶,心肌中的MMPs能够降解除多糖以外的所有基质成分。糖尿病时高血糖诱导的氧化应激可通过调节基质金属蛋白激酶(MMPs)/基质金属蛋白酶组织抑制物(TIMPs)的平衡参与DCM心室重构[1-3]。糖心宁是我院国家级名老中医魏执真教授结合多年临床经验,潜心组方形成的经验方,既往实验研究结果表明:糖心宁对DCM心肌超微结构病理改变具有改善作用,可抑制血管平滑肌细胞的增值、血小板衍化生长因子的生成和原癌基因C-myc、C-fox基因的表达,从而起到对糖尿病心脏的保护作用[4-5]。本研究采用STZ诱导的SD雄性大鼠DCM模型,初步探讨糖心宁对DCM心室重构的影响,DCM大鼠心肌组织中氧化应激反应及MMP-2、MMP-9、TIMP-2、TIMP-1表达情况以及糖心宁的干预作用。
1 材料与方法
1.1 材料
1.1.1 动物 雄性SD大鼠(由中国食品药品检定研究院提供,SCXK(京)2014-0013)36只,SPF级,体重180~220 g,于SPF级动物房喂养,饲养条件为恒温20~24 ℃,相对湿度40~70,明暗交替12 h/12 h,普通饲料,自由进食水。
1.1.2 药物 糖心宁组成(太子参、麦冬、五味子、丹参、川芎、香附、香橼、佛手、牡丹皮、赤芍、黄连),由北京中医医院中药房提供。糖心宁制备成水煎剂,等效剂量为成人正常剂量按体表面积系数折算乘以7,高剂量为等效剂量的2倍。
1.1.3 试剂与仪器 链脲佐菌素(STZ货号:S0130,Sigma)、糖原染色试剂盒(PAS货号:MST-8037,迈新生物技术开发有限公司)、Masson染色试剂盒(货号:D026,南京建成科技有限公司)、总超氧化物歧化酶试剂盒(T-SOD货号:A001-1,南京建成科技有限公司)、丙二醛试剂盒(MDA货号:A003-1,南京建成科技有限公司)、兔抗大鼠MMP-2单克隆抗体(货号:BA0569,武汉博士德生物公司)、兔抗大鼠MMP-9单克隆抗体(货号:PB0710,武汉博士德生物公司)、兔抗大鼠TIMP-1多克隆抗体(货号:BA0575,武汉博士德生物公司)、兔抗大鼠TIMP-2多克隆抗体等(货号:BA0576,武汉博士德生物公司)、脱水机、包埋机(Leica,EG1140C)、石蜡切片机(Leica公司,RM2135)生物图像分析软件AON-STUDIO 2012等。
1.2 方法
1.2.1 动物模型制备 采用链脲佐菌素(STZ)腹腔注射制作糖尿病大鼠模型[6-7]。普通饲料适应性喂养1周后,禁食12 h,期间自由饮水,随机分为空白对照组9只,造模组27只,造模组按55 mg/kg剂量单次腹腔内注射STZ,空白对照组腹腔内注射等体积柠檬酸缓冲液,分别于72 h、1周后,采用葡萄糖氧化酶法尾静脉取血测定空腹血糖,两次空腹血糖均≥11.1 mmol/L,定义为糖尿病大鼠造模成功。第5周(STZ注射后第4周),空白组随机抽取1只大鼠,造模组随机抽取3只大鼠取材,光镜下观察空白组及造模组的心肌组织,若造模组表现为心肌细胞肥大、心肌间质纤维化,且心肌过碘酸雪夫染色呈阳性,可认为DCM造模成功。
1.2.2 实验分组及给药 大鼠32只,分为4组,其中包括空白对照组(Control)8只,将造模组24只随机平均分为3组,分别为模型组(Model)、糖心宁高剂量组(TXN-H)、糖心宁等效剂量组(TXN-L)。
糖心宁高剂量组和糖心宁等效剂量组每日中药灌胃1次,空白对照组、模型组予等量清洁饮用水灌胃,1次/d,按1 mL/100 g计算,共给药8周。
1.2.3 一般情况 平时记录大鼠活动状态、毛色、精神状态、饮食、二便情况。每周测血糖和称重。
1.2.4 标本采集 给药8周结束后,腹腔注射戊巴比妥钠(40 mg/kg)将大鼠麻醉,腹主动脉取血,3 000 r/min离心15 min,分离血清,处死动物,迅速取出心脏,称取动物心重、称取左心室游离壁湿重,计算左室肥厚指数(LVHI左心室重量/全心湿重)。心脏保存于10%福尔马林溶液。
1.2.5 生化法测定氧化应激指标 采用硫代巴比妥酸法测定MDA的含量。用可见分光光度计测量其吸收度,通过公式计算MDA含量。具体操作按试剂盒说明书进行。采用黄嘌呤氧化酶法(羟胺法)测定T-SOD活力,通过比色法可以测定被测样品具有的T-SOD活力。具体操作按试剂盒说明书进行。
1.2.6 Masson染色测定心肌胶原含量 心肌组织常规脱水、包埋、切片,按照Masson染色说明说操作,光镜下观察心肌细胞,在200倍镜下拍片,每张片选10个视野,,采用生物图像分析软件AON-STUDIO 2012分析心肌组织胶原含量,测量胶原面积百分比(Percent)和积分光密度(IOD),结果用质量评分公式Q=P/I(Q:Quality、P:Percent阳性物质表达面积、I:IOD值)来评价心肌胶原的含量。
1.2.7 心肌MMP-2、MMP-9、TIMP-2、TIMP-1蛋白表达测定 采用免疫组化方法石蜡切片常规脱蜡至水,过梯度乙醇,PBS清洗后甩干,内源性过氧化物酶封闭消除背景染色,PBS清洗,浸入柠檬酸盐溶液,水浴锅加热法修复抗原,冷却至常温,正常山羊血清封闭非特异性抗原,PBS清洗甩干,滴加一抗小鼠一抗,4 ℃过夜。PBS泡洗、甩干,加入羊抗小鼠二抗,PBS洗片,DAB显色,封片,在400倍镜下拍片,每张片选10个视野。应用生物图像分析软件AON-STUDIO 2012对MMP-2、MMP-9、TIMP-2、TIMP-1(细胞质中棕褐色颗粒为阳性)表达进行图像分析,测量阳性物质的面积百分比(Percent)和积分光密度(IOD),结果用质量评分公式Q=P×I(Q:Quality、P:Percent阳性物质表达面积、I:IOD值)来评价蛋白表达情况。
1.3 统计学方法 采用GraphPad Prism6.01软件进行数据分析,计算结果采用均数±标准差(mean±SD)表示,采用单因素ANOVA分析各组组间差异,2组间采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 对照组大鼠体重随时间明显增加,精神状况良好,毛皮有光泽,反应灵敏。模型组大鼠均出现多饮、多食、多尿及消瘦等症状,毛皮杂乱、失去光泽,倦怠少动,反应迟钝,灌服中药组大鼠整体状况虽不及正常组,但较模型组有所改善。
糖尿病心肌病大鼠成模后,空腹血糖比对照组空腹血糖明显升高(P<0.01),差异有统计学意义;给药期间,各组血糖数值无明显波动;用药后,糖心宁组血糖与模型组血糖比较(P>0.05),差异无统计学意义。见表1。

表1 各组大鼠空腹血糖的比较
注:与模型组比较,*P<0.05,**P<0.01。
2.2 左心室肥厚指数 模型组大鼠LVHI(0.73±0.08)明显高于对照组(0.61±0.06)(P<0.01),糖心宁高剂量组LVHI(0.64±0.06)和糖心宁等效剂量组LVHI(0.64±0.06)均低于模型组(P<0.05)。
2.3 T-SOD活力和MDA含量 模型组较对照组T-SOD活力显著下降,MDA含量升高(P<0.01);而糖心宁高剂量和糖心宁等效剂量均可升高T-SOD活力(P<0.01),降低MDA含量(P<0.05)。见表2。
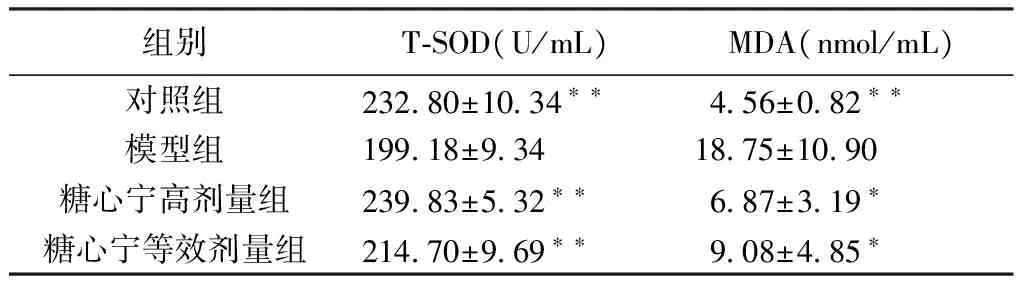
表2 糖心宁对糖尿病心肌病大鼠血清T-SOD及MDA的影响(mean±SD,n=8)
注:与模型组比较,*P<0.05,**P<0.01。
2.4 Masson染色结果胶原蛋白分析 模型组大鼠心肌胶原较对照组显著增多(Q:0.06±0.02比0.02±0.01,P<0.01)。糖心宁高剂量组(Q:0.02±0.01比0.06±0.02,P<0.01)及糖心宁等效剂量组(Q:0.03±0.0.03比0.06±0.02,P<0.05)均可降低心肌胶原。所有数值均采用科学计数(10-2)法表示。见图1。
2.5 大鼠心肌MMP2、MMP-9、TIMP-2、TIMP-1蛋白表达 大鼠心肌MMP2、MMP-9、TIMP-2、TIMP-1蛋白表达情况见表3,MMP-2见图2,MMP-9见图3,TIMP-2见图4,TIMP-1见图5。
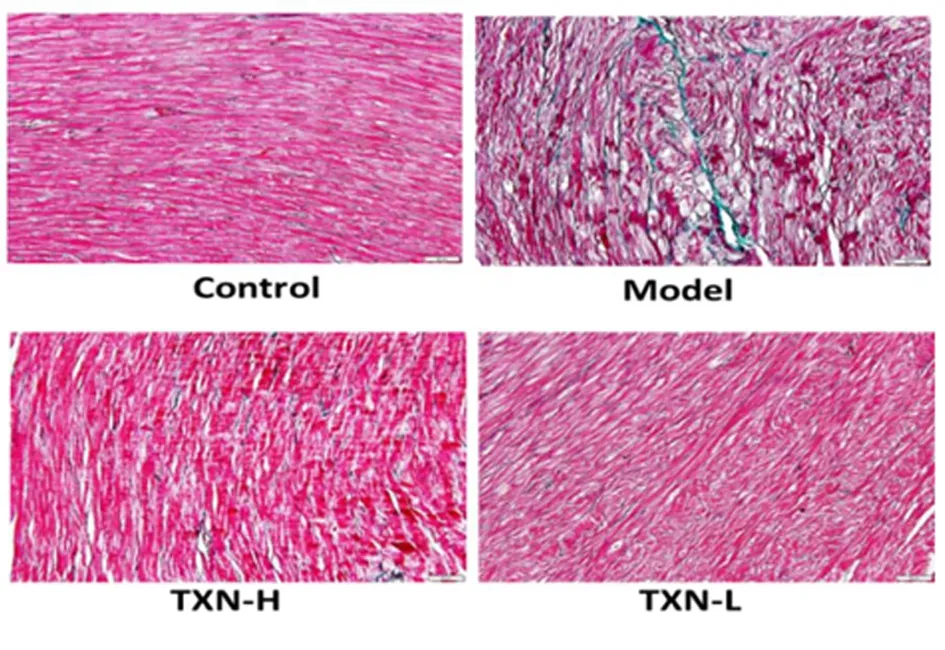
图1 各组胶原纤维表达水平(×400)
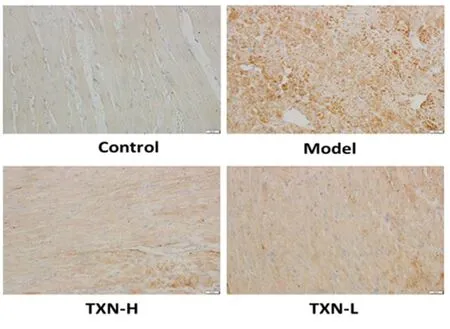
图2 各组MMP-2蛋白表达水平(×400)
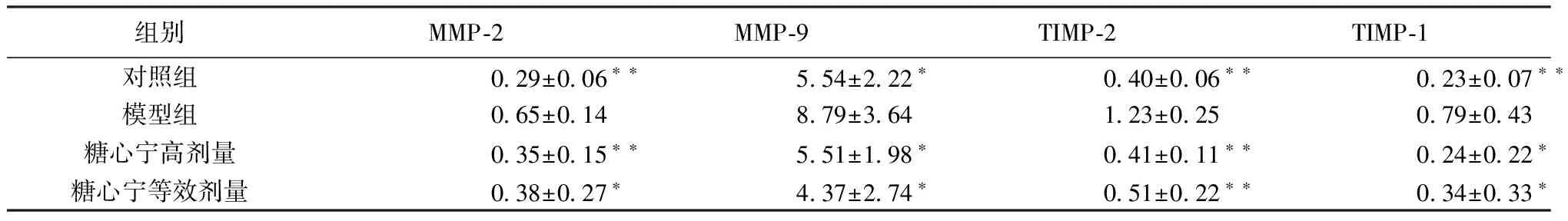
组别MMP⁃2MMP⁃9TIMP⁃2TIMP⁃1对照组029±006∗∗554±222∗040±006∗∗023±007∗∗模型组065±014879±364123±025079±043糖心宁高剂量035±015∗∗551±198∗041±011∗∗024±022∗糖心宁等效剂量038±027∗437±274∗051±022∗∗034±033∗
注:与模型组比较,*P<0.05,**P<0.01。所有数值均采用科学计数法(10-2)表示。
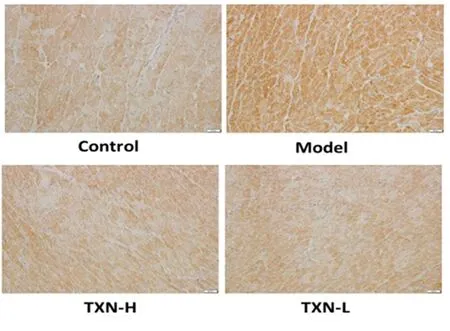
图3 各组MMP-9蛋白表达水平(×400)
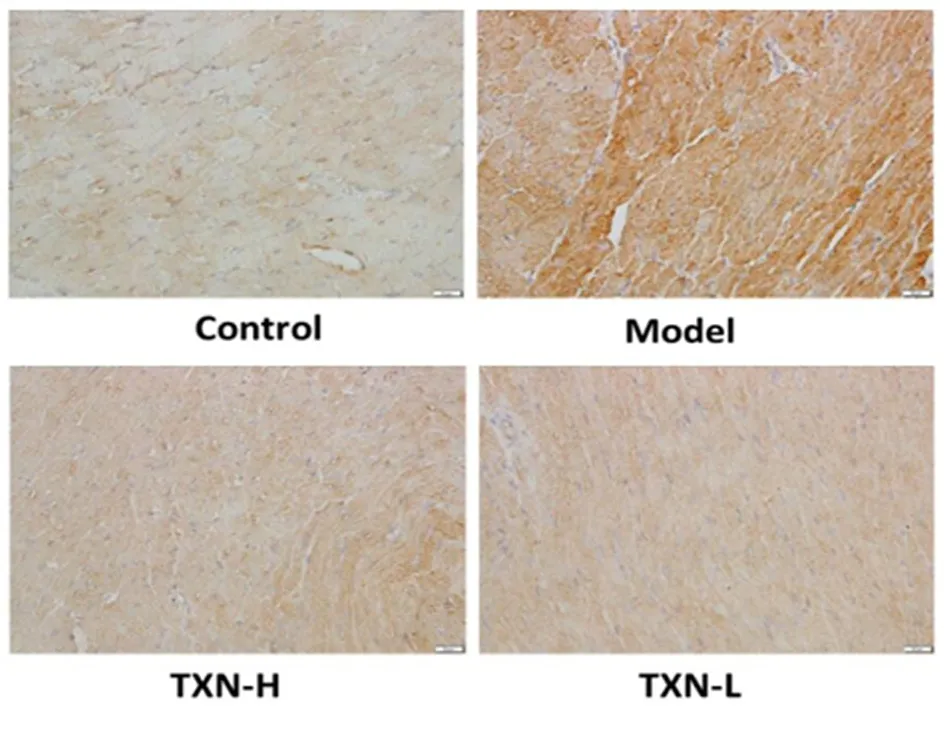
图4 各组TIMP-2蛋白表达水平(×400)
2.6 各组大鼠 MMP-2与TIMP-2、MMP-9与TIMP-1蛋白含量比值比较见表4。

表4 各组大鼠心肌MMP-2/TIMP-2、MMP-9/TIMP-1蛋白含量比值比较(mean±SD,n=8)
注:与模型组比较,*P<0.05,**P<0.01。所有数值均采用科学计数法(10-2)表示。
3 讨论
DCM心室重构包括心肌细胞肥大、心肌间质纤维化和心肌细胞凋亡,糖尿病时高血糖诱导的氧化应激是心肌损伤的主要机制之一[8-9],氧化应激可通过调节MMPs/TIMPs的平衡参与DCM心肌损伤,促进心肌间质纤维化,而心肌间质纤维化是糖尿病心肌病心室重构的病理特点之一。心肌细胞外基质最主要的成分是胶原,其中Ⅰ型、Ⅲ型胶原占90%以上,MMPs是降解细胞外基质的关键酶,MMP-2和MMP-9是心肌组织I、III型胶原完全降解的限速酶,决定I、III型胶原降解的速度[10-11]。TIMPs为MMPs内源性的特异性抑制剂,与MMPs共同构成体内调节细胞外基质动态平衡的最重要的系统,目前发现与MMP-2和MMP-9关系密切而且在心脏表达较多的是TIMP-1、TIMP-2;TIMP-1主要抑制MMP-9,TIMP-2主要抑制MMP-2[12]。
现代医学目前尚无治疗DCM的特异性药物,临床主要以纠正糖、脂代谢紊乱,控制血压,保护心肌细胞等对症综合治疗为主,尤其是纠正糖、脂代谢紊乱是治疗DCM的关键环节。高额的治疗费用和化学药物所带来的不良反应使上述药物的临床获益受限,因此,加强传统中医药学在相关领域的研究,具有重要临床意义。
中医虽无DCM的明确记载,但对其症状与病机的描述可见于“消渴病”并发“心悸”“怔忡”“胸痹心痛”“厥心痛”“真心痛”等证之中。“瘀血”在糖尿病心肌病的发生、发展中起着至关重要的作用。消渴病迁延日久,气阴两虚,气虚无力推动血行,阴虚脉道不充,则更易导致瘀血阻滞;瘀血一旦形成,即成为新的致病因素,如血瘀气滞可影响水津的输布和吸收,水液停蓄成痰,形成瘀痰互结,痹阻心脉,故目前多以以益气养阴活血法为DCM基本治疗大法[13-14]。糖心宁由太子参、麦冬、五味子、丹参、川芎、香附、香橼、佛手、牡丹皮、赤芍、黄连组成。方中以太子参、麦冬、五味子益气养心,以香附、香橡、佛手宽胸理气,配以丹参、川芎活血通脉,牡丹皮、赤芍凉血清热,黄连厚肠理气,诸药相伍,共奏益气养心、理气通脉、凉血清热之功,具有良好的临床疗效。
本研究发现,模型组大鼠左心室肥厚指数升高,MDA含量增多、T-SOD活力下降,提示氧化应激参与了糖尿病心肌病心室重构的发生和发展;而MMPs/TIMPs在模型组和对照组之间也存在差异,模型组比值有下降趋势,尤其以MMP9/TIMP1比值降低明显,提示MMPs和TIMPs失衡可能是糖尿病心肌病心室重构的发病机制之一,且氧化应激与MMPs/TIMPs平衡可能存在一定的联系。应用糖心宁后,能够降低左心室肥厚指数,提高T-SOD活力,减少MDA含量,升高MMPs/TIMPs比值,尤以MMP9/TIMP1比值升高明显,达到保护心肌的目的。
研究结果提示糖心宁可以降低左心室肥厚指数,减轻DCM心室重构,实现途径与改善氧化应激反应,减弱TIMP-1对MMP-9的抑制密切相关。至于糖心宁其他减轻心肌细胞损伤具体作用环节及其改善心室重构的分子通路机制尚有待进一步研究。
[1]康雅萍.α-硫辛酸对糖尿病大鼠心肌损伤的保护作用[D].沈阳:辽宁医学院,2012.
[2]NabeebaccusA,ZhangM,etal.NADPH oxidases and cardiac remodeling[J].Heart Fail Rev,2011,16(1):5-12.
[3]吕琳.氧化应激介导糖尿病心肌纤维化的机制研究[D].天津:天津医科大学,2009.
[4]宋冰,魏执真,吕仁和.中药糖心宁口服液对血管平滑肌细胞原癌基因C-myc和C-fox表达的影响[J].中医杂志,2004,45(4):292-294.
[5]魏执真,易京红,宋冰,等.糖心宁治疗糖尿病性心脏病的试验研究[J].中国医药学报,2004,45(4):292-294.
[6]张春虹,臧伟进,徐静,等.建立糖尿病心肌病动物模型方法的实验研究[J].卫生研究,2006,35(6):707-711.
[7]Liu Wen-qi,Dai Hong-yan,Xing Ming-qingetal.Establishiment of animal models of diabetic cardiomyopathy[J].Chinese Journal of Tissue Engineering Research,2015,19(27):4265-4270.
[8]Huynh K,Bernardo BC,McMullen JR,et al.Dibetic cardiomyopathy:mechanisms and new treatment strategies targeting antioxidant signaling pathways[J].Pharmacol Ther,2014,142(3):375-415.
[9]Joshi M,Kotha SR,Malireddy S,et al.Conundrum of pathogenesis of diabetic cardiomyopathy:role of vascular endothelial dysfunction,reactive oxygen species,and mitochondria[J].Mol Cell Biochem,2014,386(1/2):233-249.
[10]张建,华绮.代谢综合征[M].北京:人民卫生出版社,2003:23-28,92-98.
[11]Peterson JT,LiH,Bryant JW.Evolution of matrix metalloprotease and tissue inhibitor expression during heart failure progression in the infracted rat[J].Cardiovase Res,2004,6:307-315.
[12]Visser,NagaseH.Matrix Metalloproteinases and tissue inhibitors of metalloproteinases:structure,function and biochemistry[J].Circulation Research,2003,92(8):827-839.
[13]王海颖,陈城,陆敏,等.怡心饮对糖尿病心脏病大鼠心肌CTGF-mRNA和MCP-1mRNA表达的影响[J].中西医结合心脑血管病杂志,2012,10(9):1086-1088.
[14]郑永钿,缪英年,林泽宏.益气化瘀汤对糖尿病心肌病大鼠心肌细胞纤维化的影响[J].中国医药指南,2014,12(15):67-68.
(2016-12-20收稿 责任编辑:洪志强)
MMPs and TIMP′s Relationship with Diabetic Cardiomyopathy Ventricular Remodelingand Intervention Effect of Tangxinning

(1DepartmentofEndocrinology,BeijingHospitalofTraditionalChineseMedicine,CapitalMedicalUniversity,Beijing100010,China;2CollegeofBasicMedicalSciences,CapitalMedicalUniversity,Beijing100010,China; 3BeijingInstituteofTraditionalChineseMedicine,Beijing100010,China)
Objective:To study the MMP-2,MMP-9,TIMP-2 and TIMP-1′s function during diabetic cardiomyopathy ventricular remodeling process,as well as the myocardial protective effect and mechanism of Tangxinning.Methods:A total of 36 SD rats were included into the study,9 of them were taken as normal control rats,and the other 27 rats were injected with streptozotocin(STZ).These 27 rats were randomly divided into three groups:a model group and a high dose group of Tangxinning and an equal dose group of Tangxinning.The groups of Tangxinning were given a gavage of Chinese traditional medicine.The groups of model and control were given a gavage of clean drinking water.The experiment lasted 8 weeks.Then,the rats were killed to calculate the left ventricular hypertrophy index and estimate the activities of the T-SOD and MDA in serum.The cardiac histological changes were observed by Masson staining.The protein expression of MMP-2,MMP-9 and TIMP-2 and TIMP-1 in myocardium were detected by immunohistochemical method.Results:After 8 weeks of medication,both high dose group and the equal dose group of Tangxinning could reduce index of left ventricular hypertrophy and MDA,increase the level of T-SOD and the ratio of MMP-9/TIMP-1 and MMP-2/TIMP-2.The myocardial collagen content dropped.Conclusion:Tangxinning may have the effect to readjust the balance of MMP-9/TIMP-1 by improving oxidative stress and weakening TIMP-1 to MMP-9,Then DCM ventricular remodeling effect was reduced.
Diabetic cardiomyopathy; Oxidative stress; MMPs; TIMPs; Tangxinning
首都中医药研究专项一般项目(编号:15ZY15);首都医科大学附属北京中医医院“育苗计划”院级课题(编号:2014YM-07)
谷玉红(1988.03—),女,在读硕士研究生,研究方向:中医内科学内分泌方向,E-mail:guyuhongtt@163.com
易京红(1963.07—),女,硕士,主任医师,研究方向:糖尿病及其并发症的中医药研究,E-mail:kycyjh@sina.com;魏执真(1937.04—),女,学士,教授,主任医师,国家级名老中医,研究方向:心血管疾病、糖尿病及其并发症的中医药研究
R587.2
A
10.3969/j.issn.1673-7202.2017.01.006
