益气活血散结法对糖尿病肾病大鼠肾组织中MCP-1、TGF-β的影响
2017-03-29黄为钧王世东赵进喜吴文静申子龙张雨婷
黄为钧 王世东 赵进喜 傅 强 宫 晴 张 华 吴文静 申子龙 贾 旭 张雨婷
(1 北京中医药大学东直门医院,北京,100700; 2 湖北省中医院,武汉,430061; 3 首都医科大学北京中医医院肾病科,北京,100010; 4 北京中医药大学科研实验中心,北京,100029)
益气活血散结法对糖尿病肾病大鼠肾组织中MCP-1、TGF-β的影响
黄为钧1王世东1赵进喜1傅 强1宫 晴1张 华1吴文静2申子龙3贾 旭4张雨婷4
(1 北京中医药大学东直门医院,北京,100700; 2 湖北省中医院,武汉,430061; 3 首都医科大学北京中医医院肾病科,北京,100010; 4 北京中医药大学科研实验中心,北京,100029)
目的:通过动物实验,基于免疫炎性反应因子MCP-1、TGF-β,探索益气活血散结法改善肾小球硬化的分子机制。方法:24只GK大鼠,随机分为模型组、假手术组、益气活血散结组。通过高脂高能量喂养加单肾切除术复制糖尿病肾病模型。检测各组大鼠的24 h尿蛋白,观察大鼠在干预后肾脏组织的病理改变,同时采用Western blotting以及免疫组化法检测肾脏组织的MCP-1和TGF-β的表达情况,采用RT-PCR法检测MCP-1mRNA以及TGF-βmRNA的表达水平。结果:PASM染色和Masson染色显示:益气活血散结组阳性率明显低于模型组(P<0.01)。益气活血散结组中24 h尿蛋白在药物干预后明显减少(P<0.01)。Western blotting、免疫组化结果均显示:益气活血散结组MCP-1(P<0.05)、TGF-β(P<0.01)的表达程度明显低于模型组。同样,RT-PCR结果也显示:MCP-1mRNA(P<0.01)、TGF-βmRNA(P<0.05)水平在益气活血散结组明显低于模型组。结论:益气活血散结法可以有效地减少24 h尿蛋白定量、延缓肾小球纤维化,其机制可能与抑制肾脏组织中MCP-1和TGF-β的表达有关。
MCP-1;TGF-β;益气活血散结法;糖尿病肾病
糖尿病肾病(Diabetes Nephropathy,DN)是糖尿病最为常见的微血管并发症之一,也是目前导致终末期肾衰竭的最主要的原因[1]。长期以来,糖尿病肾病的治疗手段仅仅局限于降血糖、降血压、ACEI/ARB类药物的治疗,治疗手段较少,即使是仅有的已经明确证明具有降蛋白作用的ACEI/ARB类药物,其效果也一般,而且研究证实其只能使糖尿病肾病患者发展为终末期肾病的危险率降低28%,而且不能降低死亡率[2-4]。可见,现代医学对于糖尿肾病的治疗,目前没有十分理想的药物。相对而言,中医学在糖尿病肾病的治疗方面有一定的优势。本课题组长期对糖尿病肾病的中医药治疗进行研究,提出糖尿病肾病的“微型癥瘕”形成病机理论,并且证实了益气化瘀散结法治疗糖尿病肾病的有效性[5-11]。
MCP-1和TGF-β在糖尿病肾病的发展过程中起着重要的作用[12],其中前者可以在肾脏组织中募集单核-巨噬细胞,后者可以释放多种炎性反应因子以及生长因子,促进细胞外基质增生,导致肾小球硬化。释放的炎性反应因子还可以激活p38 MAPK信号通路,产生TGF-β,后者同样可以导致细胞外基质以及系膜细胞增生,导致肾小球硬化[13]。
1 材料与方法
1.1 材料
1.1.1 动物 健康SPF级GK大鼠24只,11~17周,300 g,雄性,清洁级,购自常州卡文斯实验动物有限公司[实验动物许可证号:SCXK(苏)2011-0003]。所有动物都饲养在北京中医药大学动物实验室,饲养温度22 ℃,相对湿度60%,12 h光/暗周期,自由饮水。
1.1.2 器材 血糖仪(ACCU-CHEK® Performa,罗氏卓越型);尿蛋白定量试剂盒(货号c035-2,规格100T/96样,生产批号:20150928,南京建成生物工程研究所);紫外-可见分光光度计(美国Beckman(贝克曼)公司,型号:DU 800);Anymicro DSSTM图像采集系统(江苏瑯珈科技有限公司);Synergy 4型酶标仪(美国BioTek公司);转移电泳槽(Mini Trans-Blot Transfer Cell,BIO-RAD公司);垂直板电泳槽(Mini-PROTEAN3 cell,BIO-RAD公司);DYY-10型电泳仪(北京市六一仪器厂);TS-1型脱色摇床(海门麒麟医用仪器厂);Bio-Rad Image LabTM XRS+凝胶图像分析管理系统(BIO-RAD公司);TRIzol(美国Invitrogen15596-026);RT reagent Kit(大连宝生物公司);SYBR PremixEX Taq(大连宝生物公司);PCR引物(大连宝生物公司);Real time PCR master Mix(SYBRGreen)(日本TOYOBO);荧光定量PCR循环仪(美国ABI Step one plus)。
1.1.3 药物和试剂 高热量高脂饲料成分:猪油10%,胆固醇2%,胆酸盐0.25%,蔗糖5%,基础饲料82.75%。基础饲料:热量比例,糖水化合物65%,脂肪10.3%,蛋白质24.2%。由北京科奥协力饲料有限公司提供。戊巴比妥钠(Sigma-P3761,北京智杰方远科技有限公司);实验用中药颗粒剂购自北京康仁堂药业有限公司;MCP-1抗体(ab25124,批号lotGR151246-1)以及兔抗TGF-β多克隆抗体(ab66043,批号lotGR134709-5)购自Abcam公司。Dako REALTM EnVisiontm Detection SystemPeroxidase/DAB+,Rabbit/Mouse(丹麦DAK0公司)。BCA蛋白定量试剂盒、RIPA裂解液(强)、PMSF均购自碧云天生物技术公司,组织蛋白质制备试剂、5×蛋白上样缓冲液、1.5M Tris·HCl缓冲液、1.0M Tris·HCl缓冲液、30%丙烯酰胺、AP、TEMED、10×封闭-洗涤缓冲液、10×电泳缓冲液均购自普利莱基因技术有限公司,彩色蛋白Marker、ECL发光液购自Thermo公司,反转录提取试剂盒、takara试剂盒均购自大连宝生物工程有限公司。
1.2 方法
1.2.1 大鼠分组及模型复制 所有大鼠在适应性喂养1周后,高脂高热量饲料喂养8周。然后对所有大鼠进行OGTT测试(空腹12 h后,灌服2 g/kg体重的葡萄糖溶液),检测口服葡萄糖后0 h、0.5 h、1 h、2 h尾尖血血糖。以血糖(2 hPG=11.1 mmol/L)为随机分层因素进行分层随机分组,随机分为中模型组、假手术组、益气活血散结组。分组完成后,模型组、益气活血散结组行单侧肾切除手术,假手术组只切开皮肤、肌肉,不切除肾脏。手术在3%戊巴比妥钠(1.6 mL/kg腹腔注射)麻醉下进行。手术后连续3 d腹腔注射青霉素钠注射液(40单位/只),预防伤口感染。此后整个实验过程均给予高脂高热量饮食。
1.2.2 干预药物及干预措施 所有大鼠在术后恢复饲养1周后,开始进行药物干预(8周)。益气活血散结组给予益气活血散结颗粒(黄芪、鬼箭羽)。模型组、假手术组则给予纯净水。以灌胃的方式进行给药。结合前期预实验结果,根据人和动物体重进行换算,实验大鼠剂量选用人体临床等效剂量的10倍。
1.2.3 取材及检测指标 在术后8周的药物干预期间,每隔2~3周进行1次大鼠24 h尿液的收集,并且及时使用考马斯亮蓝法进行24 h尿蛋白的检测。药物干预结束后,在3%戊巴比妥钠(1.6 mL/kg腹腔注射)麻醉下摘取剩余肾脏。肾脏纵切后,一半放入冻存管并放入-80 ℃冰箱暂时保存,用于western blotting以及PCR;另一半浸泡于4%多聚甲醛中固定,用于病理染色以及免疫组化。采用Western blotting以及免疫组化法以检测肾脏组织中MCP-1以及TGF-β的表达情况和分布情况,采用Quantitative Real-time PCR以检测肾脏组织中MCP-1mRNA和TGF-βmRNA的表达情况。
1.3 统计学方法 本实验采用SPSS 20.0统计软件进行统计:计量资料以均数±标准差(X±S)表示。符合正态分布者,使用单因素方差分析(One-wayANOVA);不符合正态分布者,采用非参数检验。以P<0.05为差异有统计学意义,以P<0.01为差异有显著统计学意义。
2 结果
2.1 动物一般状况及存活情况 益气活血组在麻醉时死亡1只,考虑为麻药误入血管所致。单肾切除术后,假手术组和益气活血组各死亡1只,考虑为术后出血过量致死。
2.2 病理染色 HE染色在镜下100倍、200倍观察大鼠肾脏结构。假手术组可见到:肾小球肥大或萎缩(以前者为主),肥大的肾小球内毛细血管迂曲扩张,毛细血管瘤形成;萎缩表现为系膜细胞及系膜基质均增生,毛细血管压迫闭塞,球囊间隙轻度变窄;局部肾小管上皮细胞变性,呈空泡样变,管腔内未见管型;间质少量炎细胞浸润及少量纤维组织增生。模型组可见到:肾小球肥大或萎缩(以前者为主),肥大的肾小球内毛细血管迂曲扩张,毛细血管瘤形成;萎缩表现为系膜细胞及系膜基质均增生,毛细血管压迫闭塞,球囊间隙变窄;肾小管上皮细胞变性,呈空泡样变及颗粒样变(以前者为主),肾小管可见代偿性扩张,管腔内见管型;间质少量炎细胞浸润及少量纤维组织增生。益气活血散结组可见到:肾小球体积形态正常,肾小球毛细血管扩张,系膜细胞增生不明显,系膜基质区轻度增宽;肾小管上皮细胞完整,肾小管排列轻度紊乱,扩张明显,小灶肾小管上皮细胞空泡变性,管腔内未见管型,间质未见炎性反应细胞浸润。见图1。
PASM染色和Masson染色在镜下200倍观察大鼠肾脏染色结果:益气活血散结组的系膜增生以及基底膜增厚程度要轻于模型组。见图2。PASM染色及Masson染色的阳性率结果显示:益气活血散结组阳性率明显低于模型组(P<0.01,表1)。
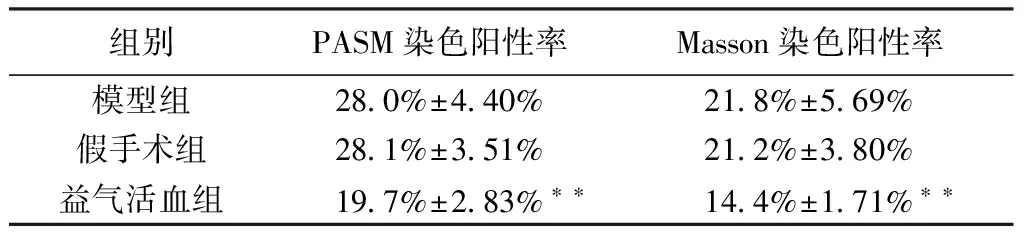
表1 PASM染色和Masson染色阳性率
注:**与模型组相比差异有统计学意义,P<0.01。
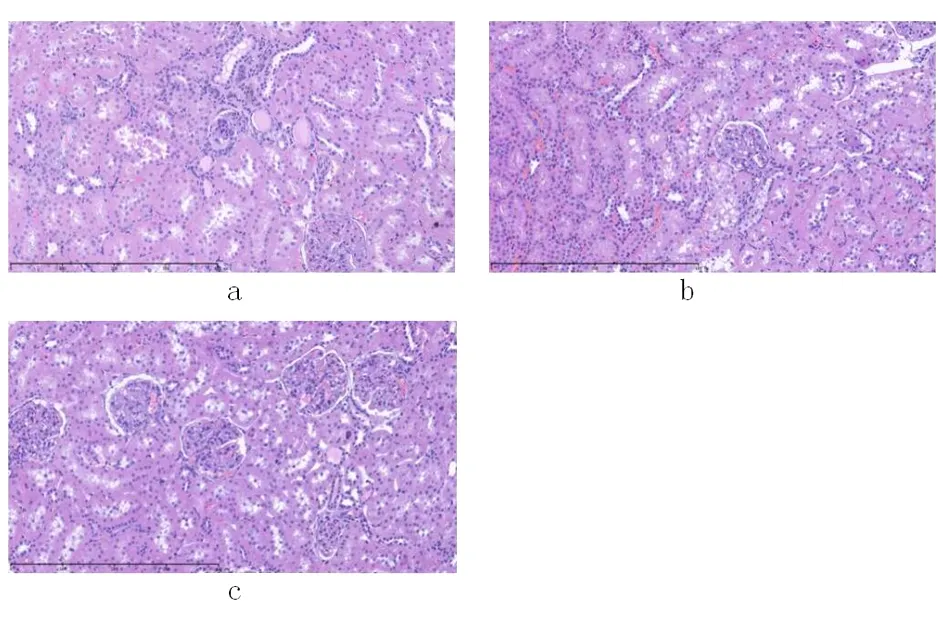
图1 HE染色
注:a空白组;b假手术组;c益气活血散结组。
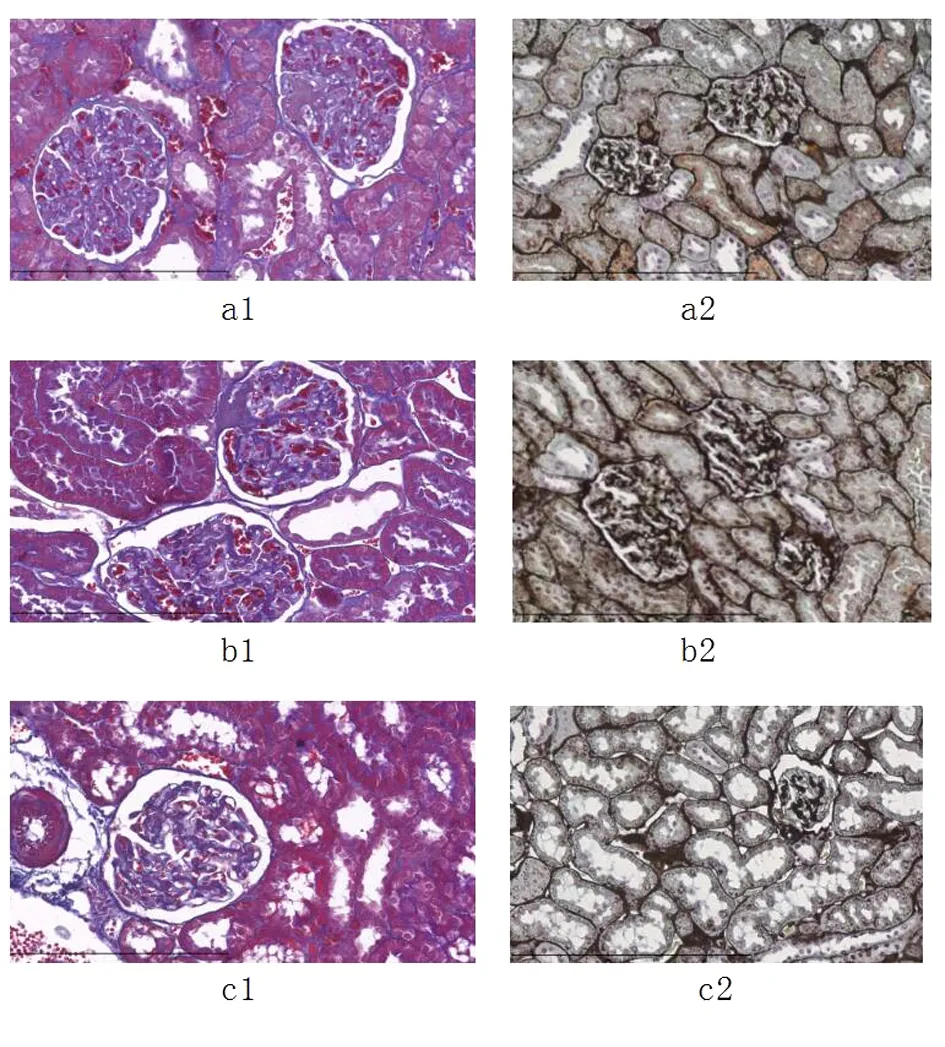
图2 Masson染色和PASM染色
注:a空白组;b假手术组;c益气活血散结组。
2.3 24 h尿蛋白定量 药物干预后,各组的尿蛋白量呈现下降的趋势,分析第8周与第0周尿蛋白差值的结果显示:益气活血散结组的24 h尿蛋白在药物干预后明显减少,而且与模型组对比差异有统计学意义(P<0.01,表2)。
2.4 Western blotting 各组均在分子量为25 kDa(MCP-1),13 kDa(TGF-β)处可见蛋白条带。对其灰度值进行分析,结果显示:益气活血散结组MCP-1(P<0.05,表3)、TGF-β(P<0.01,表3)的表达程度明显低于模型组。

表2 药物干预前后24 h尿蛋白定量差值
注:**与模型组相比,差异有统计学意义,P<0.01。
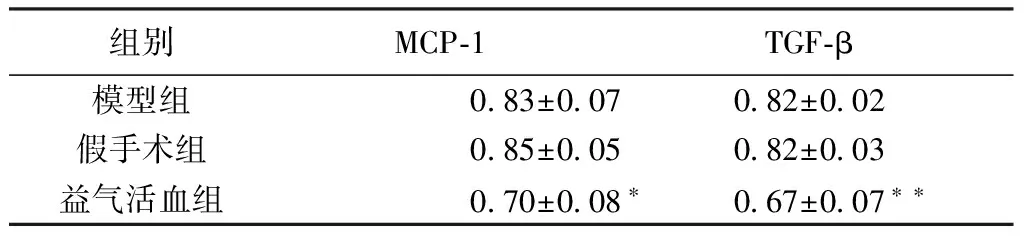
表3 WB检测MCP-1和TGF-β在肾脏组织中的表达情况
注:*与模型组相比,差异有统计学意义,P<0.05,**与模型组相比,差异有统计学意义,P<0.01。

图3 Western blotting蛋白条带
2.5 免疫组化 结果显示,肾脏组织中MCP-1主要表达于肾小球系膜上皮细胞胞质,TGFβ表达于肾小球和肾小管上皮细胞胞质。进一步分析灰度值,结果显示:MCP-1(P<0.05,表4)及TGF-β(P<0.01,表4)在益气活血散结组的表达水平显著低于模型组。

表4 免疫组化检测肾脏组织中MCP-1、TGF-β的表达水平
注:*与模型组相比,差异有统计学意义,P<0.05,**与模型组相比,差异有统计学意义,P<0.01。
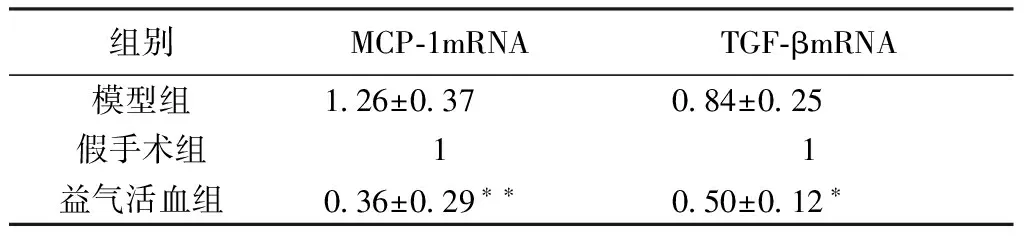
表5 PCR检测MCP-1mRNA和TGF-βmRNA的表达水平
注:*与模型组相比,差异有统计学意义,P<0.05,**与模型组相比,差异有统计学意义,P<0.01。
2.6 RT-PCR 本实验采用实时定量PCR对MCP-1mRNA以及TGF-βmRNA的表达水平进行检测,结果采用2-△△CT法进行数据的相对定量分析,并且以假手术组为对照组。结果显示:MCP-1mRNA(P<0.01,表5)、TGF-βmRNA(P<0.05,表5)水平在益气活血散结组明显低于模型组。
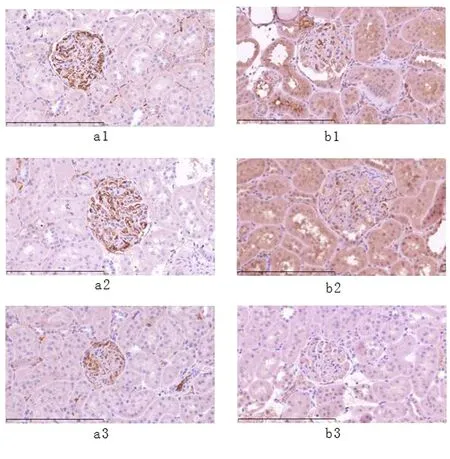
图4 免疫组化结果
注:a MCP-1,b TGF-β;1模型组,2假手术组,3益气活血散结组。
3 讨论
糖尿病肾脏病“微型癥瘕”学说是吕仁和教授在整理古代文献的基础上,参照现代医学相关认识,结合临床实践经验提出来的。认为糖尿病肾脏病属于中医“消瘅”的范畴,为消渴病日久,体质因素加以情志、饮食失调等,内热伤阴耗气,气阴两伤,或阴损及阳,久病致虚基础上,久病入络,气虚血瘀,痰郁热瘀互相胶结,则可在肾之络脉形成微型癥瘕,使肾体受损,肾用失司。肾主藏精,肾气不固,精微外泄,则可见尿蛋白,或见夜尿频多等。肾主水,肾气不化,或阴损及阳,阳不化气,水湿气化不利,水液滞留,溢于肌肤,故可见水肿胀满。病情继续发展,肾体劳损,肾元虚衰,气血俱伤,气化不行,浊毒内留,则诸症峰起。终成肾元衰败,五脏俱病,升降失常,三焦阻滞,水湿浊毒泛滥,一身气机升降出入俱废,转为关格危证[7]。在治疗方面,强调益气活血散结法应贯穿糖尿病肾病治疗的始终[14]。在“十五”“十一五”期间,吕仁和教授团队基于“微型癥瘕”学说,开展了多个随机、单盲、平行对照和多中心临床研究,研究结果均显示,基于“微型癥瘕”学说形成的中药辨证论治方案在有效率、24 h尿蛋白定量、尿微量白蛋白排泄率、血肌酐等方面具有优于或非劣于西药ARB类药物的疗效,甚至在终点事件方面(Ⅲ期DKD患者进入Ⅳ期,或者Ⅳ期DKD患者血肌酐平翻倍或需要透析治疗)明显优于西药厄贝沙坦组[5-6,9-11]。可见,益气活血散结法治疗糖尿病肾病的疗效明确,但是其分子生物学机制仍不清楚,为此,我们开展了此项研究。
研究表明,免疫炎性反应机制在糖尿病肾病的发生发展过程中起着重要的作用[13],其中MCP-1以及TGF-β与糖尿病肾病肾脏纤维化有着密切的关系。糖尿病时高血糖刺激肾系膜细胞表达MCP-1增多,MCP-1可直接激活系膜细胞产生肌纤维蛋白,使肾小球纤维化;此外还可募集血循环中的单核巨噬细胞,被活化的巨噬细胞可以释放活性氧、各种炎性因子(IL-1,TNF-α等)和促纤维化生长因子(PDGF,TGF-β等),导致肾小球实质细胞受损以及坏死,上皮细胞间充质转化,细胞外基质的增多,最终导致肾小球硬化的发生[15]。可见,MCP-1和TGF-β在糖尿病肾病发展过程中的起着重要作用,甚至有学者认为将MCP-1、TGF-β等作为生物标记评估糖尿病肾病的发展[16]。
本研究结果显示,益气活血散结组在降低24 h尿蛋白定量以及减轻肾小球纤维化,延缓肾小球硬化方面明显要比模型组效果好(见图1,图2,表1,表2)。这与我们临床观察以及以往的随机对照研究结果是相符的,再次证明了益气活血散结法治疗糖尿病肾病的有效性。而在机制研究方面,不管是western blotting、免疫组化,还是RT-qPCT,结果都一致显示,对比模型组,益气活血而散结组可以很明显地抑制MCP-1以及TGF-β的表达(见表3,表4,表5)。此外,在HE染色病理切片中也可以看见益气活血散结组的炎性反应细胞浸润要比模型组以及假手术组轻(见图1)。可见,中药益气活血散结法可以有效地抑制糖尿病肾病大鼠肾脏组织中MCP-1和TGF-β的表达。
综上,我们得出结论,益气活血散结法可以有效地减少24 h尿蛋白定量、延缓肾小球纤维化,其机制可能与抑制肾脏组织中MCP-1和TGF-β的表达有关。
[1]KDOQI.KDOQI clinical practice guidelines and clinical practice recommendations for diabetes and chronic kidney disease[J].American journal of kidney diseases:the official journal of the National Kidney Foundation,2007,49(2 Suppl 2):S12-154.
[2]Brenner BM,Cooper ME,de Zeeuw D,et al.Effectsof losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy[J].The new England journal of medicine,2001,345:861-869.
[3]Enrique Z Fisman,Alexander Tenenbaum,Michael Motro.Losartan and diabetic nephropathy:commentaries on the RENAALstudy[J].Cardiovascular Diabetology,2002:1.
[4]Keane WF,Brenner BM,de Zeeuw D,et al.The risk of developing end-stage renal disease in patients with type 2 diabetes and nephropathy:the RENAAL study[J].Kidney International,2003,63(4):1499-1507.
[5]李景,赵进喜,王世东,等.中医药综合治疗方案全程干预对糖尿病肾病终点事件的影响[J].中医杂志,2012,53(7):568-571,580.
[6]赵进喜.糖尿病肾病规范化中医诊疗方案及其研究[J].药品评价,2012,9(28):31-35,40.
[7]吕仁和,赵进喜.糖尿病及其并发症中西医诊治学[M].2版.北京:人民卫生出版社,2009.
[8]王世东,黄允瑜,李靖,等.中医防治方案对糖尿病肾病肾功能不全代偿期肾功能和血脂代谢的影响[J].北京中医,2007,26(4):211-214.
[9]宋美铃,杨敏,牟新,等.中医辨证治疗糖尿病肾病肾功能不全的肾功能指标疗效和证候疗效评价[J].北京中医药大学学报,2006,29(6):429-432.
[10]张丽芬,赵进喜,吕仁和,等.糖尿病肾病肾功能不全防治优化方案的有效性和安全性研究[J].中医杂志,2006,47(10):755-758.
[11]张丽芬,吕仁和,赵进喜,等.中医辨证治疗方案对糖尿病肾病肾功能不全患者生存质量的影响——多中心临床研究[J].中医杂志,2008,49(2):119-122.
[12]Shaker OG1,Sadik NA.Transforming growth factor beta 1 and monocyte chemoattractant protein-1 as prognostic markers of diabetic nephropathy [J].Human and experimental toxicology,2013,32(10):1089-1096.
[13]Lim AK,Tesch GH.Inflammation in Diabetic Nephropathy[J].Mediators of Inammation,2012,2012:1-12.
[14]丁英钧,肖永华,傅强,等.糖尿病肾病“微型癥瘕”病理假说解析[J].中华中医药杂志,2009,24(1):27-30.
[15]Tesch GH.MCP-1/CCL2:a new diagnostic marker and therapeutic target for progressive renal injury in diabetic nephropathy [J].American journal of physiology,2008,294(4):F697-701.
[16]El Mesallamy HO,Ahmed HH,Bassyouni AA,et al.Clinical significance of inflammatory and fibrogenic cytokines in diabetic nephropathy [J].Clinial biochemistry,2012,45(9):646-650.
(2016-12-20收稿 责任编辑:洪志强)
Effects of Qi-tonifying Blood-activating and Mass-dissipating Method on Expressions of MCP-1 AndTGF-β in Renal Tissue of Rats with Diabetic Nephropathy
Huang Weijun1,Wang Shidong1,Zhao Jinxi1,Fu Qiang1,Gong Qing1,Zhang Hua1,Wu Wenjing2,Shen Zilong3, Jia Xu6,Zhang Yuting6
(1SectionⅡofEndocrinology&NephropathyDepartmentofDongzhimenHospitalAffiliatedtoBeijingUniversityofChineseMedicine,Beijing100700,China; 2NephropathyDepartmentofHubeiProvincialHospitalofTCM,Hubei430061,China;3NephropathyDepartmentofBeijingHospitalofTraditionalChineseMedicineAffiliatedtoCapitalMedicalUniversity,Beijing100010,China; 6ResearchandExperimentCenter,BeijingUniversityofChineseMedicine,Beijing100029,China)
Objective:To study the mechanism of Qi-tonifying blood-activating and mass-dissipating method in treating diabetic nephropathy based on MCP-1 and TGF-β through animal experiment.Methods:A total of 24 GK rats were randomly divided into model group,sham-operated group and Qi-tonifying blood-activating and mass-dissipating group.Each group had 8 rats.The DN model was established by feeding with high-fat diet and unilateral nephrectomy.24-hour urine protein was detected and the renal pathological changes were observed.Expressions of MCP-1 and TGF-β in the renal tissue were detected by Western blotting and immunohistochemistry,while RT-PCR was used to detect the expression of MCP-1mRNA and TGF-β mRNA.Results:Results of PASM staining and Masson staining show that the positive rate of Qi-tonifying blood-activating and mass-dissipating group was significantly lower than that of model group(P<0.01).The 24-hour urinary protein in Qi-tonifying blood-activating and mass-dissipating group decreased significantly after drug intervention(P<0.01).Results of Western blotting and immunohistochemistry showed that expression levels of MCP-1(P<0.05) and TGF-β(P<0.01) were lower in Qi-tonifying blood-activating and mass-dissipating group than those in model group.Results of RT-qPCR showed that expression levels of MCP-1 mRNA(P<0.01) and TGF-β mRNA(P<0.05) in Qi-tonifying blood-activating and mass-dissipating group were significantly lower than those in model group.Conclusion:The treatment of diabetic nephropathy with Qi-tonifying blood-activating and mass-dissipating method can decrease the proteinuria and delay the glomerular fibrosis.The molecular mechanism may be related to the inhibition of MCP-1 and TGF-β.
MCP-1; TGF-β; Qi-tonifying blood-activating and mass-dissipating method; diabetic nephropathy
国家自然科学基金项目(编号:81473664)
黄为钧(1990.07—),男,在读博士研究生,研究方向:中医药防治糖尿病及其并发症,E-mail:huangweijun2015@126.com
赵进喜(1965.03—),男,博士,教授/主任医师,北京中医药大学第一临床医学院中医内科学教研室主任,研究方向:中医药防治糖尿病及其并发症,邮编:100700,电话:84013293,E-mail:zhaojinximd@126.com
R259
A
10.3969/j.issn.1673-7202.2017.01.004
