辣椒轻斑驳病毒凤城分离物的鉴定、全基因测序及系统进化分析
2017-03-29竹怀婷李晓冬侯慧慧徐千惠安梦楠
竹怀婷, 李晓冬, 侯慧慧, 徐千惠, 安梦楠
(沈阳农业大学植物保护学院, 沈阳 110866)
辣椒轻斑驳病毒凤城分离物的鉴定、全基因测序及系统进化分析
竹怀婷, 李晓冬, 侯慧慧, 徐千惠, 安梦楠*
(沈阳农业大学植物保护学院, 沈阳 110866)
辣椒轻斑驳病毒Peppermildmottlevirus(PMMoV)属于烟草花叶病毒属,是辣椒上重要的病原病毒之一,近年来PMMoV对辽宁部分辣椒产区造成严重危害。本文采用DAS-ELISA检测以及RT-PCR的方法首次从辽宁省凤城市蔬菜产区辣椒病叶中检测出PMMoV,暂命名为PMMoV-FC。设计3对特异性引物对其进行扩增并测序后得到该病毒分离物全基因序列。将PMMoV-FC的全基因序列与已报道的国内外9个PMMoV分离物进行同源性分析,结果表明,其同源性介于94.3%~99.7%之间。基于全基因序列的系统发育进化分析表明,PMMoV-FC与国内分离物、日本分离物以及美洲分离物亲缘关系密切,而与韩国和西班牙分离物亲缘关系稍远。鉴于该病毒在辣椒上造成的严重危害,对于PMMoV-FC在辽宁地区的发生以及防治仍需进行更为详细的研究。
辣椒轻斑驳病毒; RT-PCR; 全基因组测序; 系统进化分析
我国近年来辣椒Capsicumfrutescens产业发展迅速,已成为世界上辣椒栽培面积最大的国家[1],种植面积基本稳定在150万~160万hm2,约占我国蔬菜种植面积的10%[1-2]。辣椒也是我国辽宁省重要的蔬菜作物之一,辣椒病毒病是危害辣椒生产的重要病害,常导致辣椒落叶、落花、落果,可造成减产30%~50%,甚至绝收,成为影响辣椒产量的主要因素之一[3]。辣椒轻斑驳病毒Peppermildmottlevirus(PMMoV)属于烟草花叶病毒属Tobamovirus的正义链RNA病毒,基因组RNA由6 356或6 357个碱基组成,编码病毒复制酶蛋白p126和p183、运动蛋白(movement protein, MP)和外壳蛋白(17 kDa)等至少4种蛋白[4-5],是世界范围内造成辣椒经济损失的重要病原之一。PMMoV可以通过种子和汁液摩擦传播,带毒种子、发病植株和病土是重要的侵染来源[6]。PMMoV最早报道于美国辣椒[7],1994年在中国新疆辣椒上首次发现[8]。2014年6月辽宁省葫芦岛地区温室大棚辣椒上暴发辣椒轻斑驳病毒病,50%的辣椒受到侵染,受害总面积达15 hm2,直接造成三分之一的经济损失[9]。感病辣椒叶片呈现斑驳、花叶、扭曲或皱缩,茎秆上出现褐色坏死斑,果实变小畸形、果面斑驳或出现凹陷坏死等明显病毒病症状,后期辣椒果实外观和内在品质均显著变差[10]。迄今有关辽宁地区辣椒轻斑驳病毒的基因序列的详细研究十分缺乏,本研究采用反转录PCR(RT-PCR)和双抗体夹心酶联免疫吸附法(DAS-ELISA)检测等技术对PMMoV凤城辣椒分离物(PMMoV-FC)的基因全序列进行克隆和序列分析,明确了该分离物与国内外分离物的亲缘关系,从分子水平鉴定该病毒分离物,为后续在该病毒的预防和控制方面提供依据和参考。
1 材料与方法
1.1 试验材料
毒源的采集与保存:本研究于2015年9月在辽宁省凤城市凤山区大梨树村辣椒生产区调查采样,采集的辣椒(品种为‘津福15号’)病叶具有明显花叶和斑驳症状。将上述症状病样汁液摩擦接种于温室培养辣椒‘津福15号’上繁殖并保存。
生化及分子生物学试剂:供试PMMoV的DAS-ELISA检测试剂盒购自美国Agdia公司;植物总RNA提取所用TRIzon Reagent试剂购自北京康为世纪公司;反转录TIANScriptcDNA第一链合成试剂盒购自北京天根生化科技有限公司,PCR扩增酶 Ex Taq购自大连宝生物公司;引物由上海生工合成,质粒核酸测序由苏州金唯智生物科技有限公司完成。
1.2 试验方法
1.2.1 DAS-ELISA血清学检测
取田间采集到的辣椒疑似感染病毒病叶,加入PBS缓冲液进行研磨裂解后,采用DAS-ELISA法进行检测。按照DAS-ELISA试剂盒说明书进行操作,终止液终止反应后用酶标仪于405 nm波长下读取每孔的吸光度。
1.2.2 辣椒叶片总RNA提取及反转录
选取2份发病症状明显的辣椒病叶,以一份温室培育的健康辣椒叶片作为对照,提取叶片总RNA,每份样品称取0.1 g。提取方法按照TRIzon Reagent试剂说明书步骤进行,将得到的叶片总RNA存于-80℃下备用。以提取的总RNA为模板,采用随机引物,参照TIANScriptcDNA第一链合成试剂盒说明书方法获取反转录产物cDNA。
1.2.3 基因全序列的克隆与测序
根据GenBank中PMMoV中国分离物PMMoV-CN(登录号:AY859497)的基因序列设计3对特异性引物(表1)。引物由上海生工合成。
表1 PMMoV特异性扩增引物
Table 1 Specific primer sequences for PMMoV amplification

引物名称Primer序列(5'-3')Sequence起始位点InitiationsitePMMoV1FGTAAATTTTTCACAATTTAA-CAACAACAAC1PMMoV1RACACCAAAGATTCGGAGCTC2482PMMoV2FGTAGAGTCGCAGTGAGCTCC2450PMMoV2RTAGCATAGAGGACAGACATGC4466PMMoV3FGAGGAAAAGCGGTGATGTCAC4395PMMoV3RTGGGCCGCTACCCGCGGTTC6356
以叶片的总RNA为模板,采用3步RT-PCR法扩增PMMoV-FC的全基因序列。分别以特异性引物PMMoV1F和PMMoV1R,PMMoV2F和PMMoV2R以及PMMoV3F和PMMoV3R扩增PMMoV-FC(图1),并进行测序,将测序结果通过拼接得到PMMoV-FC全基因序列。PCR反应体系按照反转录试剂盒进行操作,总体积为25 μL,反应条件为94℃ 1 min;94℃ 30 s,54℃ 30 s,72℃ 3 min,35个循环;72℃ 8 min。PCR产物分别进行电泳并切胶回收后与pMD19-T载体(宝生物公司)进行连接,转化大肠杆菌感受态细胞DH5α(北京康为世纪生物科技有限公司),于含50 ng/μL氨苄青霉素的平板上培养过夜,经蓝白斑筛选挑取白色菌落进行培养,提取质粒。将筛选出的含重组质粒的阳性克隆送至金唯智生物科技(北京)有限公司进行测序。采用DNAMAN V8.0(Lynnon Corporation)软件及BLAST(https:∥www.ncbi.nlm.nih.gov/)进行序列分析,利用Clustalx v1.81和Mega v6.06软件构建系统进化树。

图1 RT-PCR扩增过程Fig.1 Amplification process of RT-PCR
2 结果与分析
2.1 辣椒疑似病毒病样品田间症状
调查发现,发病辣椒叶片呈现斑驳、花叶、扭曲或皱缩,茎秆上出现褐色坏死斑,果实变小畸形、果面斑驳或出现凹陷坏死等明显病毒病症状,果实外观和内在品质均显著下降(图2)。

图2 田间辣椒病叶症状Fig.2 Symptoms of diseased pepper leaves in the field
2.2 PMMoV的DAS-ELISA血清学检测
对采集到的3个病样进行DAS-ELISA检测结果表明辣椒病叶均呈PMMoV阳性,其中辣椒病叶PMMoV检测OD平均值=1.06;阴性对照OD平均值=0.095;PMMoV阳性质控物OD平均值=0.81,表明采集到的样品中携带PMMoV。
2.3 PMMoV-FC RT-PCR扩增结果
分别采用PMMoV1F和PMMoV1R,PMMoV2F和PMMoV2R以及PMMoV3F和 PMMoV3R 3对特异性引物(表1),以反转录的cDNA为模板进行了PCR(RT-PCR)扩增(图1)。琼脂糖凝胶电泳结果表明:泳带从左到右分别扩增出长度约为2.5、2和2 kb的单一PCR产物片段(图3)。
2.4 PMMoV-FC的全基因测序
通过DNAMAN V8.0软件对3段克隆到pMD19-T载体的PCR扩增产物进行测序和拼接,每段产物至少测通3个克隆以上,确保序列结果的准确性。将拼接后的PMMoV-FC全基因序列上传至NCBI数据库并获得临时登记号(KU646837)。

图3 3对特异性引物的 PMMoV-FC RT-PCR扩增产物Fig.3 RT-PCR products of PMMoV-FC using three pairs of specific primers
2.5 PMMoV-FC与其他分离物的基因同源性比对
从GenBank中选取9个PMMoV分离物(其中包括2个中国分离物、4个来自亚洲其他国家的分离物、2个美洲分离物和1个欧洲分离物)和烟草花叶病毒属其他2种病毒分离物基因全序列,采用DNAMAN软件对PMMoV-FC的基因全序列与上述基因的序列同源性进行了比较,结果(表2)表明:PMMoV-FC与选取的9个PMMoV分离物核苷酸的序列同源性介于94.4%~99.7%之间,同源性很高,其中与中国分离物PMMoV-CN(AY859497)、PMMoV-HN1(KP345899)和日本分离物PMMoV-J(AB000709)、PMMoV-Jp(AB069853)以及美洲分离物PMMoV BR-DF01(AB550911)、PMMoV-A(NC003630)同源性均在99%以上;与分离物PMMoV-Kr(AB126003)、PMMoV-Ia(AJ308228)、PMMoV-P3(LC082100)的亲缘关系相对较远,同源性介于94.3%~97.3%之间,与TMV(NC001367)相似度为69.5%,与CGMMV(NC001801)的相似度为51.1%(表2)。
2.6 基于全基因序列的PMMoV系统进化树分析
将PMMoV-FC基因全序列与上述分离物(表2)进行比对后,通过Clustalx V1.81和Mega V6.06构建系统进化树(图4)。结果表明:采用Neighbor-Joining聚类分析方法将所有PMMoV分离物聚类在一起,形成两大支系群体,PMMoV-FC与来自中国、日本、韩国和美洲的6个PMMoV分离物聚为一个支系,与西班牙分离物(PMMoV-Ia)和来自韩国的另一种分离物(PMMoV-P3)分属不同支系,但亲缘关系仍相对较近,与TMV以及CGMMV亲缘关系很远(图4)。
表2 PMMoV-FC核苷酸序列同源性比较
Table 2 Homology analysis of PMMoV-FC genome sequence with other PMMoV isolates and other virus ofTobamovirus

分离物IsolateGenBank登录号GenBankaccessionno.来源Origin核苷酸序列同源性/%IdentityPMMoV-JAB000709日本99.7PMMoV-JpAB069583日本99.7PMMoV-CNAY859497中国99.6PMMoV-HN1KP345899湖南99.6PMMoV-ANC003630美国99.6PMMoV-BR-DF01AB550911南美99.3PMMoV-KrAB126003韩国97.3PMMoV-IaAJ308228西班牙94.4PMMoV-P3LC082100韩国94.3TMVNC001367俄罗斯69.5CGMMVNC001801日本51.1
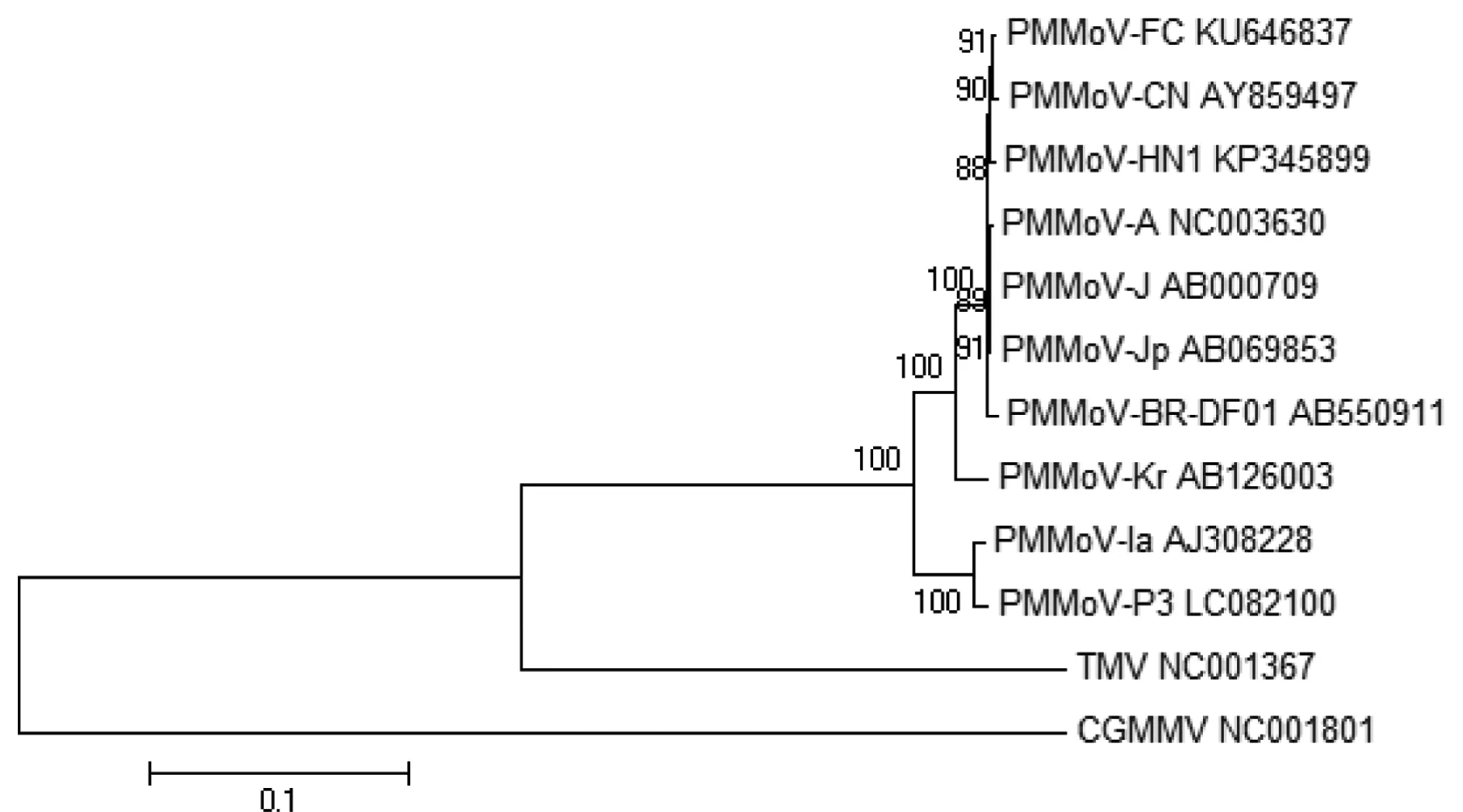
图4 基于PMMoV基因核酸全序列的系统进化分析Fig.4 Phylogenetic analysis of PMMoV complete genome sequences
3 结论与讨论
自向本春等[8]首次将新疆石河子地区辣椒上危害的病毒鉴定为辣椒轻斑驳病毒以来,近些年在我国华北地区、山东青岛、西南贵州、西北宁夏、陕西乃至台湾地区的辣椒上均发现该病毒[11-13],可见其危害地区越来越广、危害面积也在逐步增加。辽宁省辣椒主栽品种有‘丹椒4号’、‘超级金塔2号F1’、‘西星牛角椒1号’、‘津福15号’、‘益都红’、‘辣优8号’、‘鞍椒1号’、‘猛椒3号’等。本研究通过RT-PCR检测,可确定辽宁省丹东市凤城大梨树村采集到辣椒病叶为PMMoV所致,带毒样品为‘津福15号’,在辽宁地区属于主栽品种之一,具有代表性。本研究通过同源性分析以及系统进化树分析明确PMMoV-FC与GenBank中9个国内和其他国家PMMoV分离物同源性很高,核苷酸同源性介于94.3%~99.7%之间。采用聚类分析法构建系统发育进化树并明确了该分离物与国内分离物、日本分离物以及美洲分离物亲缘关系密切,而与韩国和西班牙分离物亲缘关系稍远。通过上述结果揭示PMMoV-FC可能与中国已报道的几种分离物,日本以及美洲分离物具有相同的进化祖先。
近年,随着国际间种子、苗木贸易往来日益频繁,各口岸出入境检疫部门不仅在引种种植的辣椒上检测到PMMoV,也从我国台湾及韩国等进境辣椒种子中检测到PMMoV的存在。Peng等[14]通过对不同省份的42份市场上销售的辣椒酱进行检测,结果表明:辣椒酱中的PMMoV仍具有侵染活性,PMMoV也会随着辣椒酱等辣椒制品的贸易进行传播。同时,Colson等[15]的研究表明食用含有PMMoV的辣椒产品可导致腹泻,发热等症状。因此,应重视PMMoV对于辣椒生产上的危害以及对人们健康方面的潜在威胁。但PMMoV尚不属于我国禁止进境的检疫性有害生物,无法通过植物检疫措施阻止该病毒进入我国。PMMoV在辽宁的发生尚不普遍,除葫芦岛市和凤城市以外,暂未在其他地区检测到PMMoV,鉴于其潜在的危害性,对于该病毒的发生以及防控仍需进行更加深入的研究。
[1] 陈文超, 戴雄泽, 马艳青, 等. 辣椒新品种“福湘秀丽”的选育[J]. 湖南农业科学, 2012, 32(13): 19-20.
[2] 耿三省, 陈斌, 张晓芬, 等. 我国辣椒品种市场需求变化趋势及育种对策[J]. 中国蔬菜, 2015(3): 1-5.
[3] 林燕春, 罗明云, 林江, 等. 辣椒病毒病发生规律与防治技术研究[J]. 湖北农业科学, 2009, 48(9): 2142-2144.
[4] Alonso E, Gareia-Luque I, De La Cruz A, et al. Nucleotide sequence of the genomic RNA ofPeppermildmottlevirus, a resistance-breakingTobamovirusin pepper [J]. Journal of General Virology, 1991(72): 2875-2884.
[5] Velaseo L, Janssen D, Ruiz-Garcia L, et al. The complete nucleotide sequence and development of a differential detection assay for aPeppermildmottlevirus(PMMoV) isolate that overcome L3 resistance in pepper[J]. Journal of Virological Methods, 2002, 106(1): 135-140.
[6] Ikegashira Y, Ohki T, Ichiki U, et al. An immunological system for the detection ofPeppermildmottlevirusin soil from green pepper fields [J]. Plant Disease, 2004, 88(6): 650-656.
[7] Greemleaf W H, Cook A A, Heyn A N J. Resistance toTobaccomosaicvirusin capsicum, with reference to the samsun latent strain [J]. Phytopathology,1964,54(11):1367-1371.
[8] 向本春, 谢浩, 崔星明, 等. 新疆辣椒轻微斑驳病毒的分离鉴定[J]. 病毒学报, 1994, 10(3): 240-245.
[9] Li Xiaodong, An Mengnan, Wu Yuanhua. First report of pepper mild mottle virus in Northeast China [J]. Plant Disease,2016, 100(2):541.
[10]李晓冬, 安梦楠, 王冠中, 等. 辣椒轻斑驳病毒辽宁分离物的鉴定及序列分析[J]. 沈阳农业大学学报, 2016, 47(1): 29-34.
[11]谭根堂, 史联联, 尚慧兰, 等. 陕西线辣椒病毒病病原检测简报[J]. 辣椒杂志, 2003(3): 32-33.
[12]黄粤, 马荣群, 岳文辉. 应用RT-PCR方法检测辣椒轻微斑驳病毒[J]. 山东农业科学, 2004(5): 56-57.
[13]李兴红, 严红, 郭京泽, 等. 种传辣椒轻斑驳病毒病DAS-ELISA的检测[J]. 植物保护, 2005, 31(3): 66-68.
[14]Peng Jiejun, Shi Bingbin, Zheng Hongying, et al. Detection of pepper mild mottle virus in pepper sauce in China [J]. Archives of Virology, 2015, 160: 2079-2082.
[15]Colson P, Richet H, Desnues C, et al. Pepper mild mottle virus, a plant virus associated with specific immune responses, fever, abdominal pains, and pruritus in humans [J]. PLoS ONE, 2010, 5(4): 1-12.
(责任编辑:田 喆)
Identification, whole-genome sequencing and phylogenetic analysis ofPeppermildmottlevirusFengcheng isolate
Zhu Huaiting, Li Xiaodong, Hou Huihui, Xu Qianhui, An Mengnan
(CollegeofPlantProtection,ShenyangAgriculturalUniversity,Shenyang110866,China)
Peppermildmottlevirus(PMMoV), a member ofTobamovirus, is a major viral pathogen of pepper. In recent years, PMMoV has caused great loss to pepper production in Liaoning Province. In this study, PMMoV was first identified in Fengcheng City by using DAS-ELISA and RT-PCR method, and named as PMMoV Fengcheng isolate (PMMoV-FC). Three pairs of specific primers were used to amplify the complete genome sequence of PMMoV-FC, and the results of sequence analysis and phylogenetic analysis showed that PMMoV-FC was closely related with 9 PMMoV isolates reported in China or abroad with a sequence identity of between 94.3%-99.7%. Phylogenetic tree was constructed, showing that PMMoV-FC was closely related with Chinese domestic isolate, Japanese isolate and southern American isolate but not with South Korean isolate or Spanish isolate. Due to the significant losses caused by PMMoV to pepper, further research is required to control and prevent the prevailing of the diseases caused by PMMoV-FC in Liaoning Province.
PMMoV; RT-PCR; whole-genome sequencing; phylogenetic analysis
2016-05-09
2016-06-15
公益性行业(农业)科研专项(201303028);沈阳农业大学2016大学生创新训练计划项目
S 436.418
A
10.3969/j.issn.0529-1542.2017.02.009
* 通信作者 E-mail:anmengnan1984@163.com
