艾拉莫德分别联合甲氨蝶呤和双醋瑞因对难治性类风湿关节炎患者相关指标的影响比较
2017-03-29李连菊王京旭邢台市人民医院风湿免疫科河北邢台054000
李连菊,王京旭(邢台市人民医院风湿免疫科,河北邢台 054000)
艾拉莫德分别联合甲氨蝶呤和双醋瑞因对难治性类风湿关节炎患者相关指标的影响比较
李连菊*,王京旭(邢台市人民医院风湿免疫科,河北邢台 054000)
目的:比较艾拉莫德分别联合甲氨蝶呤和双醋瑞因对难治性类风湿关节炎(RRA)患者相关指标的影响。方法:98例RRA患者随机分为对照组(48例)和观察组(50例)。对照组患者口服艾拉莫德片25 mg,每日2次+甲氨蝶呤片初始剂量10 mg,每周1次,2周后增加至12.5 mg,并于第2个周期加量至15 mg,每周1次。观察组患者口服艾拉莫德片(用法用量同对照组)+双醋瑞因胶囊50 mg,每日2次。两组均以4周为1个周期,共治疗6个周期。观察两组患者治疗前后晨僵时间、28个关节压痛数、28个关节肿胀数、28个关节的疾病活动度(DAS28)评分、红细胞沉降率(ESR)、类风湿因子(RF)、白细胞介素1(IL-1)、血管内皮生长因子(VEGF)、肿瘤坏死因子α(TNF-α)、C反应蛋白(CRP)、丙二醛(MDA)、超氧化物歧化酶(SOD)、总抗氧化能力(TAOC)、早期血流峰值(E峰)、左室舒张晚期血流峰值(A峰)、E/A、左室射血分数(LVEF)及不良反应发生情况。结果:治疗后,两组患者晨僵时间、28个关节压痛数、28个关节肿胀数、DAS28评分、ESR、RF、IL-1、TNF-α、CRP、VEGF、MDA、TAOC、A峰均显著低于同组治疗前,且观察组显著低于对照组;两组患者SOD、E峰、E/A、LVEF均显著高于同组治疗前,且观察组显著高于对照组,差异均有统计学意义(P<0.05)。两组患者不良反应发生率比较,差异无统计学意义(P>0.05)。结论:艾拉莫德联合双醋瑞因治疗RRA在改善患者心功能、氧化-抗氧化系统失衡及降低炎症反应作用方面均优于艾拉莫德联合甲氨蝶呤,而两者安全性相当。
难治性类风湿关节炎;艾拉莫德;甲氨蝶呤;双醋瑞因;心功能;炎症反应;安全性
类风湿关节炎(RA)是一种主要累及周围关节的多系统炎症性自身免疫性疾病,随着疾病的进展可致软骨及骨质破坏,甚至残疾。据了解,我国RA的发病率为0.2%~0.4%,是引起残疾和功能障碍的主要原因之一[1]。RA可影响心功能,导致心内膜、心肌、心脏的传导系统改变,是心血管病变的独立危险因素,其中免疫失调和炎症在RA合并心血管病变中占重要地位[2],但发生机制尚不明确。目前,临床尚无治疗RA的特效药物,常给予非甾体类抗炎药、改善病情抗风湿药(DMARDs)等单用或联合治疗,但仍有部分患者病情无法缓解,成为难治性类风湿关节炎(RRA)。艾拉莫德、甲氨蝶呤、双醋瑞因均是临床治疗RRA的常用药物。前期有研究证实,艾拉莫德单用或分别联合甲氨蝶呤、双醋瑞因治疗RRA,可减轻临床症状,抑制关节破坏进展[3-4]。为此,在本研究中笔者比较了艾拉莫德分别联合甲氨蝶呤和双醋瑞因对RRA患者相关指标的影响,旨在为临床提供参考。
1 资料与方法
1.1 研究对象
选择2013年8月-2015年8月我院收治的98例RRA患者,将所有患者按随机数字表法分为观察组(50例)和对照组(48例)。观察组男性34例,女性16例;年龄19~69岁,平均(42.58±4.08)岁;病程1~13年,平均(5.19±1.71)年。对照组男性33例,女性15例;年龄18~65岁,平均(41.05±4.19)岁;病程1~15年,平均(5.66±1.87)年。两组患者性别、年龄、病程等基本资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究方案经医院医学伦理委员会审核通过,所有患者均签署了知情同意书。
1.2 纳入/排除/脱落标准
纳入标准:①符合《临床诊疗指南(风湿病分册)》[5]中的RA诊断标准,并经非甾体类抗炎药和2种以上DMARDs治疗>6个月或1种DMARDs治疗>1年无效;②均无原发性心血管疾病。排除标准:①其他风湿性自身免疫性疾病者;②合并严重肝、肾功能及心功能异常者;③造血系统疾病、急性或慢性感染性疾病、恶性肿瘤者;④入组前4周服用免疫抑制剂或糖皮质激素者;⑤妊娠期或哺乳期妇女;⑥药物过敏者。脱落标准:①出现严重不良反应,无法继续治疗;②主观认为药物治疗无效而主动退出本研究;③未按照规定服药;④资料不完整。
1.3 治疗方法
对照组患者口服艾拉莫德片(先声药业有限公司,规格:25 mg/片,批准文号:国药准字H20110084)25 mg,每日2次+甲氨蝶呤片(湖南正清制药集团股份有限公司,规格:2.5 mg/片,批准文号:国药准字H19983205)初始剂量10 mg,每周1次,2周后增加至12.5 mg,并于第2个周期加量至15 mg,每周1次。观察组患者口服艾拉莫德片(用法用量同对照组)+双醋瑞因胶囊(TRB Pharma S.A,规格:50 mg/粒,批准文号:国药准字H20150131)50 mg,每日2次。两组均以4周为1个周期,共治疗6个周期[6]。
1.4 观察指标
1.4.1 治疗前后晨僵时间、28个关节压痛数、28个关节肿胀数、28个关节的疾病活动度(DAS28)评分、红细胞沉降率(ESR)、类风湿因子(RF) 采用免疫速率散射比浊法测定RF(试剂盒由美国贝克曼库尔特公司提供);采用DRAGONMED 2010全自动血沉仪(芬兰DRAGONMED公司)测定ESR(试剂盒为配套试剂)。
1.4.2 治疗前后白细胞介素1(IL-1)、血管内皮生长因子(VEGF)、肿瘤坏死因子α(TNF-α)、C反应蛋白(CRP) 采用酶联免疫吸附法(ELISA)测定IL-1、VEGF、TNF-α(试剂盒由北京晶美生物公司提供);采用免疫速率散射比浊法测定CRP(试剂盒由上海北加生化试剂公司提供)。
1.4.3 治疗前后丙二醛(MDA)、超氧化物歧化酶(SOD)、总抗氧化能力(TAOC) 采用硫代巴比妥酸法测定MDA,采用羟胺法测定SOD,采用比色法测定TAOC(试剂盒均由南京建成生物工程研究所提供)。
1.4.4 治疗前后早期血流峰值(E峰)、左室舒张晚期血流峰值(A峰)、E/A、左室射血分数(LVEF) 采用VIVID7超声诊断仪(美国GE公司)测定E峰、A峰、E/ A、LVEF。
1.4.5 不良反应 两组患者治疗期间的不良反应发生情况。
1.5 统计学方法
采用SPSS 19.0统计软件对数据进行分析。计量资料以±s表示,采用t检验;计数资料以率表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者完成研究情况
观察组有6例患者脱落,44例完成治疗;对照组有7例患者脱落,41例完成治疗。
2.2 两组患者治疗前后晨僵时间、28个关节压痛数、28个关节肿胀数、DAS28评分、ESR和RF比较
治疗前,两组患者晨僵时间、28个关节压痛数、28个关节肿胀数、DAS28评分、ESR和RF比较,差异均无统计学意义(P>0.05)。治疗后,两组患者晨僵时间、28个关节压痛数、28个关节肿胀数、DAS28评分、ESR和RF均显著低于同组治疗前,且观察组显著低于对照组,差异均有统计学意义P<0.05),详见表1。
2.3 两组患者治疗前后IL-1、TNF-α、CRP和VEGF比较
治疗前,两组患者IL-1、TNF-α、CRP和VEGF比较,差异均无统计学意义(P>0.05)。治疗后,两组患者IL-1、TNF-α、CRP和VEGF均显著低于同组治疗前,且观察组显著低于对照组,差异均有统计学意义(P<0.05),详见表2。
表1 两组患者治疗前后晨僵时间、28个关节压痛数、28个关节肿胀数、DAS28评分、ESR和RF比较(±s)Tab 1 Comparison of the morning stiffness time,the numbers of 28 joints with pressing pain and swelling,DAS28 score,ESR and RF between 2 groups before and after treatment(±s)

表1 两组患者治疗前后晨僵时间、28个关节压痛数、28个关节肿胀数、DAS28评分、ESR和RF比较(±s)Tab 1 Comparison of the morning stiffness time,the numbers of 28 joints with pressing pain and swelling,DAS28 score,ESR and RF between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别观察组44 n对照组RF,IU/mL 139.42±32.64 65.26±19.52*#141.48±33.05 89.42±20.15*41时段治疗前治疗后治疗前治疗后晨僵时间,h 3.18±1.05 1.04±0.75*#3.21±1.13 1.52±0.87*28个关节压痛数,个12.02±3.023.24±1.51*#11.96±3.415.10±1.68*28个关节肿胀数,个13.24±3.854.18±1.20*#13.57±4.167.24±3.58*DAS28,分7.01±1.63 3.85±1.10*#7.14±1.58 5.76±1.34*ESR,mm/h 71.26±7.05 35.14±5.20*#69.75±8.02 47.26±6.13*
表2 两组患者治疗前后IL-1、TNF-α、CRP和VEGF比较(±s)Tab 2 Comparison of IL-1,TNF-α,CRP and VEGF between 2 groups before and after treatment(±s)
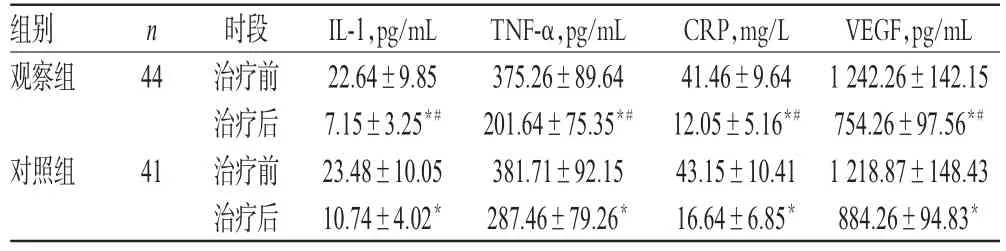
表2 两组患者治疗前后IL-1、TNF-α、CRP和VEGF比较(±s)Tab 2 Comparison of IL-1,TNF-α,CRP and VEGF between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
VEGF,pg/mL 1 242.26±142.15 754.26±97.56*#1 218.87±148.43 884.26±94.83*组别观察组n 44对照组41时段治疗前治疗后治疗前治疗后IL-1,pg/mL 22.64±9.85 7.15±3.25*#23.48±10.05 10.74±4.02*TNF-α,pg/mL 375.26±89.64 201.64±75.35*#381.71±92.15 287.46±79.26*CRP,mg/L 41.46±9.64 12.05±5.16*#43.15±10.41 16.64±6.85*
2.4 两组患者治疗前后MDA、SOD和TAOC比较
治疗前,两组患者MDA、SOD和TAOC比较,差异均无统计学意义(P>0.05)。治疗后,两组患者MDA和TAOC均显著低于同组治疗前,且观察组显著低于对照组;两组患者SOD显著高于同组治疗前,且观察组显著高于对照组,差异均有统计学意义(P<0.05),详见表3。
表3 两组患者治疗前后MDA、SOD和TAOC比较(±s)Tab 3 Comparison of MDA,SOD and TAOC between 2 groups before and after treatment(±s)
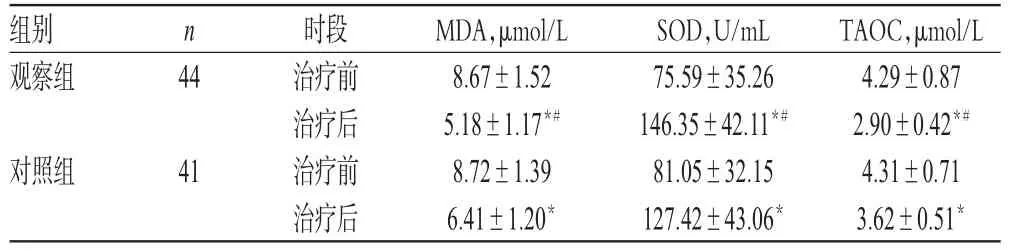
表3 两组患者治疗前后MDA、SOD和TAOC比较(±s)Tab 3 Comparison of MDA,SOD and TAOC between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
TAOC,μmol/L 4.29±0.87 2.90±0.42*#4.31±0.71 3.62±0.51*组别观察组n 44对照组41时段治疗前治疗后治疗前治疗后MDA,μmol/L 8.67±1.52 5.18±1.17*#8.72±1.39 6.41±1.20*SOD,U/mL 75.59±35.26 146.35±42.11*#81.05±32.15 127.42±43.06*
2.5 两组患者治疗前后E峰、A峰、E/A和LVEF比较
治疗前,两组患者E峰、A峰、E/A和LVEF比较,差异均无统计学意义(P>0.05)。治疗后,两组患者E峰、E/A和LVEF均显著高于同组治疗前,且观察组显著高于对照组;两组患者A峰显著低于同组治疗前,且观察组显著低于对照组,差异均有统计学意义(P<0.05),详见表4。
2.6 不良反应
两组患者不良反应发生率比较,差异无统计学意义(P>0.05),详见表5。
表4 两组患者治疗前后E峰、A峰、E/A和LVEF比较(±s)Tab 4 Comparison of peak E,peak A,E/A and LVEF between 2 groups before and after treatment(±s)
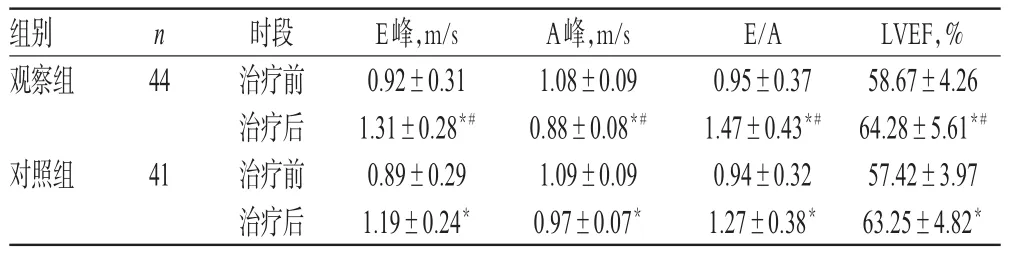
表4 两组患者治疗前后E峰、A峰、E/A和LVEF比较(±s)Tab 4 Comparison of peak E,peak A,E/A and LVEF between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别观察组LVEF,% 58.67±4.26 64.28±5.61*#57.42±3.97 63.25±4.82*n 44对照组41时段治疗前治疗后治疗前治疗后E峰,m/s 0.92±0.31 1.31±0.28*#0.89±0.29 1.19±0.24*A峰,m/s 1.08±0.09 0.88±0.08*#1.09±0.09 0.97±0.07*E/A0.95±0.37 1.47±0.43*#0.94±0.32 1.27±0.38*
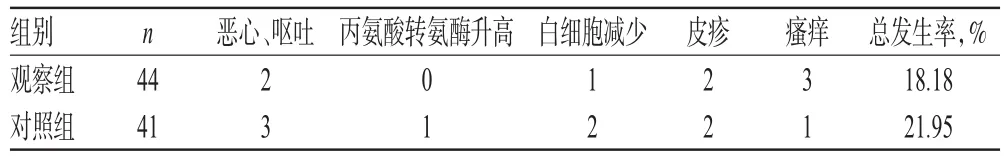
表5 两组患者不良反应发生率比较(例)Tab 5 Comparison of the incidence of adverse reactions between 2 groups(case)
3 讨论
RA患者心功能损伤发生较为隐匿,常表现为瓣膜受累、心脏传导系统发生变化等,加之甾体和非甾体药物的应用,也会直接或间接引起心功能损伤。有学者报道,RA发病时往往伴随动脉粥样硬化形成,随病情进展而加重[7]。崔轶霞[8]研究发现,RA患者的心血管事件发生率高于正常人。细胞因子在RA发展中起重要参与作用,IL-1、CRP等细胞因子可通过诱导T细胞及B细胞活化,产生自身抗体,破坏全身免疫系统的稳定性。近年来临床研究发现,IL-1、CRP等细胞因子大量释放是RA患者发生心功能损伤的重要原因[9]。RA微环境特点为关节腔内低氧状态、大量致炎因子和大量血管新生活性分子,而大量血管新生活性分子不仅可为增生的滑膜细胞提供营养物质,还可刺激炎症因子释放,加速炎症因子浸润,发生心功能损伤。
研究证实,氧化-抗氧化系统失衡是导致RA患者心功能损伤的重要原因[10]。SOD属于一种抗氧化酶,可清除生物体内的氧自由基;MDA是体内脂质过氧化产物,可反映机体细胞受氧自由基损伤程度;TAOC与机体内氧自由基清除能力密切相关,其水平越高,氧自由基清除能力越强。有学者指出,机体氧化-抗氧化系统失衡会造成大量氧化还原产物堆积,造成氧化应激损伤,进而诱发心功能损伤[11]。
艾拉莫德为新型抗风湿类药物,是临床应用较为广泛的DMARDs,除具有抗炎、抑制细胞因子生成、促进骨形成的作用外,还具有较强的抑制环氧化酶-2作用,与其他DMARDs相比,具有起效快、疗效好的优势。朱琦等[12]研究发现,艾拉莫德可降低IL-8、血清胱抑素C、CRP水平。甲氨蝶呤是临床治疗RA的常用药物,欧洲抗风湿病联盟(EULAR)推荐其作为治疗RA的首选药物[13]。该药属于DMARDs,可竞争性地与二氢叶酸还原酶结合,抑制其转化;抑制缓激肽、P物质释放;抑制滑膜刺激因子释放,发挥抗炎和免疫抑制的作用。2012年美国风湿病协会(ACR)推荐甲氨蝶呤与DMARDs联合治疗RRA[14]。许百洁等[15]研究指出,甲氨蝶呤联合艾拉莫德治疗RA的效果优于单用甲氨蝶呤。Ishiguro N等[16]研究发现,甲氨蝶呤联合艾拉莫德可提高RRA患者的疼痛缓解率。
IL-1是RA中重要的促炎症因子,可刺激下破骨细胞增殖、分化,抑制破骨细胞增殖;刺激破骨细胞释放酸性蛋白水解酶,加速骨吸收;大量积聚和释放会造成骨膜发炎,引起炎症性连锁反应,加重原发病情。双醋瑞因属于IL-1抑制剂,其代谢产物可抑制细胞因子释放引起的炎症反应,抗炎、诱导骨生成作用明确,且能在短时间内改善疼痛、关节障碍症状。美国食品药品管理局于2001年批准双醋瑞因在用于DMARDs治疗无效的RRA中,可单独给药,也可与DMARDs联合用药[17]。
本研究结果显示,治疗后两组患者晨僵时间、28个关节压痛数、28个关节肿胀数、DAS28评分、ESR、RF、IL-1、TNF-α、CRP、VEGF、MDA、TAOC和A峰均显著低于同组治疗前,且观察组显著低于对照组;两组患者SOD、E峰、E/A和LVEF均显著高于同组治疗前,且观察组显著高于对照组,差异均有统计学意义。两组患者不良反应发生率比较,差异无统计学意义。
综上所述,艾拉莫德联合双醋瑞因治疗RRA在改善患者心功能、氧化-抗氧化系统失衡及降低炎症反应作用方面均优于艾拉莫德联合甲氨蝶呤,而两者安全性相当。本研究存在的局限性:(1)纳入的样本量较小,需进行大样本、多中心、前瞻性研究,提高研究结果的客观性;(2)随访时间短,有待延长随访时间,了解远期疗效;(3)本研究主要分析了氧化应激反应、炎症指标在保护心功能中的作用,但其作用机制还有待进一步研究。
[1] 薛太平.影像学诊断对类风湿性关节炎的诊断、治疗及预后评估[J].中国CT和MRI杂志,2015,13(8):105-107.
[2] 张晶,刘建,周婷,等.白介素17及单核细胞趋化因子-1与长程类风湿关节炎患者血管病变的相关性研究[J].实用医院临床杂志,2015,12(5):62-64、65.
[3] 孟德钎,潘文友,刘焱,等.艾拉莫德联合甲氨蝶呤对难治性类风湿关节炎患者血管新生相关细胞因子的影响[J].医药导报,2016,35(2):153-156.
[4] 韩丹.双醋瑞因联合甲氨蝶呤和来氟米特治疗老年人类风湿关节炎的疗效分析[J].中华老年医学杂志,2014,33(7):775-778.
[5] 中华医学会.临床诊疗指南:风湿病分册[M].北京:人民卫生出版社,2010:1-11.
[6] 张斌,王宏智,顾娟芳,等.艾拉莫德治疗类风湿关节炎对骨代谢的影响及临床疗效[J].中华全科医学,2015,13(3):364-366.
[7] 常文静,蔡辉.类风湿关节炎早发动脉粥样硬化机制的研究进展[J].中国免疫学杂志,2015,31(3):426-428、432.
[8] 崔轶霞.类风湿关节炎患者心血管病变的发生机制与治疗措施[J].中国医药导报,2012,9(18):63-64.
[9] 汪汉.心功能与类风湿关节炎[J].心血管病学进展,2013,34(5):690-694.
[10] 孙玥,刘健,万磊,等.类风湿关节炎患者心肺功能变化及与B、T淋巴细胞衰减因子及氧化应激的相关性分析[J].
免疫学杂志,2015,31(3):234-239.
[11] 陆瑶,刘国华,袁洪.抗氧化剂治疗心血管疾病的临床研究进展[J].中国药房,2013,24(20):1910-1912.
[12] 朱琦,宋经略,徐云芝,等.艾拉莫德对类风湿关节炎临床疗效及T辅助细胞亚群调节作用的研究[J].中华风湿病学杂志,2016,20(2):93-99.
[13] 张琼,刘锦华.艾拉莫德:治疗类风湿关节炎的一种新选择[J].实用医学杂志,2014,30(1):160-161.
[14] Singh JA,Furst DE,Bharat A,et al.2012 update of the 2008 American college of rheumatology recommendations for the use of disease-modifying antirheumatic drugs and biologic agents in the treatment of rheumatoid arthritis [J].Arthritis Care Res:Hoboken,2012,64(5):625-639.
[15] 许百洁,莫守崎,薛晓倩,等.甲氨蝶呤联合艾拉莫德治疗类风湿关节炎的临床研究[J].实用临床医药杂志,2015,19(1):120-122.
[16] Ishiguro N,Yamamoto K,Katayama K,et al.Concomitant iguratimod therapy in patients with active rheumatoid arthritis despite stable doses of methotrexate:a randomized,double-blind,placebo-controlled trial[J].Mod Rheumatol,2013,23(3):430-439.
[17] 杨仓良.难治性类风湿关节炎的诊疗思路探讨[J].世界中医药,2011,6(2):93-95.
(编辑:陈 宏)
Comparison of the Effects of Iguratimod Combined with Methotrexate and Diacerein Respectively on Related Indexes of Refractory Rheumatoid Arthritis
LI Lianju,WANG Jingxu(Dept.of Rheumatism and Immunology,People’s Hospital of Xingtai,Hebei Xingtai 054000,China)
OBJECTIVE:To compare the effects of iguratimod combined with methotrexate and diacerein respectively on related indexes of refractory rheumatoid arthritis(RRA).METHODS:98 RRA patients were randomly divided into control group(48 cases)and observation group(50 cases).Control group received Iguratimod tablet 25 mg,twice a day+Methotrexate tablet with initial dose of 10 mg,once a week,increased to 12.5 mg after 2 weeks,increased to 15 mg in the second courses,once a week.Observation group received Iguratimod tablet(the same dosage and usage with control group)+Diacerein granule 50 mg,twice a day. 4-week was a course,they were treated for 6 courses.Morning stiffness time,the numbers of 28 joints tenderness and swelling,28 joint disease activity score(DAS28),erythrocyte sedimentation rate(ESR),rheumatoid factor(RF),IL-1,vascular endothelial growth factor(VEGF),tumor necrosis factor(TNF)-α,C-reaction protein(CRP),malondialdehyde(MDA),superoxide dismutase(SOD),total antioxidant capacity(TAOC),early peak flow(peak E),left ventricular late flow peak flow(peak A),E/A and left ventricular ejection fraction(LVEF)before and after treatment,and the incidence of adverse reactions in 2 groups were observed.RESULTS:Before treatment,morning stiffness time,the numbers of 28 joints tenderness and swelling,DAS28 score,ESR,RF,IL-1,TNF-α,CRP,VEGF,MDA,TAOC and peak A in 2 groups were significantly lower than before treatment,and observation group was significantly lower than control group;SOD,peak E,E/A and LVEF in 2 groups were significantly higher than before treatment,and observation group was significantly higher than control group,with statistical significances(P<0.05). And there was no significant difference in the incidence of adverse reactions(P>0.05).CONCLUSIONS:Iguratimod combined with diacerein is superior to iguratimod combined with methotrexate in improving cardiac function,oxidation-antioxidant imbalance play and reducing inflammatory reactions in the treatment of RRA,with similar safety.
Refractory rheumatoid arthritis;Iguratimod;Methotrexate;Diacerein;Cardiac function;Inflammatory reaction;Safety
R684.3
A
1001-0408(2017)06-0769-04
2016-07-07
2016-12-16)
*副主任医师。研究方向:类风湿性关节炎。E-mail:1806247750@qq.com
DOI10.6039/j.issn.1001-0408.2017.06.14
