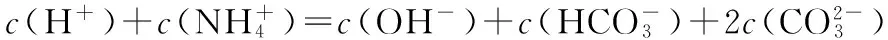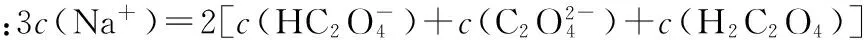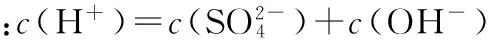剖析近年高考试题,突破电解质溶液中离子浓度大小比较
2017-03-28湖北文丽娟杨恩健
湖北 文丽娟 杨恩健
(作者单位:陕西省永寿县中学)
(作者单位:湖北省襄阳市一中 湖北省襄阳市四中)
剖析近年高考试题,突破电解质溶液中离子浓度大小比较

分析近几年全国及部分省市的高考试题看来,电解质溶液中离子浓度大小比较频繁出现。这是高考的重点考点,也是学生觉得困难的题型之一,同时也是我们复习备考时觉得较棘手的问题。
一、多元弱酸、弱碱溶液
【例1】(2014天津)下列有关电解质溶液中粒子浓度关系正确的是
( )


【解题指导】根据多步电离分析。弱酸:c(酸)>c(H+)>c(酸式酸根离子)>c(酸根离子)>c(OH-)
弱碱:c(碱)>c(OH-)>c(阳离子)>c(H+)
二、多元弱酸的正盐及酸式盐溶液
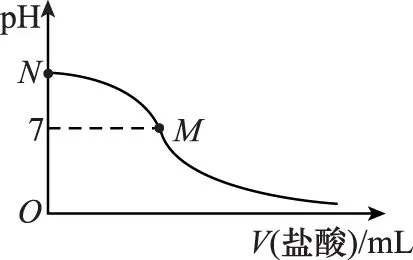
【例2】 (2016四川,7)向1 L含0.01 mol NaAlO2和0.02 mol NaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01 mol ( ) 【答案】D 答案:+41.2 例6 (2016江苏)通过以下反应均可获取H2,下列有关说法正确的是 ( ) A.反应①中电能转化为化学能 B.反应②为放热反应 C.反应③使用催化剂,ΔH3减小 答案:D (作者单位:陕西省永寿县中学) 【解题指导】 规律:①盐电离离子>离子第一步水解(电离)>水的电离离子>第二步水解粒子 ②第一步水解生成的粒子浓度在c(OH-)和c(H+)之间,第二步水解生成的粒子浓度最小 【例3】(2014全国Ⅱ,11节选)一定温度下,下列溶液的离子浓度关系式正确的是 ( ) D.pH相同的①CH3COONa ②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ 【解析】酸性:CH3COOH>H2CO3>HClO,根据盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,物质的量浓度相同时,溶液的碱性越强,pH越大,故pH相同的①CH3COONa ②NaHCO3③NaClO三种溶液的c(Na+):①>②>③,正确。 【解题指导】要分析溶液中其他离子对该离子的影响。 混合溶液中各离子浓度的比较,要进行综合分析。溶液中反应物是否过量,反应后溶液是酸性,还是碱性,以电离为主,还是以水解为主等问题要全面分析后再下结论。 (1)电解质溶液相互不反应 【例4】①等物质的量浓度的醋酸和醋酸钠溶液等体积混合,所有粒子浓度大小关系:___________。 ②等物质的量浓度一水合氨和氯化铵溶液等体积混合,所有粒子浓度大小关系:___________。 【解析】①等体积、等物质的量浓度的醋酸和醋酸钠混合,醋酸的电离程度大于醋酸根离子的水解程度,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可得:c(CH3COO-)>c(Na+)>c(CH3COOH),则溶液中溶液中离子浓度大小关系为c(CH3COO-)>(Na+)>c(CH3COOH)>c(H+)>c(OH-)。 (2)电解质溶液相互反应 【例5】(2016全国Ⅰ,12节选)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是 ( ) 【解题指导】两种(或多种)物质相混合:先考虑这两种物质能否发生反应、反应后溶液中剩余的物质是强电解质还是弱电解质。 ①如果恰好完全反应,则考虑生成的物质是什么,然后按照只有一种物质作溶质进行处理;若溶液中有酸或碱存在,要考虑酸和碱的电离,即溶液相应地显酸性或碱性;若溶液中的溶质仅为盐,则考虑盐水解情况。 ②若溶液中有过量的,就必须考虑最终溶液中的溶质组分的电离或水解情况。 1.电荷守恒 【例6】(2015四川,节选)常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得溶液pH<7,下列关于滤液中的离子浓度关系不正确的是 ( ) 2.物料守恒 【例7】(2014天津,节选)下列有关电解质溶液中粒子浓度关系正确的是 ( ) 3.质子守恒 【例8】(2014天津,节选)下列有关电解质溶液中粒子浓度关系正确的是 ( ) 4.三个守恒联立、变形 ( ) 【解题指导】(1)电荷守恒:电解质溶液中,不论存在多少种离子,电解质溶液总是呈中性,即阳离子所带正电荷总数等于阴离子所带负电荷总数。 (2)物料守恒:在电解质溶液中,虽然某些离子能够水解同时也能够电离,但原子不论以何种形式存在,个数总是不变的,即原子守恒。 (3)质子守恒:指溶液中酸碱反应的结果,得质子后的产物的物质的量与失质子后的产物的物质的量相等。 溶液中离子浓度大小比较的方法思路 (作者单位:湖北省襄阳市一中 湖北省襄阳市四中)
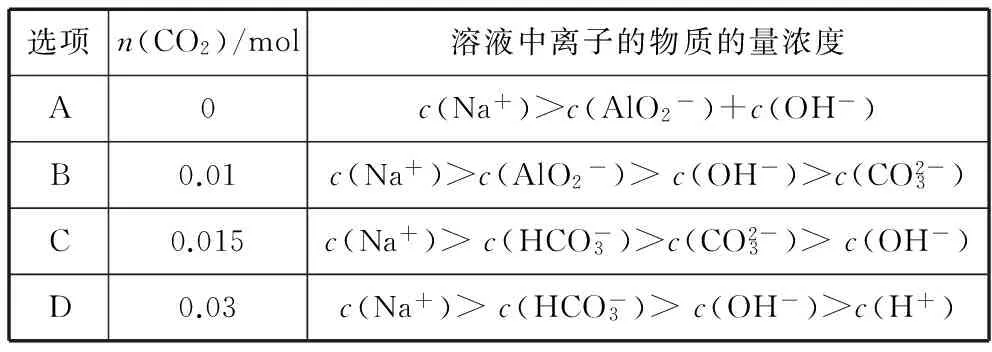
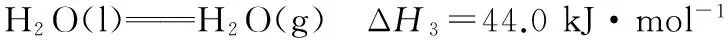
题型六:综合性判断





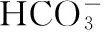
三、不同溶液中同一离子浓度大小的比较
四、混合溶液中各离子浓度的大小比较
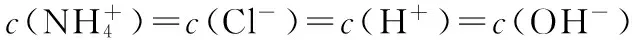
五、三个守恒的应用