Eimeria tenlla和E.acervulina对凋亡诱导抑制的研究
2017-03-28赵晨璐王黎霞宋丽聪郑新枫张建军阮文科安健
赵晨璐,王黎霞,宋丽聪,郑新枫,张建军,阮文科,安健
(1.北京农学院动物科学技术学院,北京昌平102206; 2.北京农业职业学院畜牧兽医系,北京房山102442)
Eimeria tenlla和E.acervulina对凋亡诱导抑制的研究
赵晨璐1,王黎霞2,宋丽聪1,郑新枫1,张建军1,阮文科1,安健1
(1.北京农学院动物科学技术学院,北京昌平102206; 2.北京农业职业学院畜牧兽医系,北京房山102442)
为了研究鸡艾美耳属球虫不同种在入侵细胞早期对凋亡诱导抑制的差异,将柔嫩艾美耳球虫(Eimeria tenlla)和堆型艾美耳球虫(E.acervulina)纯化的裂殖子入侵马-达氏牛肾细胞(MDBK细胞)1.5 h后,对被入侵的细胞计数并计算入侵率;加入含6%乙醇的完全培养基对细胞诱导凋亡3 h,检测细胞凋亡率。结果表明,E.tenlla裂殖子和E.acervulina裂殖子入侵率为21%和43%;凋亡诱导组的凋亡率是36.98%;柔嫩艾美耳球虫凋亡诱导组的凋亡率是25.77%;堆型艾美耳球虫凋亡诱导组的凋亡率是28.92%。柔嫩艾美耳球虫凋亡诱导组与凋亡诱导组之间差异极显著(P<0.01);堆型艾美耳球虫凋亡诱导组与凋亡诱导组之间差异极显著(P<0.01)。柔嫩艾美耳球虫凋亡诱导组与堆型艾美耳球虫凋亡诱导组之间差异显著(P<0.05)。结果提示,E.acervulina裂殖子入侵细胞并起到明显的抑制细胞凋亡作用,在入侵早期也许有类似于E.tenlla裂殖子抑制凋亡的机制;与E.tenlla裂殖子的抑制率相比略低,这可能与它的个体大小、致病能力有关。
球虫;艾美耳属;裂殖子;凋亡抑制;MDBK细胞
艾美耳属的7种顶复门寄生虫导致的鸡球虫病,给全世界的家禽养殖业造成巨大的经济损失,控制其发病迫在眉睫,深入研究球虫与被入侵细胞之间的相互作用机制是防治该病的基础。
细胞凋亡是程序性的细胞死亡,某些病原体却可以延长宿主细胞的生命来确保它们能在细胞内生长、发育、繁殖。据报道,弓形虫能够改变细胞凋亡机制,促进或抑制宿主细胞凋亡[1]。球虫子孢子会在发展早期阶段保护宿主细胞避免发生凋亡;另外,宿主细胞凋亡的抑制有利于柔嫩艾美耳球虫在细胞内生长发育[2]。
为了对球虫的早期入侵有更全面更透彻的认识,本试验分别用E.tenlla和E.acervulina入侵细胞,以6%乙醇的完全培养基为诱导凋亡剂,用光学显微镜观察入侵情况,流式细胞术检测细胞的凋亡率,分析两种球虫的抑制凋亡能力差异,探讨球虫与宿主细胞的作用机制,为防治球虫病的发生提供理论基础。
1 材料与方法
1.1 毒株E.tenlla和E.aceverlina孢子化卵囊,北京农学院病理实验室提供,复壮周期为3个月。
1.2 细胞MDBK细胞,本实验室保存用于鸡球虫研究的贴壁细胞系。
1.3 试验动物刚出壳健康农大5号公鸡雏,将其饲养于照明充足,经过消毒的无球虫环境中。用不加药饲料喂养至12日龄,同时公雏鸡在此过程不受污染,自由饮食。
1.4 方法
1.4.1 卵囊的感染分A,B两组。A组:20只12日龄健康雏鸡口腔灌服E.tenlla孢子化卵囊7×104个/只;B组:在A组雏鸡灌服36 h后,20只无感染健康雏鸡灌服E.acervulina孢子化卵囊2×105个/只。
1.4.2 裂殖子的获取及纯化在灌服E.tenlla孢子化卵囊4.5 d,即灌服E.acervulina卵囊3 d后,将试验鸡分别剖检。将感染E.tenlla卵囊的鸡盲肠剪开,于冰浴中刮取肠道黏膜,匀浆,离心收集沉淀,后离心收集上清,除去红细胞等;再次离心收集沉淀,加40℃温热的洗脱液重悬备用。准备DE-52纤维层析柱,将悬有裂殖子的洗脱液缓慢加入,收集E.tenlla裂殖子。E.acervulina裂殖子取十二指肠用同样的方法收集。
1.4.3 MDBK细胞的培养将保存于液氮中的MDBK细胞于1 min内在37℃水浴中快速溶解,转移到细胞瓶,缓慢加入DMEM完全培养基后,用移液枪吹吸混匀,在细胞CO2培养箱培养2 h,换新的完全培养基。待细胞长至细胞瓶80%~90%,进行传代。细胞传至3~5代即可。
1.4.4 试验分组A组:对照组;B组:凋亡诱导组;C组:柔嫩艾美耳球虫组;D组:柔嫩艾美耳球虫凋亡诱导组;E组:堆型艾美耳球虫凋亡诱导组;F组:堆型艾美耳球虫组。每组做3个重复。
1.4.5 裂殖子的入侵分别加入细胞数量3倍的E.tenlla、E.acervulina裂殖子,入侵细胞1.5 h。在光学显微镜下观察,对被入侵的细胞计数并计算入侵率。入侵率为每个视野中被裂殖子感染的细胞占视野内细胞总数的百分比,重复3次取平均值。
1.4.6 MDBK细胞的凋亡诱导加入含有6%乙醇的完全培养基3 h进行诱导凋亡。
1.4.7 凋亡的检测将处理后的细胞离心收集沉淀,加Binding Buffer重悬;加入PI和Annexin VFITC,混合均匀后避光常温孵育15 min;再加入Binding Buffer检测[3]。
1.4.8 数据处理用SPSS软件对多组MDBK细胞凋亡数据之间的差异进行分析比较,当P<0.05,差异显著;P<0.01,差异极显著。
2 试验结果
2.1 柔嫩艾美耳球虫和堆型艾美耳球虫裂殖子的入侵E.tenlla裂殖子入侵率为21%,E.acervulina裂殖子入侵率为43%(图1A)、(图1B)。
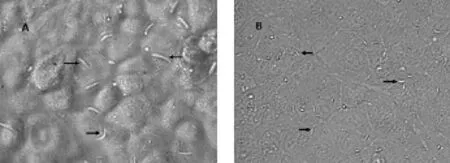
图1 裂殖子入侵细胞Fig.1 Merozoites invade cells
2.2 流式细胞术对凋亡的检测对照组的凋亡率是2.64%(图2A);凋亡诱导组的凋亡率是36.98% (图2B);柔嫩艾美耳球虫组的凋亡率是4.19%(图2C);柔嫩艾美耳球虫凋亡诱导组的凋亡率是25.77%(图2D)堆型艾美耳球虫凋亡诱导组的凋亡率是28.92%(图2E);堆型艾美耳球虫组的凋亡率是7.53%(图2F)。柔嫩艾美耳球虫凋亡诱导组与凋亡诱导组之间差异极显著(P<0.01),抑制凋亡30%;堆型艾美耳球虫凋亡诱导组与凋亡诱导组之间差异极显著(P<0.01),抑制凋亡22%。柔嫩艾美耳球虫凋亡诱导组与堆型艾美耳球虫凋亡诱导组之间差异显著(P<0.05)。
3 讨论
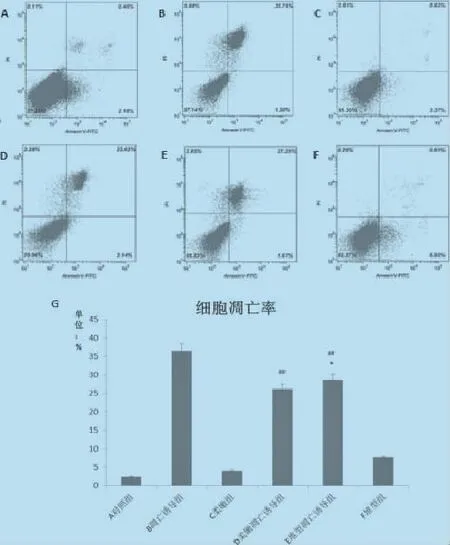
图2 流式细胞术检测MDBK细胞在各种处理方式下的凋亡水平
细胞凋亡线粒体途径是通过介导bcl-2相关X蛋白基因(bcl-2 associated X protein,bax)的表达,诱导细胞色素C的释放,引发caspase级联反应,导致凋亡[4]。本试验发现,E.acervulina在入侵早期也许有类似于E.tenlla或弓形虫抑制凋亡的机制,通过caspase蛋白及各种抗凋亡或促凋亡因子的相互抗衡,达到抑制宿主细胞凋亡的作用。
E.tenlla卵囊平均22×19 μm,E.acervulina卵囊平均大小为8.3×14.6 μm[5]。本研究观察到,E.acervulina裂殖子的长度为6~9 μm,而E.tenlla裂殖子为10~17 μm。E.tenlla,E.acervulina裂殖子入侵率分别为21%和43%;当细胞加入凋亡诱导剂,两者抑制凋亡率分别为22%和30%;虽然在入侵率的对比上,E.acervulina裂殖子高于E.tenlla裂殖子,但从结果看出,前者没有后者抑制凋亡能力强,这也许因为裂殖子抑制凋亡能力与个体大小,裂殖子个体入侵能力有关。个体小从而产生的抑制凋亡的因子相对偏少。
E.tenlla在鸡盲肠上皮细胞中完成内源性生长阶段[6]。E.tenlla常在感染后引起盲肠高度肿胀和严重出血,出现血便,死亡率最高[7]。E.acervulina主要寄生于鸡十二指肠,其次为空肠;病变集中在十二指肠,肠壁有充血、坏死现象,黏膜增厚,严重时甚至死亡。这两种艾美耳球虫寄生部位,产生病理现象的差异说明两种虫子有着不完全一样的入侵机制和致病作用,也许与其抑制宿主细胞凋亡能力的差异有关。
本试验表明,E.acervulina裂殖子入侵MDBK细胞率为43%,高于E.tenlla裂殖子入侵率21%;E.acervulina裂殖子入侵细胞并起到明显的抑制细胞凋亡作用,E.acervulina在入侵早期也许有类似于E.tenlla抑制凋亡的机制,与E.tenlla裂殖子的抑制率相比略低,这可能与它的个体小、致病能力弱有关,两者抑制机制的具体差异有待研究。
[1]Laliberte J,Carruthers V B.Host cell manipulation by the human pathogen Toxoplasma gondii[J].Cellular and Molecular Life Sciences,2008(65):1900-1915.
[2]Zhang Y,Zheng M X,Xu Z Y,et al.Relationship between Eimeria tenella development and host cell apoptosis in chickens[J].Poultry Science,2015,94(12):2970-2979.
[3]宋丽聪,王黎霞,刘新月,等.柔嫩艾美耳球虫裂殖子对侵入细胞凋亡抑制通路的研究[J].中国兽医杂志,2016,52(1): 14-16.
[4]王雪峰,何援利.凋亡调节基因bcl-2/bax与卵巢早衰的关系[J].生殖与避孕,2008,28(8):487-490.
[5]孔繁瑶.家畜寄生虫学[M].北京:中国农业大学出版社,1997:330-331.
[6]Zhang J,Chen P,Sun H,et al.Pichia pastoris expressed EtMic2 protein as a potential vaccine against chicken coccidiosis[J].Veterinary Parasitology,2014,205:62-69.
[7]安健.鸡球虫病与鸡球虫病抗药性[M].北京:中国农业出版社,2011:8.
Theinduced Apoptosis inhibited by Eimeria tenlla and E.acervulina
ZHAO Chen-lu1,WANG Li-xia2,SONG Li-cong1,ZHENG Xin-feng1,ZHANG Jian-jun1,RUAN Wen-ke1,AN Jian1
(1.Animal Science and Technology College,Beijing University of Agriculture,Beijing 102206,China;2.Institute of animal husbandry and veterinary medicine,Beijing Vocational College of Agriculture,Beijing 102442,China)
The aim of study is to investigate the apoptosis inhibition differences of the cells invaded by kinds of Eimeria during early invasion stage.The E.tenlla and E.acervulina merozoites were inoculated in MDBK cells for 1.5 hours,and both the invaded cells were counted and the ratio of invasion was calculated.Completed medium containing 6%ethanol was added to the cells to induce cell apoptosis.After 3 hours,cell apoptosis was detected.The results indicated that the E.tenlla merozoites invasion rate was 21%and the E.acervulina merozoites invasion rate was 43%.The apoptosis rate in the induction of apoptosis group was 36.98%.The induction of apoptosis with E.tenlla group was 25.77%.The apoptosis rate in the induction of apoptosis with E.acervulina group was 28.92%.The apoptosis rate of the control group was 2.64%.The difference between induction of apoptosis with E.tenlla group and induction of apoptosis group was significant(P<0.01).The difference between induction of apoptosis with E.acervulina group and induction of apoptosis group was significant(P<0.01).The difference between induction of apoptosis with E.tenlla group and induction of apoptosis with E.acervulina group was significant(P<0.05).The results suggest that,E.acervulina merozoites could invade cells and play a significant role in inhibition of apoptosis during the early state of invasion.E.acervulina merozoites may have some inhibition mechanism of apoptosis as same as E.tenlla merozoites.The inhibition rate of E.acervulina merozoites is slightly lower than the E.tenlla merozoites,which may be due to its body size or disease-causing ability.
Coccidiosis;Eimeria;Merozoites;Apoptosis;MBDK cell
AN Jian
S855.9
A
0529-6005(2017)01-0013-03
2016-05-09
赵晨璐(1992-),女,硕士生,主要从事兽医寄生虫与分子生物学研究,E-mail:1084188785@qq.com
安健,E-mail:anyh001@bac.edu.cn
