中药多成分药代动力学研究:思路与方法
2017-03-28李川
李川

[摘要] 药物在体内产生药效作用有两个前提条件,其一是给药后药物分子能被机体有效利用(即:能够通过体内的生物屏障到达作用靶位,达到并维持起效浓度);其二是药物分子到达作用靶位的化学形式(原型化合物或代谢物)具有与药效关联的生物活性。中药药代动力学是中药药理学的重要分支,它从中药活性成分能否被机体有效利用的角度,研究与中药药效和安全性相关的物质问题。中药化学组成复杂,通常含众多活性成分,许多中药的发展经过“临床→研究→临床”的过程;与此相对应,化药通常为单一成分,其发展一般经过“研究→临床”的过程;这些带来了中药药代动力学研究有别于化药相关研究的特点。中药药代动力学研究常围绕临床有效中药,为揭示中药药效物质基础迈出关键的一步,并通过“选对成分”和“用好成分”为中药疗效的提高创造条件。作者主要基于其研究团队近年来开展的中药多成分药代动力学研究工作,重点介绍开展这类研究的思路和方法。
[关键词] 多成分药代动力学研究; 中药; 中药药代标识物
[Abstract] There are two prerequisites for the therapeutic action of a drug, i.e., having sufficient bioavailability to and biopersistence at the locus of action after dosing and having intrinsic ability to produce desired pharmacodynamic effects in their major exposure forms, unchanged and metabolized. As a special branch of pharmacology of Chinese herbal medicines, pharmacokinetics is to investigate issues related to the medicines′ efficacy and safety by assessing the herbal ingredients′ bioavailability to and biopersistence at the locus of action in the body. Chinese herbal medicines are often herb combinations of complex mixture and contain multiple bioactive ingredients working in concert. Unlike most investigational synthetic drugs developed from bench to bedside, Chinese herbal medicines are often developed from bedside to bench to bedside. Accordingly, pharmacokinetic research on Chinese herbal medicines could serve as a crucial step in identifying the chemical basis of the medicines′ therapeutic actions and could facilitate development of new herbal medicines with enhanced efficacy and safety by using the right herbal ingredients in the right way. Mainly based on studies by the author′s research group, this article illustrates approach to and methodology of multi-compound pharmacokinetic research on Chinese herbal medicines.
[Key words] multi-compound pharmacokinetic research; Chinese herbal medicines; pharmacokinetic markers for Chinese herbal medicines
經过20年中药现代化的努力,中药制药产业取得了长足进步,其年生产总值从1996年的不足250亿元人民币迅猛增长至2015年的7 800亿元人民币[1]。通过大规模工业化生产,中药被制成片剂、胶囊剂、注射剂等现代药物剂型(中成药),来满足临床用药的巨大需求。然而,由于中药复杂的化学组成及独特的发展历程,目前中药离完全概念的现代药物尚有差距。一方面中药药用价值的评价标准尚低于以化药为代表的现代药物标准,另一方面中药的临床合理使用尚缺足够的科技支持。中药制药产业的可持续发展迫切需要继续推进中药现代化,也就是用现代科学的原理与语言,阐明中药的有效性、安全性和与有效安全关联的质量一致性,提供能够让人听得懂、信得过的科学证据。为使中药成为获得国际普遍认可的现代药物,需针对其特点做好三方面的工作:其一是通过严格的随机对照多中心临床试验以验证中药的有效性和安全性,其二是揭示中药的药效物质基础及作用机理,其三是充分展示并确保与药效和安全性关联的中药质量一致性。围绕中成药品种,做好这些工作将极大地提升其科技内涵与形象、扩大临床用药,促进产业可持续发展。
随着中药制药产业的迅猛发展,近年来出现了一个重要的发展趋势,国内一些大型中药制药企业按现代药物的标准投巨资开展严格的临床试验,以评价其临床用量大的中成药品种的有效性和安全性。麻杏石甘-银翘散、芪苈强心胶囊、芪参益气滴丸、黄葵胶囊等中成药的有效性和安全性在严格的临床试验中得以验证,其研究结果获得国际同行的认可,研究工作发表于相关医学领域的国际权威刊物[2-6]。另外,复方丹参滴丸(NCT00797953)、血脂康胶囊(NCT01327014)、扶正化瘀片(NCT00854087)、康莱特注射液(NCT00733850)、桂枝茯苓胶囊(NCT01588236)等一批中成药先后通过了美国FDA的Ⅱ期临床试验(http://clinicaltrials.gov)[7-8]。这些按现代药物标准所开展的严格临床试验极大地提升了人们对中药有效性和安全性的认识,促进了中药制药产业的进一步发展,未来将有更多的中成药品种进行这样的临床试验。由于中药化学组成复杂,阐明中药的有效性和安全性不仅需要开展严格的临床试验,在此基础上还需进一步揭示中药的药效物质基础。这是因为不明确药效物质基础就不能说明中药是通过哪些化学成分发挥药效作用,也难以说明其药效作用的机制和特点。
药物在体内产生药效作用有2个前提条件,其一是给药后药物分子能被机体有效利用(即:药物分子能够通过体内的生物屏障到达作用靶位,达到并维持起效浓度);其二是药物分子到达作用靶位的化学形式(原型化合物或代谢物)具有与药效关联的生物活性(药效活性)。中药通常含众多化学成分,能够成为药效物质基础的中药成分需要具备一定的条件,简单地讲就是:这些成分应有较好的“类药属性”[9]。所谓类药属性包括:与中药疗效关联的生物活性(药效活性)、用药时的“安全性”、决定能否被机体有效利用的“药代属性”、在中药中的“含量”以及能否与其他药物“和谐共事”。由于中药所含的各化学成分在生物活性、理化性质、含量等方面存在明显差异,因此中药的药效作用可能主要来自其所含的部分关键成分,而非中药所含的全部化学成分。给药后能被机体有效利用且具有药效活性的中药成分最有可能成为中药的药效物质基础,此外也不排除一些含量较低但具有相同药理活性的中药成分通过在体内的“浓度叠加”产生药效作用的可能。面对中药的化学复杂性,作者及其研究团队提出:药代动力学可作为筛选手段,通过考察给药后中药成分能否被机体有效利用,发现值得进一步研究的中药成分,为揭示中药的药效物质基础迈出关键一步[10-11]。
1 开展中药药代动力学研究的思路
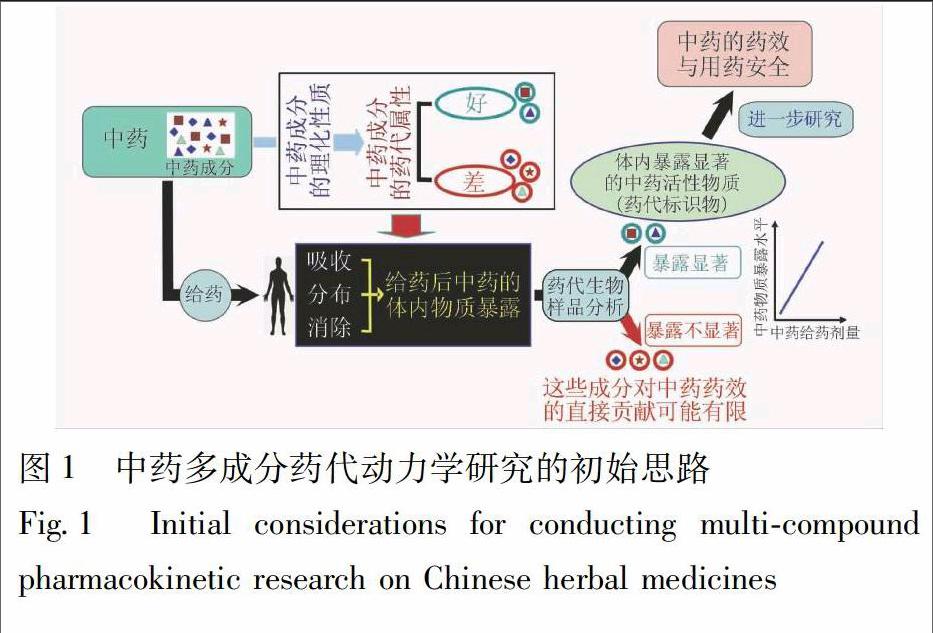
所含成分在给药后能被机体有效利用,是中药在体内产生药效作用的物质前提。对于大多数中药而言,药效作用的发挥需要其活性成分进入体循环,由此到达作用靶位与受体发生作用,因此给药后哪些中药物质具有显著的系统暴露(在体循环血液中出现)是开展药代动力学研究首先要搞清楚的问题。图1所示为作者开展中药药代动力学研究的初始思路。中药含有众多成分,各成分不仅含量高低不同,而且其药代属性也会因结构和理化性质的不同而不同。给药后,由于在中药中的含量差异,以及在吸收、分布、代谢及排泄过程中受机体因素的影响,中药各成分的体内暴露会出现明显差异。通过对给药前后收集的血、尿样品进行分析,就能发现中药所含的许多成分因含量低或药代属性差,给药后的体内暴露不显著,这些成分即使有药效活性,可能也很难对中药药效产生贡献;另一些成分因含量高且药代属性较好或在体内可由其他成分转化而来,给药后在体内以原型化合物或代谢物形式暴露显著,其暴露水平可随中药给药剂量的增加而提高,这些中药成分是后续涉及中药药效和安全性的研究应优先关注的对象。如果在体内暴露显著的同时具有较强的药效活性,这样的中药成分就很有机会成为中药的药效物质基础。药代动力学研究发现的暴露显著的活性中药成分或其代谢物可作为中药的药代标识物(pharmacokinetic markers for Chinese herbal medicines)[9],用以反映给药后机体对中药的物质暴露,并在后续临床研究中与中药的药效和安全性相关联。
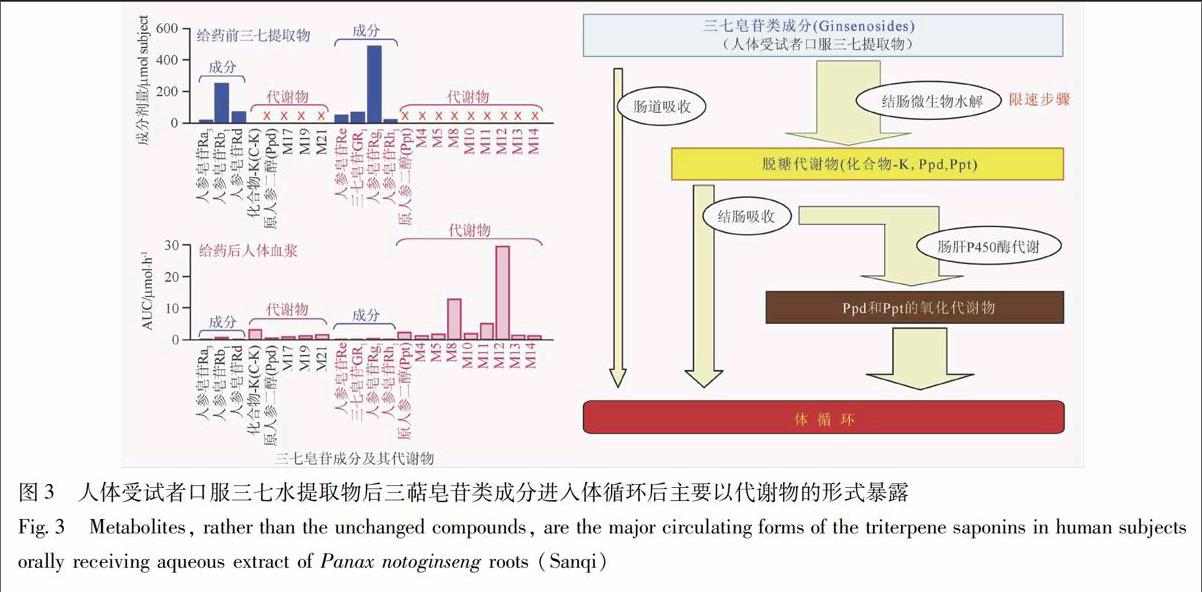
基于上述研究思路,作者及其研究团队在人体受试者和实验动物上开展了一批中药多成分药代动力学研究[9-18]。研究结果表明:不论是口服给药还是静脉注射给药,给药前的中药化学组成物质谱与给药后的中药体内暴露物质谱之间通常存在明显差异。这可总结为2个“不一定”,即:给药前在中药中含量高的成分给药后其体内暴露水平“不一定”仍然高;给药后一些体内暴露显著的中药物质(中药成分的代谢物)“不一定”是中药所含的成分。上述2个“不一定”突显药代动力学研究对于揭示中药药效物质基础的重要性。图2所示为人体受试者口服复方丹参滴丸后,在具有心血管药效活性的丹参多酚类主要成分中,丹参素的系统暴露水平明显高于其他成分的暴露水平,这是因为后者的肠道吸收差(丹酚酸A、丹酚酸B、丹酚酸D、迷迭香酸、紫草酸)或者体内代谢过快(原儿茶醛)[9]。在人体受试者上静脉注射丹红注射液后,丹参素、丹酚酸D及紫草酸的系统暴露水平明显高于其他丹参多酚类成分(原儿茶醛、丹酚酸B、迷迭香酸及丹酚酸A)的暴露水平(图2)[12]。静脉注射丹红注射液后丹参素的暴露水平高,主要是由于该成分在注射液中的含量高于其他成分的含量。然而,丹酚酸D和紫草酸在丹红注射液中的含量却低于上述其他丹参多酚类成分的含量,这以上成分的暴露水平较高是由于其清除半衰期比其他成分的长3~5倍,较长时间的体内循环抵消了这些成分含量相對较低对其体内暴露带来的不利影响。再有1个例子是关于口服给药后三七皂苷类成分的系统暴露。三萜皂苷类成分是三七所含的具有心血管药效活性的一类重要成分,主要有二醇型皂苷成分(如人参皂苷Rb1, Rd, Rc等)及三醇型皂苷成分(如人参皂苷Rg1, Re和三七皂苷R1等)。虽然2型皂苷成分化学结构相似,但在大鼠和人体受试者上开展的药代动力学研究表明:经成分剂量校正后,口服三七水提物后二醇型皂苷成分的系统暴露水平(AUC)仍显著高于三醇型皂苷成分的暴露水平[10,13]。这是由于二醇型皂苷成分与三醇型皂苷成分在肝胆排泄和肾排泄2个清除途径上存在显著差异[19]。在人体受试者上开展的研究还发现:口服给药后三七皂苷类成分以三类化学形式进入体内循环,包括:由肠道吸收的原型成分、在结肠微生物作用下水解脱糖形成的代谢物(化合物-K,二醇型苷元原人参二醇及三醇型苷元原人参三醇)、以及脱糖代谢物在宿主肠肝P450酶作用下生成的代谢物(图3)。比较三七皂苷类成分的上述三类物质形式在人体内的暴露水平可知,口服给药后三七皂苷类成分主要以代谢物的形式(而非原型成分的形式)在体内产生暴露,这些代谢物是研究口服给药后三七皂苷类成分的体内药效作用及其机制所应重点关注的物质对象。
2 中药多成分药代动力学研究方法及关键技术
中药化学组成复杂,一般含有众多具有药效活性的成分。针对中药的这一特点,开展中药多成分药代动力学
A.来自复方丹参在滴丸的丹参多酚类成分的成分剂量;B.口服给药复方丹参滴丸后丹参多酚成分的系统暴露水平;C.来自丹红注射液的丹参多酚类成分的成分剂量;D.静注给药丹红注射液后丹参多酚类成分的系统暴露水平。
研究,考察给药后中药成分能否被机体有效利用,其目的就是在中药化学研究与中药成分的药效活性研究之间搭建桥梁,为揭示中药的药效物质基础迈出关键一步。开展中药多成分药代动力学研究有2类基本方法[20]。研究方法之一被归纳为“药效→物质”方法,它是围绕一类具有药效活性的中药成分,在人体受试者和实验动物上开展研究,比较给药后不同成分的体内暴露,找出暴露显著的中药成分及其代谢物,并研究这些中药物质的药代动力学特征和体内变化过程,由此找出有可能影响中药药效或安全性的中药物质[9-10]。研究方法之二被归纳为“物质→药效”方法,它是从中药所含的能被现有分析技术检测到的所有成分出发,利用高载量和高通量技术考察不同成分的药代属性,根据给药后体内暴露情况找出能被机体有效利用的中药物质,为后续涉及中药药效和安全性的研究指明应优先关注的中药物质[14]。目前针对中成药品种所开展的多成分药代动力学研究正是基于上述2类基本研究方法的结合。
围绕某个中成药品种,在健康人体受试者上和大鼠等实验动物上开展的多成分药代动力学研究,应回答3个问题:①被研中成药品种的化学组成及质量一致性如何?回答该问题是开展药代动力学研究的第一步,这是因为中成药含有什么成分及其含量高低是决定给药后体内中药物质暴露的一个重要因素。另外,在人体受试者和实验动物上进行的药代动力学研究通常都只用某一生产批次的中成药开展工作,这就需要了解用该批次中成药获得的药代动力学研究结果是否能推广至该中成药的其他批次产品。②给药后被研中成药所含的哪些成分能产生显著的系统暴露?研究中成药所含成分能否被机体有效利用首先要看给药后这些成分在体循环血液中的出现情况,也就是成分的系统暴露。考察系统暴露,既要看成分的暴露水平(可用曲线下面积AUC及峰浓度Cmax等药动学参数来表达),也要看成分的暴露形式(原型成分或代谢物)。③给药后暴露显著的中药成分有怎样的药动学、吸收及体内变化过程特征?对该问题的回答就是围绕暴露显著的中药成分,进一步考察与被研中成药药效和安全性关联的这些成分的药代动力学特征。这些特征包括:中药成分的体内清除半衰期、中成药的给药剂量与成分暴露水平的关系(量-暴关系)、中药成分的吸收机制及影响因素、中药成分的体内到达性(能与何处的受体结合)和组织分布特征(重点是药效靶组织、毒副作用靶组织、关键清除组织和产生药代机制药物间相互作用靶组织等)、中药成分在体内的主要清除途径及相关分子作用机制等。
为了回答上述3个问题,中药多成分药代动力学研究可按照“一个基础、一个中心、两个协助、三个支撑”的工作模式来开展。“一个基础”是指:开展药代动力学研究时首先搞清楚被研中成药的化学组成(特别应关注已报道具有药效活性的成分在被研中成药中的存在情况)及其不同生产批次的质量一致性。“一个中心”是指:按照规定的临床剂量考察给药后被研中成药的成分在人体受试者上的系统暴露情况,找出暴露显著的中药成分(包括其暴露的水平和形式),特别应关注那些已报道具有药效活性的成分的系统暴露情况。“两个协助”是指:作为对上述人体受试者研究的补充,在大鼠等实验动物上开展被研中成药的药代动力学研究,并围绕在人体受试者上发现的主要暴露成分开展体外药代研究,以帮助全面了解体内暴露显著的中药成分的药代动力学特征,尤其是与药效作用或毒副作用关联的药代动力学特征。在了解种属差异的基础上,进一步开展动物药代动力学研究可帮助获得给药后的量-暴关系、吸收特征及影响因素、组织分布特征、在体内的主要清除途径及药代基质效应(中药成分的系统暴露和药动学特征受中成药中其他成分的影响)等信息。体外药代研究包括:体外代谢试验(帮助鉴定体内代谢物、比较代谢种属差异及鉴定起关键作用的人代谢酶等)、体外转运试验(研究被动扩散所涉及的膜通透性、鉴定介导主动转运的转运体并比较相关种属差异等)、血浆蛋白结合试验、全血-血浆分配比试验等。“三个支撑”是指:研究前的情报收集与分析、基于色谱-质谱技术的样品分析及研究数据分析。由于中药药代动力学研究涉及中药和机体2个复杂体系,因此研究前的情报收集与分析对于让实验研究能更快地抓住关键、减少盲目及提高效率十分重要。为了给实验研究提供更好的帮助,样品分析需要具备化合物高载量和样品高通量的性能特点。研究数据分析不仅包括药动学参数计算,还可利用生理药代动力学(PBPK)建模与预测来获取更多在人体上的中药成分药代动力学信息,此外采用正确的数理统计学方法也是产生准确信息的一个前提条件。
除上述研究方法外,开展中药多成分药代动力学研究还需发展与之相配套的關键技术。由于涉及中药和机体2个复杂体系,通常需要将不同类别的研究技术整合在一起,形成能适应多成分特点、具备某方面研究功能的技术群。支持中药药代动力学研究的技术群包括:中药情报收集与分析技术群、复杂生物样品微量中药物质分析技术群、中药体内代谢物制备和纯化技术群、药代动物实验技术群、中药化合物通过生物屏障研究技术群、中药化合物体内清除研究技术群、中药药代标识物发现鉴定技术群、中药药代研究数据分析技术群等。例如:应用低浓度电解质效应(low concentration electrolyte effects),通过提高电喷雾电离(ESI)源的离子化效率(ionization efficiency)和离子化容量(ionization capacity),来增强被测化合物的检测响应、降低复杂生物样品基质效应(matrix effects)干扰并提高定量检测上限,将其与脉冲梯度色谱洗脱技术相结合,可有效提高液相色谱-质谱联用技术用于分析复杂生物样品中微量中药物质的效能(图4)[21-26]。中药所含的一些药效活性成分因具有挥发性,一直难以准确灵敏地在生物样品中对其进行检测分析。冰片的单萜类成分龙脑、异龙脑及其代谢物樟脑正是这样的挥发性中药物质,应用气相色谱-质谱的“程序升温汽化”(programmable temperature vaporizing, PTV)进样技术结合“微萃取”样品前处理技术可解决这一分析难题,促进了冰片的药代动力学研究,该项技术可推广至分析其他挥发性中药物质[17]。图5所示的是将体内(in vivo;大鼠药代研究)、体外(in vitro;中药物质与药物代谢酶和转运体的相互作用)、计算机辅助(in silico;中药物质的理化性质)、分析等技术整合在一起,用于评价不同中药成分能否通过“肠肝屏障”和“血脑屏障”的技术群[27]。
3 研究实例:银杏酮酯及其制剂的多成分药代动力学研究
20世纪60年代德国人Willmar Schwabe博士开发了国际上首个标准化银杏叶提取物及其制剂[28]。我国是银杏叶资源大国,国家食品药品监督管理总局(CFDA)先后批准了100多个银杏叶提取物制剂品种上市。在防治心脑血管疾病的中药和植物药制剂中,银杏叶提取物制剂多年来一直在国内医院处方用量方面名列前茅。供血不足是许多心脑血管疾病的一个共同特点,银杏叶提取物的许多药效作用都与其改善血液循环和供血有关。因此,搞清楚给药后银杏叶提取物中的成分的系统暴露药代动力学特征十分重要。此外,研究还发现银杏叶提取物及其成分具有神经保护作用,然而银杏叶提取物的成分能否透过血脑屏障尚不清楚;近年来开展的临床研究也未得出一致的结论证明银杏叶提取物制剂有益于老年痴呆等神经退行性病变,这些临床研究的试验设计和数据解释均缺乏药代动力学的支持。银杏酮酯(GBE50)是上药集团上海杏灵科技药业采用具有自主知识产权的新技术生产的一种标准化银杏叶提取物,为了帮助企业提升该产品的科技内涵,作者研究团队开展了银杏酮酯及其制剂的多成分药代动力学研究[14-15]。该项研究重点回答两方面的问题,其一、口服给药后银杏酮酯的哪些成分能够从胃肠道吸收,进入体循环被机体显著利用?其二、给药后银杏黄酮醇和内酯两类成分在大鼠体内有怎样的系统暴露和脑暴露?不同给药途径(静脉注射和口服)对此有何影响?
药物通过“肠肝屏障”主要涉及肠道吸收和首过清除2个环节。影响口服药的肠道吸收的因素包括:药物分子的膜通透性、水溶性及肠上皮细胞转运体的外排作用等。首过清除涉及:药物分子在肠上皮细胞中的代谢、在肝细胞中的代谢、随胆汁排泄等。为了研究肠肝屏障各环节对银杏酮酯成分的影响及口服给药后银杏酮酯成分的系统暴露情况,首先应用液相色谱-质谱联用技术对银杏酮酯的成分谱进行系统分析。在此基础上,采用体外Caco-2细胞单层模型及计算机建模和预测技术,研究银杏叶化合物的膜通透性、水溶性以及肠上皮细胞外排转运体的影响,根据可吸收银杏叶化合物的化学结构预测其可能发生的首过代谢反应,并结合体外代谢试验研究其在人体和大鼠肠、肝中的代谢,通过灌胃给药在大鼠上考察银杏酮酯成分的系统暴露,并考察原型化合物及其主要代谢物随大鼠胆汁排泄的情况等。在银杏酮酯中共检测出72种银杏叶成分(图6),这些成分主要归为:内酯、黄酮(包括黄酮醇、黄酮、异黄酮、双黄酮和黄烷醇等)和羧酸三大类;不同成分在银杏酮酯中的含量相差较大(0.01~55.3 mg·g-1)。虽然膜通透性差影响了黄酮醇苷类成分的肠道吸收,但灌胃给药后大鼠血中仍可检测到多个银杏酮酯的黄酮醇苷类成分;黄酮醇苷成分可在结肠中微生物作用下水解生成易于吸收的苷元化合物,吸收后的黄酮醇苷元化合物迅速被代谢,所生成的Ⅱ相葡萄糖醛酸结合物和硫酸酯结合物等可在大鼠血中检测到。另外,经肠道吸收的槲皮素苷化合物(属黄酮醇苷类成分)和槲皮素的葡萄糖醛酸结合物由于具有儿茶酚结构,可被甲基化生成相应的异鼠李素苷化合物(属黄酮醇苷类化合物)和葡萄糖醛酸结合物。内酯类成分具有中等膜通透性,虽然体外实验提示银杏内酯A和银杏内酯B是肠上皮细胞外排转运体P-gp和MRP2的底物,但膜通透性似乎是影响这类银杏叶成分肠道吸收的关键因素。较差的膜通透性和水溶性限制了银杏酮酯的双黄酮类成分在肠道的吸收;银杏酮酯的其他类成分由于含量低,因此在给药后难以在大鼠血中检测到。总之,灌胃给药后体内暴露较显著的银杏酮酯物质为黄酮醇的代谢物和内酯类成分,这2类银杏叶物质有不少药效活性的报道,因此值得在后续研究中重点关注。
针对银杏叶提取物改善供血和保护神经细胞的药效作用,进一步的药代动力学研究工作着力于考察给药后银杏黄酮醇及内酯2类活性成分的系统暴露和脑暴露情况,并比较口服(银杏酮酯)和静脉注射(舒血宁注射液)2种途径给药所带来的差异。这部分研究工作在大鼠上开展,利用微透析技术采集大脑细胞间液以考察化合物透过血脑屏障的情况,试验获得的生物样品用液相色谱-质谱联用技术进行分析。研究发现:给药后在大鼠体内黄酮醇类和内酯类成分表现出不同的清除动力学特征,其中黄酮醇类成分(代谢物是其重要的暴露形式之一)的半衰期較长(11.6~30.2 h)、内酯类成分的较短(0.3~0.9 h);由此影响两类银杏叶成分的系统暴露水平。上述清除动力学特征的差异是由于在大鼠体内黄酮醇类成分能进行肠肝循环,而内酯类成分因较快的肾排泄难以进行肠肝循环(图7)。给药大鼠(按三倍临床剂量折算出大鼠的给药剂量)后黄酮醇苷成分及代谢物难以透过血脑屏障;内酯类成分的脑暴露水平也较低(图8),这比报道的银杏叶内酯类化合物展现体外神经保护作用所需的浓度低2~3个数量级[29-32];很低的脑暴露水平似乎难以支持这些银杏叶成分在体内产生对神经元细胞的直接保护作用。口服和静脉注射2种途径给药后,银杏叶成分的系统暴露相差很大。口服给药后,黄酮醇苷原型成分难以通过肠肝屏障进入体循环,水解脱糖后经Ⅱ相结合反应生成的代谢物是这类银杏叶成分在进入体循环后的主要暴露形式;通过静脉注射给药可让黄酮醇苷原型成分在体循环中产生显著暴露。银杏叶内酯类成分的暴露差异主要取决于它们在两种制剂中的含量高低。银杏内酯C在口服给药时是例外,因其较差的肠道吸收限制了系统暴露水平。白果内酯在注射剂中的含量很低,静脉注射给药后该成分在血中难以被检测。了解两类银杏叶活性成分的体内暴露,有利于更精准地研究这些成分的药效作用,并对“选对成分、用好成分”以提高银杏叶提取物制剂的临床疗效具有积极的意义。上述研究是对银杏叶提取物给药后体内物质暴露认识的突破,基本打通了相关技术路线;后续研究将重点在人体受试者上开展银杏酮酯制剂的多成分药代动力学研究,检测给药后银杏酮酯体内暴露物质的心脑血管药效活性,考察银杏酮酯制剂与化药合用时出现药代机制不良相互作用的风险等,这些研究将为优化银杏酮酯制剂的临床用药和提高临床疗效提供科学依据。
4 中药药代标识物(pharmacokinetic markers of Chinese herbal medicines)
中药药代动力学研究涉及中药和机体2个复杂系统,
为了促进中药药代动力学基础研究成果向临床应用转化,作者等提出了“中药药代标识物”概念。中药药代标识物是指用给药后体内出现的并可被现有分析技術检测的中药物质(原型成分或代谢物),来反映或预测与中药药效或安全性关联的中药体内物质暴露、影响暴露的因素及与暴露相关的其他因素。首个中药药代标识物是作者及其研究团队在围绕复方丹参滴丸开展丹参多酚类活性成分药代动力学研究时发现的[9]。研究发现丹参素具有较好的肠道吸收和适中的体内清除,丹参素是口服复方丹参滴丸后唯一系统暴露水平(以原型成分形式)显著的丹参多酚类成分,其暴露水平随复方丹参滴丸剂量的增加而增加并呈线性量暴关系,因此血中测到的丹参素可作为一个药代标识物,用来反映给药后机体对复方丹参滴丸的丹参多酚类成分的暴露。
三萜皂苷类成分是三七的一类药效活性成分(主要包括二醇型皂苷成分和三醇型皂苷成分),人体口服三七水提物后皂苷类成分会发生组合代谢(combinatorial metabolism),即在结肠中微生物和宿主肠肝P450酶作用下先水解脱糖再氧化;最后生成的代谢物的系统暴露水平显著高于从肠道吸收的原型成分的暴露水平。然而,上述代谢物的暴露水平在个体间差异很大、且呈现不随三七提取物剂量增加而增加的量暴关系。在此,作者及其研究团队发现三七皂苷类成分肠道吸收前水解脱糖生成的代谢物(原人参二醇和原人参三醇)可在人血中测到并作为药代标识物;分别用来反映给药后二醇型和三醇型皂苷成分的上述组合代谢最终产物在暴露水平上的个体间差异及其浓度随时间的变化[13]。这是第二种类型的中药药代标识物,可用于反映剂量非依赖型体内中药物质的暴露特征。在上述组合代谢中结肠微生物介导的水解脱糖是整个代谢过程的限速步骤,人体结肠中微生物的酶水解活性强弱决定了上述组合代谢最终产物暴露水平的高低。作者研究团队还发现人血中测到的原人参二醇和原人参三醇可用来反映不同个体间结肠中微生物酶水解活性的差异;这是第三种类型的中药药代标识物,可用于反映中药物质体内暴露的影响因素。在开展中药注射剂多成分药代动力学研究时,作者及其研究团队提出中药成分的剂量(由中药成分在注射液中的含量与中药注射剂的日给药剂量相乘获得)与其半衰期结合可作为药代标识物,用来预测静注给药后中药注射液成分系统暴露水平的高低[12]。随着中药药代动力学研究的不断扩展和深入,更多的中药药代标识物将被发现和应用,新的药代标识物可能被用来反映或预测与中药体内物质暴露相关的中药有效性、安全性及患者病情因中药治疗带来的变化等,帮助选择最适合中药治疗的患者等。
5 中药多成分药代动力学研究的展望
通过多年的探索与努力,中药多成分药代动力学研究已在方法与技术上取得了突破,这类研究正逐步围绕更多的中成药品种而开展,并在中成药品种科技提升中发挥作用。在此基础上,进一步开展方法学研究,让中药多成分药代动力学研究从“探索”走向“规范化”,将有利于这类研究工作的推广。另一方面,围绕中成药品种开展多成分药代动力学研究,后续可进一步从以下几个方面开展工作。
5.1 揭示中药的药效物质基础 开展多成分药代动力学研究,全面考察给药后中药的体内物质暴露,找出那些能被机体显著利用的中药物质,为揭示中药的药效物质基础迈出关键一步。后续研究工作可从三个方面来进行:检测中药体内暴露物质(原型成分及代谢物)与中药疗效相关的生物活性(药效活性)、研究如何将这些中药物质的药效活性转化为中药的整体疗效、研究中药多种物质在药效作用协同或叠加的同时能否“药代和谐”(pharmacokinetic compatability)。所谓药代和谐是指:药物一同使用时不会发生影响药物有效性或安全性的药代机制药物间相互作用(pharmacokinetic drug-drug interactions)。
5.2 研究中药与化药合用引发药代机制相互作用的风险 中药在临床上大量使用,其原因之一就是在药效作用上与化药形成互补,且长期用药较为安全。中药和化药成功地联合使用不仅取决于这类药效作用的协同或叠加,也取决于中药和化药之间能否药代和谐。开展中药制剂与化药合用引起药代机制相互作用的风险研究,不仅需要全面认识给药后中药在人体内的物质暴露,而且也要了解能影响中药药效活性成分体内暴露的关键清除途径及相关分子机制。在此基础上,结合中药的临床用药情况,从中药药效活性成分体内暴露水平被化药改变(中药物质作为substrate victims)、以及体内暴露显著的中药物质改变化药的暴露水平(中药物质作为perpetrators)两个角度开展研究[33-34]。
5.3 开展患者和特殊人群的中药多成分药代动力学研究 给药后药物的体内暴露是决定其药效和用药安全的一个重要因素。大量研究表明患者的病理生理状况及其接受的其他治疗可使药物在患者体内的暴露及药代动力学特征与在正常人体内的情况相比出现明显差异,这些差异主要归因于脏器组织的血液灌注、毛细血管的通透性、肝脏等脏器组织中多种蛋白的合成、肝肾功能等出现了改变。近年来,多种疾病中涉及的炎症反应和免疫反应等改变药物代谢酶、转运体及血浆蛋白的表达量和活性也引起人们的高度重视,这些都可造成药物的体内药代动力学特征的显著变化[35,37]。因此,在正常人体受试者上开展研究后,应进一步在患者上开展中药药代动力学研究,这不仅有利于中药临床合理用药、发现易从中药治疗获益的患者,而且还可为开展考察中药有效性和安全性的临床试验提供支持。
5.4 开展中药的制剂工艺考察,促进中药质量一致性提升
在开展中药多成分药代动力学研究时,需要建立检测功能强大的中药物质分析方法,这些分析方法除了用于中药的多成分药代动力学研究外,还可用于分析制剂生产工艺各环节对中成药产品最终质量的影响,并用于找出工艺流程中影响不同生产批次中成药质量一致性的关键环节和因素。这项研究工作对于阐明和保证中成药质量的一致性具有重要的意义。
[參考文献]
[1] 张伯礼, 陈传红主编. 中药现代化20年(1996-2015)[M]. 上海:上海科技出版社,2016.
[2] Wang C, Cao B, Liu Q-Q, et al. Oseltamivir compared with the Chinese traditional therapy Maxingshigan-Yinqiaosan in the treatment of H1N1 influenza, a randomized trial [J]. Ann Intern Med, 2011, 155(4): 217.
[3] Li X-L, Zhang J, Huang J, et al. A multicenter, randomized, double-blind, parallel-group, placebo-controlled study of the effects of Qili Qiangxin capsules in patients with chronic heart failure [J]. J Am Coll Cardiol, 2013, 62(12): 1065.
[4] Tang W H W, Huang Y-M. Editorial comment: cardiotonic modulation in heart failure: insights from traditional Chinese medicine [J]. J Am Coll Cardiol, 2013, 62(12): 1073.
[5] Shang H-C, Zhang J-H, Yao C, et al. Qi-Shen-Yi-Qi dripping pills for the secondary prevention of myocardial infarction: a randomized clinical trial [J]. Evid Based Complement Alternat Med, 2013, 2013: e738391.
[6] Zhang L, Xing C-Y, Zhao J-Y, et al. Efficacy and safety of Abeimoschus manihot for primary glomerular disease: a prospective, multicenter randomized controlled clinical trial [J]. Am J Kidney Dis, 2014, 64(1): 57.
[7] Xu Z-G. Modernization: one step at a time [J]. Nature, 2011, 480(7378): S90.
[8] Stafford L. Chinese herbal medicine clears US FDA phase II trials [J]. HerbalGram, 2010, 88(10): 58.
[9] Lu T, Yang J-L, Gao X-M, et al. Plasma and urinary tanshinol from Salvia miltiorrhiza (Danshen), can be used as pharmacokinetic markers for cardiotonic pills, a cardiovascular herbal medicine [J]. Drug Metab Dispos, 2008, 36(8): 1578.
[10] Liu H-F, Yang J-L, Du F-F, et al. Absorption and disposition of ginsenosides after oral administration of Panax notoginseng extract to rats [J]. Drug Metab Dispos, 2009, 37(12): 2290.
[11] Cheng C, Du F-F, Yu K, et al. Pharmacokinetics and disposition of circulating iridoids and organic acids after intravenous administration of ReDuNing injection in rats [J]. Drug Metab Dispos, 2016, 44(11): 1853.
[12] Li M-J, Wang F-Q, Huang Y-H, et al. Systemic exposure to and disposition of catechols, derived from Salvia miltiorrhiza roots (Danshen), after intravenous dosing DanHong injection in human subjects, rats, and dogs [J]. Drug Metab Dispos, 2015, 43(5): 679.
[13] Hu Z-Y, Yang J-L, Cheng C, et al. Combinatorial metabolism notably affects human systemic exposure to ginsenosides from orally administered extract of Panax notoginseng roots (Sanqi) [J]. Drug Metab Dispos, 2013, 41(7): 1457.
[14] Li L, Zhao Y-S, Du F-F, et al. Intestinal absorption and presystemic elimination of various chemical constituents present in GBE50 extract, a standardized extract of Ginkgo biloba leaves [J]. Curr Drug Metab, 2012, 13(5): 494.
[15] Chen F, Li L, Xu F, et al. Systemic and cerebral exposure to and pharmacokinetics of flavonols and terpene lactones after dosing standardized Ginkgo biloba leaf extracts to rats via different administration routes [J]. Br J Pharmacol, 2013, 170(2): 440.
[16] Cheng C, Liu X-W, Du F-F, et al. Sensitive assay for measurement of volatile borneol, isoborneol, and the metabolite camphor in rat pharmacokinetic study of Borneolum (Bingpian) and Borneolum syntheticum (synthetic Bingpian) [J]. Acta Pharmacol Sin, 2013, 34(10): 1337.
[17] Cheng C, Lin J-Z, Li L, et al. Pharmacokinetics and disposition of monoterpene glycosides, derived from Paeonia lactiflora roots (Chishao), after intravenous dosing of antiseptic XueBiJing injection in human subjects and rats [J]. Acta Pharmacol Sin, 2016, 37(4): 530.
[18] Li X-X, Cheng C, Wang F-Q, et al. Pharmacokinetics of catechols in human subjects intravenously receiving XueBiJing injection, an emerging antiseptic herbal medicine [J]. Drug Metab Pharmacokinet, 2016, 31(1): 95.
[19] Jiang R-R, Dong J-J, Li X-X, et al. Molecular mechanisms governing different pharmacokinetics of ginsenosides and potential for ginsenoside-perpetrated herb-drug interactions on OATP1B3 [J]. Br J Pharmacol, 2015, 172(4): 1059.
[20] Li C. Editorial: absorption, disposition, and pharmacokinetics of herbal medicines: what and how? [J]. Curr Drug Metab, 2012, 13(5): 491.
[21] Li L, Liang S-P, Du F-F, et al. Simultaneous quantification of multiple licorice flavonoids in rat plasma [J]. J Am Soc Mass Spectrom, 2007, 18(6): 778.
[22] Zhao Y, Wang L, Bao Y-W, et al. A sensitive method for the detection and quantification of ginkgo flavonols from plasma [J]. Rapid Commun Mass Spectrom, 2007, 21(6): 971.
[23] Wang L, Sun Y, Du F-F, et al. ′LC-electrolyte effects′ improve the bioanalytical performance of liquid chromatography/tandem mass spectrometric assays in supporting drug discovery pharmacokinetic study [J]. Rapid Commun Mass Spectrom, 2007, 21(16): 2573 .
[24] Zhao Y, Sun Y, Li C. Simultaneous determination of ginkgo flavonoids and terpenoids in plasma: ammonium formate in LC mobile phase enhancing electrospray ionization efficiency and capacity [J]. J Am Soc Mass Spectrom, 2008, 19(3): 445.
[25] Li Y-F, Sun Y, Du F-F, et al. Pulse gradient, large-volume injection, high-throughput ultra-performance liquid chromatographic/tandem mass spectrometry bioanalysis for measurement of plasma amrubicin and its metabolite amrubicinol [J]. J Chromatogr A, 2008, 1193(1/2): 109 .
[26] Niu W, Zhu X-H, Li L, et al. Nebulizing conditions of pneumatic electrospray ionization significantly influence electrolyte effects on compound measurement [J]. J Mass Spectrom, 2012, 47(3): 370.
[27] Sun Y, Dai J-Y, Hu Z-Y, et al. Oral bioavailability and brain penetration of (-)-stepholidine, a tetrahydroprotoberberine agonist at dopamine D1 and antagonist at D2 receptors, in rats [J]. Br J Pharmacol, 2009, 158(5): 1302.
[28] Defeudis F V. A brief history of EGb 761 and its therapeutic uses [J]. Pharmcopsychiatry, 2003, 36(Suppl 1): S2 .
[29] Luo Y, Smith J V, Paramasivam V, et al. Inhibition of amyoid-β aggregation and caspase-3 activation by the Ginkgo biloba extract EGb761 [J]. Proc Natl Acad Sci USA, 2002, 99(19): 12197.
[30] Ivic L, Sands T T, Fishkin N, et al. Terpene Trilactones from Ginkgo biloba are antagonists of cortical glycine and GABAA receptors [J]. J Bio Chem, 2003, 278(49): 49279.
[31] Tchantchou F, Lacor P N, Cao Z, et al. Stimulation of neurogenesis and synaptogenesis by bilobalide and quercetin via common final pathway in hippocampal neurons [J]. J Alzheimers Dis, 2009, 18(4):787.
[32] Shi C, Wu F, Yew D-T, et al. Bilobalide prevents apoptosis through activation of the PI3K/Akt pathway in SH-SY5Y cells [J]. Apoptosis, 2010, 15(6): 715 .
[33] Jia W-W, Du F-F, Liu X-W, et al. Renal tubular secretion of tanshinol: molecular mechanisms, impact on its systemic exposure, and propensity for dose-related nephrotoxicity and for renal herb-drug interactions [J]. Drug Metab Dispos, 2015, 43(5): 669.
[34] Tian D-D, Jia W-W, Liu X-W, et al. Methylation and its role in disposition of tanshinol, a cardiovascular carboxylic catechol from Salvia miltiorrhiza roots (Danshen) [J]. Acta Pharmacol Sin, 2015, 36(5): 627.
[35] Morgan E T, Goralski K B, Piquette-Miller M, et al. Regulation of drug-metabolizing enzymes and transporters in infection, inflammation, and cancer [J]. Drug Metab Dispos, 2008, 36(2):205.
[36] Morgan E T. Impact of infectious and inflammatory disease on cytochrome P450-mediated drug metabolism and pharmacokinetics [J]. Clin Pharmacol Ther, 2009, 85(4): 434.
[37] Harvey R D, Morgan E T. Cancer, inflammation, and therapy: effects on cytochrome P450-mediated drug metabolism and implications for novel immunotherapeutic agents [J]. Clin Pharmacol Ther, 2014, 96(4): 449.
