2型糖尿病周围神经病变的危险因素及相关炎性反应因子分析
2017-03-27侍晓云
郭 杨,宋 晓,侍晓云,王 莉
2型糖尿病周围神经病变的危险因素及相关炎性反应因子分析
郭 杨,宋 晓,侍晓云,王 莉
目的 分析2型糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)的患病情况,并研究其相关危险因素及炎性因子。方法 选择2015-01至2016-07临床确诊为2型糖尿病的住院患者,根据DPN诊断标准分为糖尿病周围神经病变组(n=224)及糖尿病非周围神经病变组(n=116),分别检查两组是否合并糖尿病视网膜病变(diabetic retinopathy,DR)、是否合并糖尿病外周血管病变(diabetic peripheral vascular,DPV),并分析年龄、体重、身体质量指数(BMI)、病程、生化指标炎性反应因子与DPN的相关性。对每个指标进行单因素分析,然后进行非条件多因素Logistic分析。结果 (1)糖尿病周围神经病变组(n=224),糖尿病非周围神经病变组(n=116),糖尿病周围神经病变患病率为65.9%;(2)糖尿病周围神经病变组中合并外周血管病变的患者比例(69%)明显高于糖尿病非周围神经病变组(50%),经χ2检验,差异有统计学意义(χ2=5.723,P<0.05);(3)在所分析的各项因素中,糖尿病周围神经病变组的病程、HbA1c、LDL-C、IL-6、TNF-α、SIL-2R与糖尿病非周围神经病变组的比较,差异有统计学意义(tw 2.084~3.407,P<0.05),其余因素比较差异无统计学意义。(4)Logistic多因素分析:病程、HbA1c、LDL-C、TNF-α、SIL-2R,以及是否合并外周血管病变均是DPN的独立危险因素(OR:0.455~1.655,P<0.05)。结论 随着病程的延长,外周血管的病变,血糖、血脂的升高,以及相关炎性因子的异常,都会使糖尿病神经病变的病情加重。
2型糖尿病;糖尿病周围神经病变;危险因素;炎性反应因子
糖尿病周围神经病变是指在排除其他原因的情况下,糖尿病患者出现与周围神经功能障碍相关的症状和(或)体征。糖尿病对神经系统的损伤是全身弥漫性的,其病理几乎均表现为脱髓鞘、轴索变性及末梢神经炎[1]。糖尿病周围神经病变具有起病缓慢、隐匿性强、症状逐渐加重、不易逆转的特点,伴随着神经病变的发生,临床上无痛性心肌梗死、猝死和糖尿病足的风险增加,患者的生活质量开始逐步下降,包括痛觉过敏、麻木、肌肉萎缩及脑卒中等。近期研究表明,炎性反应在糖尿病神经病变的发生发展中起关键性作用。本研究探讨了周围神经病变的危险因素及其相关炎性反应因子,为临床有效预防、控制、延缓糖尿病周围神经病变提供理论依据。
1 对象与方法
1.1 对象 选择2015-01至2016-07我院内分泌科确诊的2型糖尿病患者340例,其中男178例,女162例,年龄30~87岁,平均58.16岁,平均病程11.0年。
1.2 仪器 神经-肌电图仪:美国,Bio-Thesiometer;全自动生化分析仪:东芝,TBA-120FR;全自动糖化血红蛋白分析仪:TOSOH,HLC-723G8;化学发光免疫分析仪:罗氏,Cobas E601。
1.3 方法 (1)调查患者的年龄及糖尿病病程。(2)入院时测量患者身高、体重,计算BMI。(3)住院期间由专业医师进行神经-肌电图检查及查体。DPN的诊断标准:①神经传导速度有2项或2项以上减慢;②振动觉异常;③温度觉异常;④踝反射消失;⑤足部感觉减退(取足部触觉,采用10gS-W尼龙单丝8分法),排除其他骨科和神经科疾病。一般认为以上5项检查中如果有2项或2项以上异常则可诊断为神经病变[2]。按DPN诊断标准将研究人群分为糖尿病周围神经病变组及糖尿病非神经病变组。(4)血样采集:采集所有患者的外周血,采用全自动糖化血红蛋白分析仪分析HbA1c,全自动生化分析仪测定FBG、TG、TC、HDL-C、LDL-C、Urea、Cr、UA,并用化学发光免疫分析仪测定患者外周血中的IL-6、IL-8、IL-10、IL-1β、SIL-2R、TNF-α、CRP。(5)糖尿病并发症:住院期间由专科医师对所有研究人群行眼底检查、眼底荧光素血管造影术及外周血管超声,并明确是否合并糖尿病视网膜病变及外周血管病变。
2 结 果
2.1 分组及各组患者合并症情况 340例2型糖尿病患者,按DPN诊断标准分为糖尿病周围神经病变组224例,糖尿病非神经病变组116例,发病率65.9%。两组外周血管患病构成比P<0.05,差异有统计学意义。性别及是否合并DR差异无统计学意义(表1)。
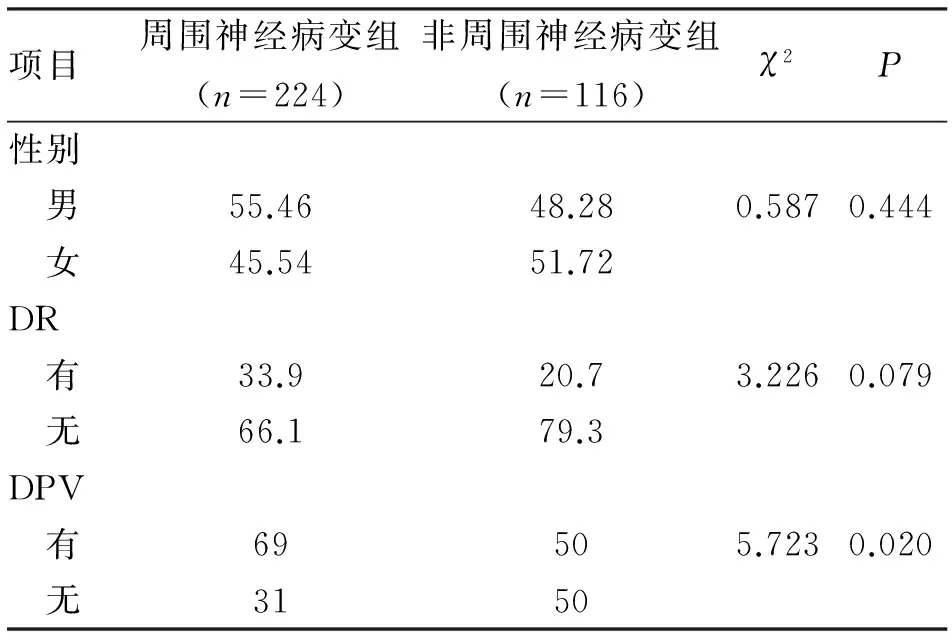
表1 两组2型糖尿病患者合并症情况 (%)
注:DR为糖尿病视网膜病变;DPV为糖尿病外周血管病变
2.2 一般资料比较 糖尿病神经病变组的年龄、体重、BMI、病程均高于糖尿病非神经病变组,其中两组年龄、体重、BMI差异无统计学意义(P>0.05),两组病程差异有统计学意义(P<0.05,表2)。
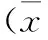
表2 两组2型糖尿病患者一般资料比较 ±s)
注:BMI为身体质量指数
2.3 血样标本比较
2.3.1 相关生化指标的比较 糖尿病神经病变组的FBG、TG、Urea、Cr、UA、HbA1c、LDL-C均高于糖尿病非神经病变组,而TC、HDL-C低于糖尿病非神经病变组,其中HbA1c、LDL-C两组差异有统计学意义(P<0.05),其余因素差异无统计学意义(P>0.05,表3)。
2.3.2 相关炎性因子的比较 糖尿病神经病变组的IL-8、IL-10、IL-1β、SIL-2R、TNF-α、CRP均高于糖尿病非神经病变组,而IL-6低于糖尿病非神经病变组,其中IL-6、SIL-2R、TNF-α两组差异有统计学意义(P<0.05),余炎性因子差异无统计学意义(P>0.05,表4)。
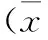
表3 两组2型糖尿病患者血样标本的比较 ±s)
注: HbA1c 糖化血红蛋白;FBG 空腹血糖;TG三酰甘油;TC 总胆固醇;HDL-C 高密度脂蛋白胆固醇;LDL-C 低密度脂蛋白胆固醇;Urea 尿素氮;Cr 肌酐;UA 尿酸
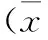
表4 两组2型糖尿病患者炎性反应因子标本的比较 ±s)
注: IL-6 白介素-6;IL-8 白介素-8;IL-10 白介素-10;IL-1β 白介素-1β;SIL-2R 可溶白介素-2受体;TNF-α 肿瘤坏死因子-α;CRP C反应蛋白
2.4 DPN危险因素的多因素logistics回归分析 对糖尿病病程、LDL-C、IL-6、SIL-2R、TNF-α以及是否合并外周血管病变进行logistics回归分析结果发现,糖尿病病程、HbA1c、LDL-C、SIL-2R、TNF-α及是否合并外周血管病变是DPN的独立危险因素(表5)。
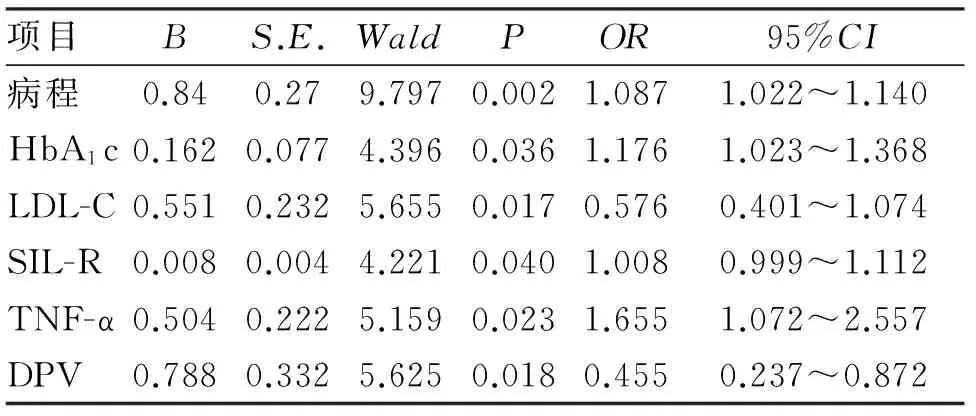
表5 DPN危险因素的logistics回归分析
注:HbA1c 糖化血红蛋白;LDL-C 低密度脂蛋白胆固醇;IL-6 白介素-6;TNF-α 肿瘤坏死因子-α;DPV 糖尿病外周血管病变
3 讨 论
DPN是糖尿病的常见并发症,在糖尿病总人群中占40%~60%[3],略低于本研究人群的发病率65.9%,考虑与住院患者的病情程度有关。在本研究中糖尿病神经病变组的病程高于糖尿病非神经病变组的病程,且差异有统计学意义(P<0.05),经过logistics回归分析病程是DPN的独立危险因素。说明糖尿病患者病程越长,DPN的发病率就越高,这与表皮内神经纤维的减少有关。
本研究显示,糖化血红蛋白两组差异有统计学意义(P<0.05),经过logistics回归分析糖化血红蛋白是DPN的独立危险因素。糖化血红蛋白对DPN的影响主要由于高血糖能够激活多元醇通路,导致非酶蛋白糖基化,使糖基化终末产物堆积,造成活性氧自由基对神经元DNA和神经蛋白的直接损伤。糖尿病周围神经病变组中外周血管病变患病率高于糖尿病非神经病变组的外周血管病变患病率,糖尿病引起一系列代谢物质的紊乱,多种代谢产物及细胞因子长时间作用于血管内皮细胞,使蛋白质复合体过度磷酸化,造成血管内皮这种屏障作用减弱或功能缺失。糖尿病患者组织的血液供应可因血管内皮细胞受损,出现超灌注和血液供应不足,从而使正常的血管扩张,对末梢血管及神经的机械保护作用消失[4]。糖尿病周围神经病变组LDL-C高于糖尿病非神经病变组LDL-C,差异有统计学意义(P<0.05),且是DPN的独立危险因素。血脂的异常造成血黏稠度增加、血小板功能异常,在血管内皮受损的情况下易造成微血栓的形成,进而导致官腔狭窄,造成神经组织低灌注,神经纤维退行性变及脱髓鞘病变。LDL在人体内的生物氧化作用下成生氧化型低密度脂蛋白胆固醇(ox-LDL),而ox-LDL升高易造成周围神经的损伤[5]。有研究表明,糖尿病周围神经病变组小鼠较正常小鼠,血浆中ox-LDL水平明显增高,并且研究者通过体外实验发现ox-LDL可引起氧化应激并与凝集素样氧化型低密度脂蛋白受体1(LDX-1)结合,激活相关的烟酰腺嘌呤二核苷酸磷酸氧化酶,损伤背根神经中枢的感觉神经元[5]。在临床治疗糖尿病患者的过程中,他汀药物在降低高血脂的同时也有可能有助于周围神经病变的治疗[6-8]。
本研究中糖尿病神经病变组炎性反应相关因子TNF-α、SIL-2R明显高于糖尿病非神经病变组,差异有统计学意义(P<0.05),经logistics回归分析均是DPN的独立危险因素。研究表明,高血糖可以激活NF-κB通路,进而激活炎性反应因子损伤周围神经[9]。NF-κB诱导激酶使游离的NF-κB转位到胞核,启动细胞因子,包括IL-6、TNF-α。TNF-α对少突胶质细胞有脱髓鞘和毒性作用,并且其能够抑制血管活性细胞的NO合酶,降低NO诱导的血管扩张。此外,TNF-α还能够促进一些生长因子和细胞黏附因子,最终导致血管细窄,血流动力学异常,造成神经组织低灌注损伤[10]。SIL-2R是一种重要的免疫抑制因子,可中和活化T细胞周围的白细胞介素-2(IL-2)、减弱机体的内分泌效应,抑制已活化的T细胞的克隆化扩增, 在免疫防御、免疫监视及自身稳定中发挥重要作用[11]。糖尿病神经经病变组SIL-2升高,说明表示患者体内淋巴细胞活化, 可能是SIL-2R 部分结合到β细胞膜上, 增强β细胞对IL-2 的反应, 从而产生更多的异常抗体[12]。SIL-2R增多的原因可能是丝裂原抗原使IL-2R在表达的同时形成SIL-2R也增多,并且IL-2本身也能使靶细胞释放更多的SIL-2R, 而使IL-2R数目相对减少,以促使活化状态细胞恢复至静息状态,从而使免疫反应程度得到一定的调控。增多的SIL-2R可与免疫细胞表面IL-2受体竞争结合IL-2,从而降低机体中依赖IL-2的多种免疫功能[11]。但是要证明上述猜想,还需进一步进行IL-2的测定。总之,DPN患者体内存在细胞因子的免疫调节紊乱,SIL-2R可初步反应患者体内的免疫动态,对DPN病因的解释及疾病的发展程度均有一定的帮助。
在本实验中糖尿病神经病变组IL-6低于糖尿病非神经病变组,且差异有统计学意义(P<0.05)。IL-6来源广泛,作为炎性反应的主要调节介质,参与血管的炎性反应和免疫应答。然而动物实验证实,IL-6对神经有保护作用,IL-6保护皮质和中脑的神经元及感觉神经元的存活;缺乏IL-6的鼠感觉功能受损,在损伤的感觉轴突中表现出再合成的延迟,而过表达IL-6的转基因鼠轴突再合成速度加快[13]。IL-6与TNF-α之间相互影响,TNF-α能刺激单核细胞和内皮细胞分泌IL-6并放大炎性作用,而IL-6能够抑制TNF-α的产生,降低TNF-α对神经的毒性作用[13]。但IL-6同时能诱导B细胞分化并产生免疫球蛋白,是细胞毒性T淋巴细胞的终末辅助因子,还能诱导纤维蛋白原启动的凝血因子,使血管炎性反应部位纤维母细胞增生、胶原沉积[14]。那么,在糖尿病神经病变中,IL-6对神经的两方面作用,哪一种更为明显还需要更多的临床证据充实。
[1] 王国民,徐 宁,尹 冬,等.糖尿病周围神经病变的诊断和治疗新进展[J].中国全科医学,2012,15(5):1661-1663.
[2] 马学毅.糖尿病神经病变的诊断与治疗[J].中国糖尿病杂志,2002,10( 5):300-302.
[3] Xu Y,Wang L,He J.Prevalence and control of diabetes in Chineseadults[J].JAMA,2013,310(9):948-959.
[4] 朱 东,鲁丽利,张剑丰,等.糖尿病患者免疫功能改变与预防肺部感染的临床研究[J].中华医院感染学杂志,2015,25(8):1790-1792.
[5] Vincent A M, Hayes J M, McLean L L,etal. Dyslipidemia-induced neuropathy in mice: the role of oxLDL/LOX-1[J].Diabetes,2009,58(10):2376-2385.
[6] Coulson W F. Statin neuropathy[J].Fam Pract,2011,60(4):182-184.
[7] Chong P H, Boskovich A, Stevkovic N. Statin-associated peripheral neuropathy: review of the literature[J].Pharmacotherapy,2004,24(9):1194-1203.
[8] Gaist D, Jeppesen U, Andersen M,etal.Statins and risk of polyneuropathy: a case-control study[J].Neurology,2002,58(9):1333-1337.
[9] Singh R, Kishore L, Kaur N. Diabetic peripheral neuropathy: current perspective and future directions[J].Phar Res,2014,80(2):21-35.
[10] Fromont A, De Seze J, Fleury M C,etal. Inflammatory demyelinating events following treatment with anti-tumor necrosis factor[J].Cytokine,2009,45(2):55-57.
[11] Barak V, Selmi C, Schlesinger M,etal. Serum inflammatory cytokines, complement components, and soluble interleukin 2 receptor in primary biliary cirrhosis[J].Autoimmun,2009,33(3-4):178-182.
[12] Garcia Ruiz P, Canora L, ebrato J,etal. Soluble interleukin-2 and tumor necrosis factor receptor in liver cirrhosis[J].Med Clin (Barc),2004,122(12):441-443.
[13] Joshi S V, Tambwekar S R, Khadalia K,etal. Role of inflammatory marker interleukin 6 (IL-6) and insulin in diabetes and diabetic neuropathy [J].Bom Hosp,2008,50(3):466-471.
[14] Halvatsiotis I, Tsiotra P C, Ikonomidis I,etal. Genetic variation in the adiponectin receptor 2 (ADIPOR2) gene is associated with coronary artery disease and increased ADIPOR2 expression in peripheral monocytes[J].Car Dia,2010,23(2):9-10.
(2016-10-09收稿 2017-01-10修回)
(责任编辑 岳建华)
Risk factors and related inflammatory factors analysis of diabetic peripheral neuropathy in patients with ty
GUO Yang,SONG Xiao,SHI Xiaoyun,and WANG Li.
Department of Endocrinology, General Hospital of Chinese people’s Armed Police Force, 100039 Beijing,China
Objective Analyze the prevalence situation of Diabetic Peripheral Neuropathy in type 2 diabetes mellitus, study the related risk factors and inflammatory factors.Methods From January 2015 to July 2016,according to DPN diagnostic criteria ,the patients were diagnosed as type 2 diabeteswere divided into diabetic peripheral neuropathy group and non group. Respectively,check whether combined with diabetic retinopathy and peripheral vascular disease, then analysis of age, weight, BMI, course of disease,biochemical indicator,meanwhile, analyse single factor of each index, and then Logistic multivariate analysis.Results (1)The prevalence of diabetic peripheral neuropathy in the study population was 65.9%; (2)The number of combined with peripheral vascular disease in the diabetic peripheral neuropathy group(69%) was significantly higher than that in non diabetic peripheral neuropathy group (50%),through theχ2test,the difference was statistically significant (χ2=5.723,P<0.05); (3)compared with non group,in the analysis of various factors,the HbA1c、LDL-C、IL-6、TNF-α、SIL-2R and disease course of diabetic peripheral neuropathy group was statistically significant (t=2.084~3.407,P<0.05).But there was no statistically significant difference compared to other factors.(4)Logistic multivariate analysis:Course、HbA1c、LDL-C、TNF-α、SIR-2R and combined with peripheral vascular disease are independent risk factors for DPN (OR=0.455~1.655,P<0.05).Conclusions The extension of the disease course, peripheral vascular disease, and blood glucose, blood lipid levels and related inflammatory factors of abnormal, will make diabetic neuropathy exacerbations.
type 2 diabetes mellitus; diabetic peripheral neuropathy; risk factors; inflammatory factors
郭 杨,硕士研究生。
100039 北京,武警总医院内分泌科
侍晓云,E-mail:shixiaoyun1983@126.com
R589.1
