3种对虾精子超低温冷冻保存技术研究
2017-03-26王文琪杨敬昆徐世宏刘清华
王文琪, 杨敬昆, 徐世宏, 刘清华, 李 军
3种对虾精子超低温冷冻保存技术研究
王文琪1, 杨敬昆1, 徐世宏2, 3, 刘清华2, 3, 李 军2, 3
(1. 青岛农业大学 海洋科学与工程学院, 山东 青岛 266109; 2. 中国科学院海洋研究所 中科院实验海洋生物学重点实验室, 山东 青岛 266071; 3. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室, 山东 青岛 266237)
作者以日本囊对虾()、中国明对虾()和南美白对虾()作为实验材料, 研究3种稀释液(天然海水, 人工无钙海水, Hank’s平衡盐溶液)、3种抗冻剂(二甲基亚砜、丙二醇和丙三醇)、3种稀释比例(5%、10%和15%)、3种不同的降温程序对3种对虾精子超低温冷冻保存效果的影响。冻精解冻后通过台盼蓝染色的方法计算其存活率。结果显示, 对于3种对虾, 以天然海水作为稀释液, 10%PG作为抗冻剂, 4℃平衡20 min, 以–2℃/min降温至–40℃, –40℃平衡10℃, 以–15℃/min降温至–150℃, 然后投入液氮作为降温程序进行超低温冷冻保存效果最好, 冻精解冻后存活率分别为75.33%±2.56%、69.00%±3.00%和 23.33%±8.55%。
日本囊对虾(); 中国明对虾(); 南美白对虾(); 精子; 超低温冷冻; 存活率
动物种质细胞的超低温保存是指在超低温条件下, 动物种质细胞内一切新陈代谢过程中的化学变化被超低温所抑制, 即随着温度的逐渐下降, 细胞内的化学反应能力也在逐渐降低, 当温度降到一定阈值时, 细胞的生理活动趋于停止; 低温保存的细胞以一定的方式复苏后, 又具有存活的能力[1]。细胞在冷冻和解冻过程中的损伤主要包括: 过冷休克、冰晶损伤、高渗休克、抗冻保护剂的毒性作用等[2]。精子冷冻过程中由于受到以上多方面因素的影响, 会使精子结构受到损伤, 进而使其功能受到影响。由于不同物种的精子对不同保存条件的承受能力不同, 因此, 应该尽力优化超低温冷冻保存的各个条件, 尽量减少对精子的损伤, 增加精子冷冻保存效率。
自20世纪80年代以来, 对虾养殖一直是中国海水经济作物的支柱型产业, 尤其以南美白对虾()、中国明对虾()、日本囊对虾()为主要的养殖物种, 但是, 由于近年来的养殖泛滥、种质退化、品质下降、病害增加等问题日益严重, 种质资源保护问题一直是对虾养殖业的一个亟待解决的大问题, 解决这一问题最成熟的办法就是超低温冷冻保存技术。近年来, 超低温冷冻保存技术对于哺乳动物和鱼类的精子中应用广泛, 而在几种经济类对虾品种的研究较少[3-5]。柯亚夫等[4]对中国明对虾精子的超低温冷冻保存进行初步的研究,以自然海水或人工海水作基础液添加10%DMSO和少量甘油配成抗冻稀释液, 经液氮蒸气两段预冷结冰后投人液氮中进行超低温冷冻保存, 解冻后精子存活率达到60%; Vuthiphandchai等[6]对斑节对虾()的纳精囊冷冻保存进行了研究, 使用5%DMSO作为抗冻剂, 无钙人工海水作为稀释液时保存效果最佳, 解冻后存活率达71.6%~72.2%; 浦蕴惠等[7]对脊尾白虾()的精子体外保存进行了研究, 并研究了存活率和顶体酶之间的相关性。目前, 中国对对虾精子的超低温冷冻保存研究较少, 因此, 本实验决定以日本囊对虾、中国明对虾、南美白对虾为实验对象, 筛选以上3种对虾精子超低温冷冻保存的最适方法。
1 材料和方法
1.1 实验材料
实验用中国明对虾和日本对虾均来自日照对虾良种养殖场, 中国明对虾体长15.96 cm±0.68 cm, 体质量40.19 g±3.68 g, 养殖温度18~20℃。日本囊对虾体长12.11 cm±0.33 cm, 体质量35.36 g±4.02 g, 养殖温度25~27℃。南美白对虾来自烟台对虾良种养殖场, 体长12.22 cm±0.56 cm, 体质量38.95 g±5.02 g, 养殖温度27~28℃。
1.2 实验方法
1.2.1 精子的获取
解剖对虾, 切断腹神经索, 使雄虾不能弹跳, 以便操作, 将头胸部与腹部分开, 切断贮精囊与生殖孔的联系, 取出贮精囊, 轻轻挤压使精荚露出, 用镊子夹住精荚扇状体与豆状体的联结处, 将精荚取出[8]。将单个精荚放入500 µL天然海水, 将精荚剪碎后用研磨棒进行研磨, 300目筛网进行过滤, 滤出后精子悬液备用。
1.2.2 超低温冷冻保存条件的筛选
选取3种不同的稀释液(天然海水、无钙人工海水和HBSS(Hank's平衡盐溶液)), 3种不同的抗冻剂(二甲基亚砜(DMSO)、丙二醇(PG)和丙三醇(GLY), DMSO购自SIGMA公司, 其他药品均购自国药集团化学试剂有限公司)配成3个不同的浓度(5%, 10%, 15%), 提前1 d置于4℃冰箱预冷过夜。将过滤后的精子悬浊液与冷冻保护剂1︰1混合, 每个样品取10 μL显微镜下观察并计算活精子个数, 放入500 μL的麦管(IMV, L’Aigle, France)中, 4℃放置30 min, 放入程序降温仪(Kyro360-1.7)运行表1(A-1、A-2和A-3)的程序进行程序降温, 之后将样品投入液氮。每个实验组设3个平行, 实验重复3次。

表1 冷冻降温程序
冷冻保存30日后, 37℃解冻, 台盼蓝染色观察其存活个数。每个样品统计3个视野中存活个数总值, 统计活精子个数与冷冻前进行比较计算其存活率, 3个平行样品间取平均值对对虾精子的超低温冷冻保存不同条件进行比较。
1.3 日本囊对虾和中国明对虾的超微结构观察
透射电镜(transmission electron microscopy, TEM)观察: 取机械匀浆法得到的对虾精子, 用2.5%戊二醛(0.2mol/L, pH=7.4, 磷酸缓冲液配制)进行前固定, 然后用1%锇酸(4℃)固定2h, 梯度酒精脱水, 然后用Epon-812渗透包埋, 超薄切片机切片, 经醋酸铀和柠檬酸铅双重染色后透射电镜(日立H-7000)下观察、拍照。
1.4 数据处理
实验数据分析采用 SPSS17.0 软件进行单因素方差(One-Way ANOVA)分析, 结果以平均值±标准差表示, 比较实验结果差异显著性采用Duncan法进行多重比较(=0.05)。
2 实验结果
2.1 精荚及冻存前后精子形态结构的比较
图1为对虾形态图, 3种对虾精子大小形状相似, 南美白对虾精子(图1-1)略大于中国明对虾(图1-2), 直径约为4 μm, 中国明对虾精子略小, 直径约3 μm, 日本囊对虾(图1-3)精子大小与南美白对虾精子大小相当, 直径约为4 μm。所得的游离成熟精子在10×100倍油镜下观察主体部呈圆球状, 带有明显的棘突, 无鞭毛, 不运动。图2为日本囊对虾(图2-1)和中国明对虾(图2-2)投射电镜图, 由图2可见日本囊对虾和中国明对虾精子整体形态相似, 呈椭圆形, 都有单一棘突, 并与顶体相连。
2.2 冷冻降温程序的确定
以10%DMSO为抗冻剂, 天然海水为稀释液, 运行3种降温程序, 实验结果如表2, 运行A-1降温程序进行冷冻保存, 解冻后存活率最高, 3种对虾冻精存活率分别为: 43.11%±6.88%(日本囊对虾)、33.35%± 6.51%(中国明对虾)、11.02%±1.12%(南美白对虾)。
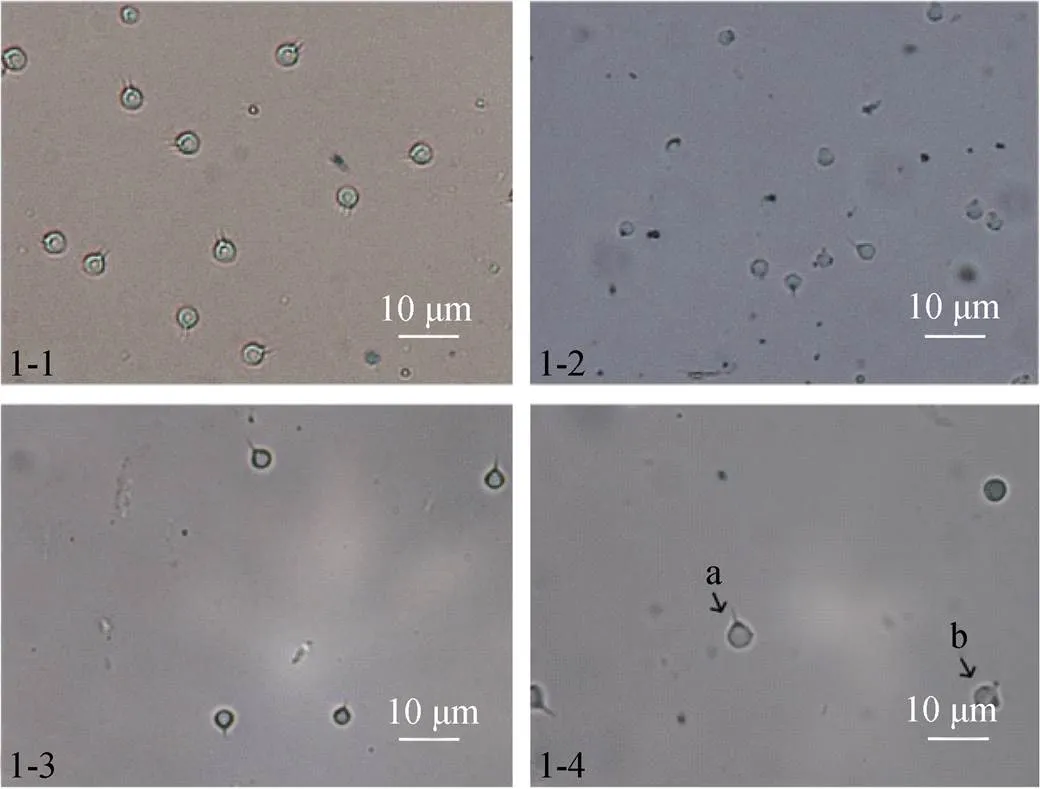
图1 冷冻保存前后对虾精子形态
1-1. 南美白对虾活精子; 1-2. 中国明对虾活精子; 1-3. 日本囊对虾活精子; 1-4. 日本囊对虾冻精解冻后形态; a. 活精子; b. 死精子
1-1. live sperm of; 1-2. live sperm of; 1-3. live sperm of; 1-4. frozen sperm of; a. live sperm; b. a dead sperm

图2 日本囊对虾和中国明对虾透射电镜结果
2-1. 日本囊对虾精子; 2-2. 中国明对虾精子; s. 棘突; ac. 顶体; sr. 亚顶体; n. 细胞核; ct. 细胞质
2-1.sperm; 2-2.sperm; s. spike; ac. acrosomal cap; sr. subacrosomal region; n. nucleus; ct. cytoplasm
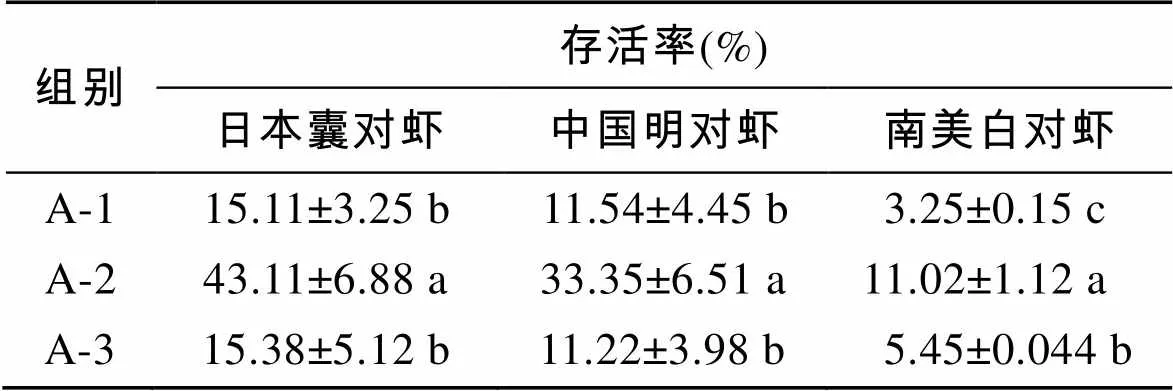
表2 各个降温程序下存活率
同行数据后不同小写字母表示差异显著(<0.05)
2.3 稀释液和抗冻剂对日本囊对虾精子冷冻保存影响
以10%DMSO作为抗冻剂, 不同稀释液下运行A-1降温程序冷冻后日本囊对虾精子存活率见图3。由图3可知, 以10%DMSO作为抗冻剂、稀释液为天然海水时冻精解冻存活率最高, 显著高于其他处理组(<0.05), 存活率为61.56%±4.23%, 无钙人工海水次之, 存活率为54.67%±5.22%, HBSS的效果最差, 存活率为15.00%±3.00%。

图3 不同稀释液对日本囊对虾精子冷冻后存活率的影响
数据后不同小写字母表示差异显著(<0.05), 图4-图8同
Different lowercase letters indicate significant difference (<0.05), the same as fig.4-fig.8
以天然海水作为稀释液, 不同抗冻剂下运行A-1降温程序冷冻后日本囊对虾精子存活率见由图4。由图4可知, 稀释液为天然海水时, 使用10%PG作为抗冻剂时冻精解冻存活率最高, 为75.33%± 2.56%, 显著高于其他处理组(<0.05), 使用GLY和DMSO时抗冻剂时次之, 两者之间差异不显著(>0.05), 15%PG、5%GLY、10%GLY和5%DMSO组解冻后精子存活率不足20%, 显著低于其他处理组(<0.05)。

图4 不同抗冻剂对日本囊对虾精子冷冻后存活率的影响
2.4 稀释液和抗冻剂对中国明对虾冷冻保存的影响
以10%DMSO作为抗冻剂, 不同稀释液下运行A-1降温程序冷冻后中国明对虾精子存活率见图5。由图5可知, 在用10%DMSO作为抗冻剂, 稀释液为天然海水时冻精解冻存活率最高, 显著高于其他组(<0.05), 解冻后存活率为61.56%±3.67%, 无钙人工海水次之, 存活率为39.67%±1.33%, HBSS的效果最差, 存活率为14.67%±5.00%。

图5 不同稀释液对中国明对虾精子冷冻后存活率的影响
以天然海水作为稀释液, 不同抗冻剂下运行A-1降温程序冷冻后中国明对虾精子存活率见图6。由图6可知, 在使用天然海水作为稀释液, 10%PG和10%DMSO组作为抗冻剂时冻精解冻存活率显著高于其他实验组(<0.05), 其中, 10%PG组冻精解冻后存活率最高, 为69.00%±3.00%, 其次为10%DMSO, 3种不同浓度DMSO差异不显著, 5%GLY组作为抗冻剂冻精解冻存活率最低, 显著低于其他处理组(<0.05)。
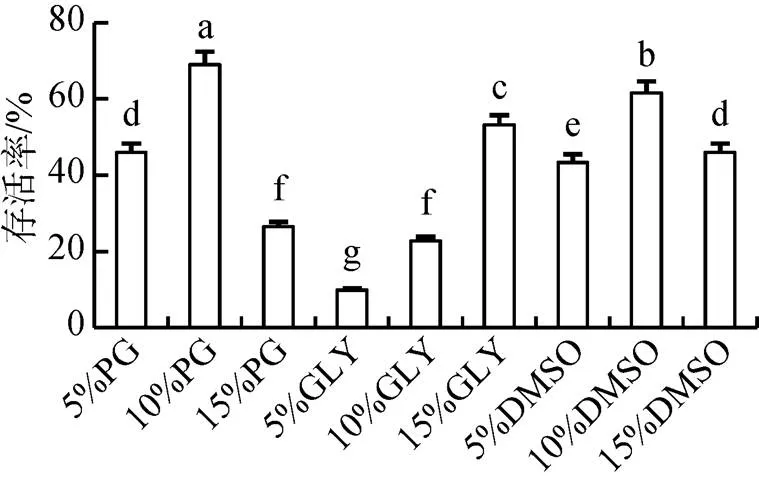
图6 不同抗冻剂对中国明对虾精子冷冻后存活率的影响
2.5 南美白对虾冷冻保存稀释液和抗冻剂的确定
以10%DMSO作为抗冻剂, 不同稀释液下运行A-1降温程序冷冻后南美白对虾精子存活率见图7。由图7可知, 在使用10%DMSO作为抗冻剂时, 稀释液为天然海水时冻精解冻存活率最高, 显著高于其他处理组(<0.05), 为12.33%±3.67%, 无钙人工海水次之, 为10.20%±3.00%, HBSS的效果最差, 存活率仅为3.60%±2.33%。

图7 不同稀释液对南美白对虾精子冷冻后存活率的影响
以天然海水作为稀释液, 不同抗冻剂下运行A-1降温程序冷冻后南美白对虾精子存活率见图8。由图8可知, 在使用天然作为稀释液, 10%PG作为抗冻剂的冻精解冻存活率最高, 显著高于其他实验组(<0.05), 为23.33%±8.55%, 5%PG、10%GLY、15%GLY、5%DMSO和10%DMSO作为抗冻剂时差异不显著(>0.05), 冻精解冻存活率低于20%, 15%PG组冻精解冻后存活率显著低于其他处理组(<0.05), 仅不足5%。

图8 不同抗冻剂对南美白对虾精子冷冻后存活率的影响
3 讨论
3.1 对虾精子的获取
对虾的精子与鱼类、贝类等不同, 它的精子储存在精荚中, 而鱼类、贝类精子在性腺中成熟, 可以通过挤压、解剖等方法较为方便地获得成熟的性腺。精荚是十足类动物所具有的一种特殊结构, 成对存在并贮存在精囊中, 每侧各1个, 其发育程度直接影响卵子的受精率和人工育苗的产量, 在对虾受精前, 精荚具有传输和保护精子的双重作用。一般由精子、精荚基质、精荚壁3部分构成[9]。形态各异, 主要有3种类型: 柄状(异尾类)、管状 (长尾类)、球形或圆形(短尾类)。而中国明对虾和日本囊对虾的精荚形态都为柄状。在之前的研究中, 对虾精子的获取有用胰蛋白酶进行消化, 但是, 在实际的实验中发现用胰蛋白酶进行消化不能很好地控制消化的时间, 因此采用机械匀浆法进行研磨来获取精子。
甲壳动物精子多种多样, 其中须虾亚纲(Mystacocaride)、蔓足亚纲(Cirripedia)、鳃尾亚纲(Branchiura) 等3个亚纲的精子具鞭毛, 能运动, 其他5个亚纲的精子形状各异, 没有中间体和鞭毛[10]。十足类动物的精子与其他较高等动物的精子比较有很大的不同, 缺少鞭毛, 核松散, 不运动, 依据形态分两类: (1) 从中央体部散发出若干棘突的精子, 如爬行目的蟹(Brachyura)、龙虾(Palinuridae)和螯虾(); (2)具有单一棘突的精子, 如游泳亚目的各种虾类。而所有种类的对虾都属于游泳亚目, 据有单一棘突, 其内部结构分为棘突、中间部和主体部, 没有鞭毛, 不主动运动。
3.2 对虾精子活力的评价方法研究
十足目(Decapoda)精子的棘突对于精子在卵的定位和刺穿次序是必需的。而其他鱼类和贝类精子由于有鞭毛, 可以通过精子运动情况直接观察精子活力状况。由于对虾精子没有鞭毛, 不能自由地游动[11]。因此, 对虾精子的质量评价主要通过生物染色剂染色和精卵相互作用这两种方法进行, 由于对虾同一时期的未受精卵难以大量获得, 因此, 生物染色的方法是主要对对虾精子活力评价的方法[12-13]。生物染色主要使用的染色剂有台盼蓝、伊红-苯胺黑, 实验过程中发现用台盼蓝进行染色效果要比其他的要好, 但是在染色过程中, 有些精子的棘突消失但是仍能不被台盼蓝染色, 但实际由于精子的棘突消失, 精子本身已经没有了受精能力。因此, 染料排斥实验只能作为一种粗略的估计精子活力的方法, 但是作为筛选对虾超低温冷冻保存方法的技术, 生物染色方法确实可行。但现在对于对虾精子活力的准确测定只能通过精卵相互作用这一方法, 由于对虾相同发育时期的卵获取难度大, 因此此方法难以实现。
3.3 稀释液和抗冻剂的筛选
稀释的天然或人工海水已被广泛地用于十足目甲壳动物精子冷冻的研究中。柯亚夫等[4]研究表明, 中国明对虾精子冷冻稀释液中, Ca2+、Mg2+、K+为必需, 其中Ca2+不能超过0.7 mol/dm3; Bhabvanishankar[13]发现海水和无钙人工海水均可作为精子冷冻稀释液; 陈东华等[14]研究证实, Na+、K+是鱼类血浆、精浆的重要组分和构成渗透压的主要离子, Na+有促进精子活动的作用, 而适当的K+浓度可延长精子寿命。柯亚夫等[4]对中国明对虾精子冷冻保存进行研究, 发现稀释液为天然海水时效果最好; 而廖馨等[15]、浦蕴惠等[7]实验时发现使用壬氏液作为稀释液对青虾, 脊尾白虾精子冷冻保存效果最好, 使用DMSO作为抗冻剂时冻精解冻存活率最高, 本研究结果对于3种不同的对虾而言, 10%PG作为抗冻剂、天然海水作为稀释液, 运行A-1程序进行冷冻保存, 解冻后存活率最高。
虽然本实验成功筛选出了3种对虾精子超低温冷冻保存的最适方法, 但是对于对虾精子解冻后的存活率统计上还是略有不足。对于对虾精子存活率的统计, 通过人工授精的方法更为可靠, 而且本实验只是对对虾精子冷冻保存的方法进行了一个初步的筛选, 并没有进行有关添加剂对于冷冻保存效果的讨论, 希望在以后的研究中能够进一步进行探讨。
[1] 李纯, 李军, 薛钦昭. 海洋生物种质细胞低温保存与机理[J]. 海洋科学, 2000, 24(4): 12-15. Li Chun, Li Jun, Xue Qinzhao. Cryopreservation of germ cells of marine organisms and its mechanism[J]. Marine Sciences, 2000, 24(4): 12-15.
[2] 李喜龙, 季维智. 动物种质细胞的超低温冷冻保存[J].动物学研究, 2000, 21(5): 407-411. Li Xilong, Ji Weizhi. Cryopreservation of animal germplasm cells[J]. Zoological Studies, 2000, 21(5): 407-411.
[3] Abdelmoneimi Y, Beth R, Saba K, et al. The effects of antifreeze peptideⅢ (AFP)and insulin transferrin selenium (ITS) on cryopreservation ofchimpanzee () spermatozoa[J]. J Androl, 1998, 19: 207.
[4] 柯亚夫, 蔡难儿. 中国对虾精子超低温保存的研究[J]. 海洋与湖沼, 1996, 27(2): 187-193. Ke Yafu, Cai Nan’er. Cryopreservation of spermatozoa from the marine shrimp penaeus chinensis[J]. Oceanologia Et Limnologia Sinica, 1996, 27(2): 187-193.
[5] 蔡难儿, 林峰, 陈本楠, 等. 中国对虾受精生物学的研究[J]. 海洋与湖沼, 1997, 28(3): 271-277. Cai Nan’er, Lin Feng, Chen Bennan, et al. Biology of fertilization in[J]. Oceanologia Et Limnologia Sinica, 1997, 28(3): 271-277.
[6] Vuthiphandchai V, Nimrat S, Kotcharat S, et al. Development of a cryopreservation protocol for long-term storage of black tiger shrimp () spermatophores[J]. Theriogenology, 2007, 68(8): 1192-1199.
[7] 浦蕴惠, 许星鸿, 高焕, 等. 脊尾白虾精子体外保存的研究[J]. 海洋科学, 2013, 37(3): 95-101. Pu Yunhui, Xu Xinghong, Gao Huan, et al. Study on in vitro preservation of spermatozoa of[J]. Marine Sciences, 2013, 37(3): 95-101.
[8] Anchordoguy T, Crowe J H, Griffin F J, et al. Cryopreservation of sperm from the marine shrimp[J]. Cryobiology, 1988, 25(3): 238-243.
[9] Aungsuchawan S, Browdy C L, Withyachumnarnkul B. Sperm capacitation of the shrimp[J]. Aquaculture Research, 2011, 42(2): 188-195.
[10] Pochon-Masson J. Spermatogenesis and sperm function (Vol.II, )[M]. New York: Wiley, 1983: 107-449.
[11] Jeyalectumie C, Subramoniam T. Cryopreservation of spermatophores and seminal plasma of the edible crab[J]. Biol Bull, 1989, 177: 247-253.
[12] Bray W A, Lawrence A L. Male viability determinations in: evaluation of short-term storage of spermatophores up to 36h and comparison of Ca2+-free saline and seawater as sperm homogenate media[J]. Aquaculture, 1998, 160: 63-67.
[13] Bhabvanishankar S, Subramoniam T. Cryopreservation of spermatozoa of the edible mud crab(Forska)[J]. J Exp Zool, 1997, 277: 326-336.
[14] 陈东华, 李艳东, 贾林芝, 等. 冷冻保护剂及预冷时间对河蟹精子体外冷冻保存的影响[J]. 水生生物学报, 2008, 4: 579-585. Chen Donghua, Li Yandong, Jia Linzhi, et al. Cryopreservation of eriocheir sinensis sperms (in vitro) with different cryoprotective solutions and prefreezing time[J]. Acta Hydrobiologica Sinica, 2008, 4: 579-585.
[15] 廖馨, 葛家春, 丁淑燕, 等.青虾精子超低温冷冻保存技术的研究[J]. 南京大学学报(自然科学), 2008, 44(4): 421-426. Liao Xin, Ge Jiachun, Ding Shuyan, et al. Study on cryopreservation of the sperm of freshwater prawn[J]. Journal of Nanjing University (natural science), 2008, 44(4): 421-426.
(本文编辑: 谭雪静)
Cryopreservation of spermatozoa of three prawn species
WANG Wen-qi1, YANG Jing-kun1, XU Shi-hong2, 3, LIU Qing-hua2, 3, LI Jun2, 3
(1.Marine Science and Engineer College, Qingdao Agricultural University, Qingdao 266109, China; 2. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 3 Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China)
This study was conducted to examine the cryoprotective effects of three extenders (natural seawater, calcium-free saline, and Hank’s balanced salt solution), three cryoprotectants (DMSO, propylene glycol, and glycerol) at different concentrations and three dilution ratios (5%, 10%, and 15%), and three cooling procedures on the cryopreservation of sperms of three types of shrimp, Kuruma prawn,, and. The survival rates of post-thawed sperms were calculated by trypan blue staining, and the cryopreservation procedures of the three shrimps were screened. Successful cryopreservation of sperms of these three shrimps in liquid nitrogen was achieved using sterilized natural seawater containing 10% propylene glycol with A-1 procedure, with the survival rates being 75.33% ± 2.56%, 69.00% ± 3.00%, and 23.33% ± 8.55%, respectively.
;;; cryopreservation; spermatozoa; survival rate
Oct. 24, 2016
王文琪(1969-), 女, 山东莱阳人, 博士, 教授, 主要从事海洋生物养殖生态方面的研究, 电话: 13730901370, E-mail: wenqi31@163.com; 李军,
, 电话: 13506482136, E-mail: junli@qdio.ac.cn
S917.4
A
1000-3096(2017)09-0081-06
10.11759//hykx20161024003
2016-10-24;
2017-05-24
山东省现代农业产业技术体系虾蟹创新团队项目(SDAIT-13); 农业部948项目(2015-Z59); 鳌山科技创新计划资助项目(2015ASKJ02, 2015ASKJ02-03-033); 海洋药源生物种质资源库建设项目(12PYY001SF08)
[Shandong Province’s Innovation Team of Modern Agricultural Technology System, No. SDAIT-13; Ministry of Agriculture 948 Project, No.2015-Z59; Aoshan Science and Technology Innovation Plan, No.2015ASKJ02, 2015ASKJ0203-033; Marine Economy Innovative Development Project, No. 12PYY001SF08]
