miR-181a在脑缺血神经损伤与神经康复中的作用
2017-03-24王剑雄胥方元
汪 丽 王剑雄 胥方元
(西南医科大学附属医院康复医学科,四川 泸州 646000)
miR-181a在脑缺血神经损伤与神经康复中的作用
汪 丽 王剑雄 胥方元
(西南医科大学附属医院康复医学科,四川 泸州 646000)
目的 探讨miR-181a在脑缺血损伤与神经康复中的作用机制。方法 构建脑缺血大鼠模型和miR-181a过表达载体,通过尾静脉注射促进脑缺血大鼠脑组织中miR-181a的表达。RT-PCR检测24 h后脑组织miR-181a的表达水平。Tunel检测海马区细胞凋亡情况。对脑缺血大鼠模型进行神经功能评分。Western印迹检测大鼠脑组织中白细胞介素(IL)-1β、肿瘤坏死因子(TNF)-α、IL-6的表达水平。结果 脑缺血处理的大鼠缺血组、对照组、促进组的miR-181a水平均明显高于正常组,促进组高于对照组和缺血组(P<0.01),对照组和缺血组无显著差异(P>0.05)。尾静脉注射的rAAV-miR-181a载体可以有效促进大鼠脑组织中miR-181a的表达。Tunel结果显示,促进组中脑组织海马区的阳性细胞比例高于对照组。促进脑缺血大鼠miR-181a的表达,脑组织中细胞凋亡率增高。促进组大鼠神经功能评分明显高于对照组(P<0.05),大鼠脑组织中IL-1β、TNF-α、IL-6蛋白表达水平均明显高于对照组(P<0.01)。结论 miR-181a在脑缺血组织中过表达,可以促进脑组织细胞凋亡和炎症的发生,加重神经损伤的严重程度。
miR-181a;脑缺血;神经损伤;凋亡
脑缺血与高血脂、动脉粥样硬化、糖尿病等的发生有密切关系,脑缺血可发生于任何年龄阶段〔1〕。小分子RNA(miRNA)在人体内广泛表达,在胚胎系统、神经系统、心血管系统等多种组织器官中发挥重要作用〔2,3〕。有研究表明,miR-376b、miR-497、miR-210等多种miRNA参与脑缺血后的神经细胞凋亡〔4〕,但尚未见miR-181a与脑缺血中神经损伤的相关研究。本研究拟探究miR-181a在脑缺血神经损伤中的作用机制。
1 材料与方法
1.1 材料 SD雄性健康大鼠40只,体重220~240 g,购于西南医科大学动物实验中心。主要仪器及试剂:水浴锅(长沙基隆仪器仪表有限公司),超净工作台(苏州尚田洁净技术有限公司),PCR仪(赛飞(中国)有限公司),显微镜(日本尼康),流式细胞仪(杭州联科生物科技有限公司),离心机(盐城市凯特实验仪器有限公司),紫外分光光度计(江苏天瑞仪器股份有限公司),PVDF膜(美国Sigma),PBS(鼎国生物试剂有限公司),反转录试剂盒(上海易利生物科技有限公司),荧光定量PCR试剂盒(上海易利生物科技有限公司),IL-6单克隆抗体(上海文渊阁生物科技有限公司),IL-1β单克隆抗体(上海文渊阁生物科技有限公司),TNF-α单克隆抗体(上海文渊阁生物科技有限公司),β-actin单克隆抗体(上海文渊阁生物科技有限公司),辣根过氧化物标记的二抗(上海文渊阁生物科技有限公司)。
1.2 方法
1.2.1 miR-181a过表达载体构建及实验分组 准备腺病毒感染的HEK293细胞,利用磷酸钙将包装质粒和miR-181a cDNA载体质粒共同转染到细胞中,培养48 h后,1 000 r/min离心10 min,弃上清液。反复冻融细胞团块,细胞裂解液在55℃孵育30 min。1 000 r/min离心10 min,弃细胞碎片。纯化粗提物,测定病毒的滴度。40只健康雄性大鼠分为正常组、缺血组、对照组和促进组,其中对照组和促进组分别尾静脉注射对照质粒(rAAV-GFP)和miR-181a过表达载体(rAAV-miR-181a)。
1.2.2 脑缺血大鼠模型构建 用浓度为10%的水合氯醛腹腔注射麻醉大鼠。将大鼠四肢和头部固定。小心剪毛后,在颈部中线小心切开4 cm,将皮下组织钝性分开后,将颈外动脉(ECA)和颈内动脉(ICA)分离并暴露后,凝闭颈动脉的分叉处和甲状腺上的动脉发出的枕动脉,凝闭用电凝器操作。根据ICA找到翼腭动脉(PPA)后阻断血流,阻断血流用微动脉夹操作。凝闭ECA的远端并用1号线打结,同时阻断颈总动脉和ICA的血流。将ECA切断后,拴线从ECA、ICA插入到大脑动脉(MCA)从而阻断血流。结扎ECA后,清理血块,去掉动脉夹,将伤口缝合。其中正常组分离颈总动脉,不阻断血流不插入拴线。
1.2.3 RT-PCR检测大鼠脑组织中miR-181a水平 大鼠脑缺血损伤后24 h,麻醉后断头处死,取大鼠的脑组织剪碎。在研钵中加入液氮后,将剪碎的组织置于研钵中研磨,观察研磨成粉状后,取80 mg粉末至EP管中,在EP管中加入1 ml的Trizol裂解液,混合均匀后放置于室温下裂解5 min。在EP管中加入氯仿200 μl,上下剧烈摇动15 s,10 000 r/min,4℃离心5 min,吸取上层水相层至新的EP管中,用500 μl的异丙醇抽提RNA,上下温和颠倒10次,在室温下静置10 min,10 000 r/min离心10 min。弃上清液,加入浓度为75%的乙醇悬浮RNA沉淀,10 000 r/min,4℃离心15 min,弃上清液。将EP管放置于超净工作台风干,加入焦碳酸二乙酯(DEPC)水悬浮,紫外分光光度计测定提取的RNA浓度。按照反转录试剂盒说明书操作步骤反转录合成miR-181a的cDNA,实时荧光定量PCR检测miR-181a的水平。
1.2.4 Tunel检测细胞凋亡 大鼠脑缺血损伤后24 h,麻醉后断头处死,制作石蜡包埋的脑组织海马区组织切片。将脑组织切片放置于二甲苯中浸泡2次,5 min/次。分别用100%、95%、90%、80%、70%的浓度梯度乙醇浸泡,每个浓度梯度浸泡3 min。用磷酸盐缓冲液(PBS)漂洗2次,4 min/次。加入Proteinase K溶液孵育30 min。用蒸馏水洗涤切片4次,3 min/次。取末端转移酶(TdT)缓冲液滴加至切片上,放置于室温下孵育5 min。取50 μl TdT酶缓冲液,放置于湿盒中,37℃孵育1 h。其中阴性对照组中加入不含有TdT的酶反应液。将切片放置于Tunel缓冲液中,在染色缸中加入反应终止缓冲液和洗涤缓冲液,37℃孵育30 min,用PBS洗涤组织切片后,取过氧化物酶标记的抗体滴加至切片上,放置于湿盒中,37℃孵育30 min。滴加PBS洗涤后,加入二氨基联苯胺(DAB),用苏木素复染后,用自来水冲洗,浓度梯度酒精脱水,二甲苯透明2次,中性树胶封片后,显微镜下观察阳性细胞数量占总细胞数的比值。
1.2.5 神经功能评分 神经功能评分设置为0~4分,评分越高,说明神经损伤越严重。大鼠可以自主活动,无异常反应,未表现出神经功能损伤的症状计0分;大鼠左前爪不能完全伸展,有轻度神经损伤的计1分;观察大鼠在自由活动时,身体不由自主地向左侧转圈,存在中度神经功能损伤症状的计2分;大鼠在自主活动时,身体不由自主地向左侧倾斜,具有重度神经功能损伤的计3分;大鼠不具备自由活动能力,不能行走,丧失意识,有极重度神经功能损伤计4分。
1.2.6 Western印迹检测白细胞介素(IL)-1β、肿瘤坏死因子(TNF)-α、IL-6的表达水平 大鼠脑缺血损伤后24 h,取大鼠脑组织,剪碎后放置于匀浆器中,在匀浆器中加入含有苯甲基磺酸氟(PMSF)储备液的裂解液,放置于冰上充分研磨,转移组织研磨液至EP管中,12 000 r/m,4℃离心10 min。吸取蛋白上清液至新EP管中,用紫外分光光度计检测蛋白浓度及纯度。取蛋白样品与loading buffer充分混合后,放置于100℃煮沸5 min。在蛋白胶上样孔中加入50 μl的蛋白样品,蛋白电泳初始电压为80 V,电泳30 min后观察溴酚蓝进入分离胶后,调整电压至120 V。电泳结束后取出蛋白凝胶,按照滤纸、聚偏氟乙烯(PVDF)膜、蛋白凝胶、滤纸的顺序,4℃转膜过夜,转膜电压为90 V。取出PVDF膜经5%脱脂奶粉封闭后,Tris盐酸缓冲液(TBST)洗膜3次,5 min/次,分别依次与一抗和二抗孵育后,在暗室中显影,曝光,分析蛋白表达量。
1.3 统计学方法 采用SPSS22.0软件进行方差表示。
2 结 果
2.1 RT-PCR检测大鼠脑组织中miR-181a表达结果 脑缺血处理的大鼠缺血组(1.98±0.02)、对照组(2.01±0.04)、促进组(3.21±0.08)的miR-181a的水平均明显高于正常组(1.02±0.01),促进组高于对照组和缺血组(均P<0.01),对照组和缺血组无显著性差异(P>0.05)。尾静脉注射的rAAV-miR-181a载体可以有效促进大鼠脑组织中miR-181a的表达。见图1。
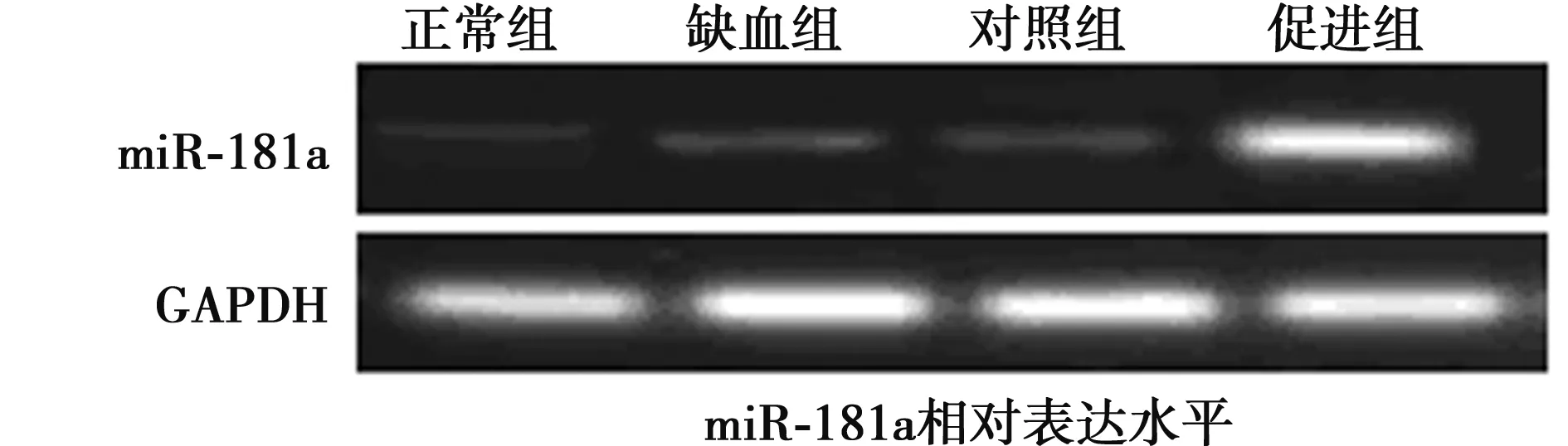
图1 RT-PCR检测各组大鼠脑组织中miR-181a表达水平
2.2 Tunel检测大鼠脑组织细胞凋亡结果 促进组中脑组织的阳性细胞比例(0.74±0.05)高于对照组(0.26±0.03)(P<0.01)。促进脑缺血大鼠miR-181a的表达,脑组织中细胞凋亡率增高。
2.3 神经功能评分结果 促进组的大鼠神经功能评分(3.69±0.24)明显高于对照组(2.43±0.16)(P<0.05)。大鼠中过表达miR-181a可以促进大鼠神经损伤的发生。
2.4 Western印迹检测IL-1β、TNF-α、IL-6的表达结果 促进组大鼠脑组织中IL-1β、TNF-α、IL-6蛋白表达水平均明显高于对照组(P<0.01)。见图2,表1。
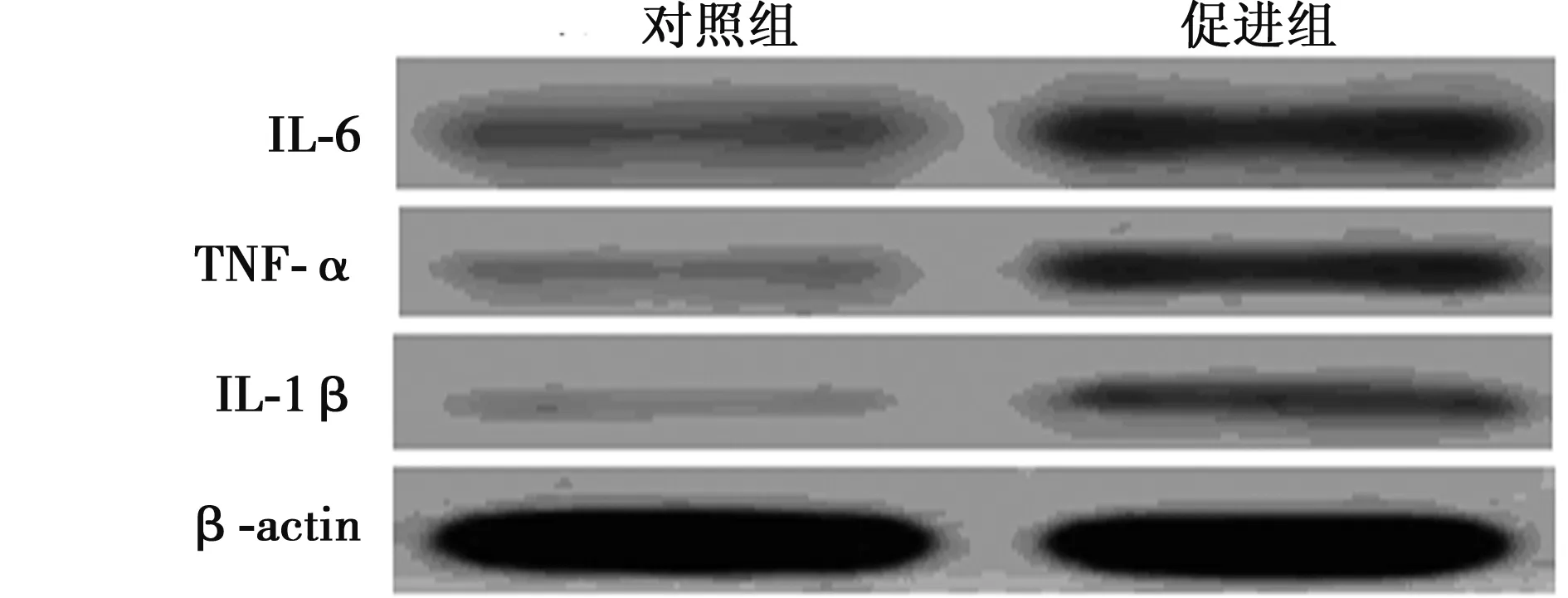
图2 脑缺血大鼠脑组织中IL-1β、TNF-α、IL-6的表达水平

组别IL-1βTNF-αIL-6对照组0.09±0.010.12±0.020.15±0.04促进组0.26±0.031)0.32±0.041)0.42±0.051)
与对照组比较:1)P<0.01
3 讨 论
脑缺血是一种严重危害人类生命健康的脑血管疾病,主要是由于脑组织中血液供应不足引起的〔5〕。脑缺血发生于多种疾病中,与糖尿病、高血压、血小板减少密不可分。脑缺血伴随的神经损伤是脑缺血致病的重要因素。有研究表明,脑缺血引起的神经损伤与神经细胞的凋亡有关〔6〕。
miRNA发现于真核生物中,由20~25个核苷酸组成,是一类非编码的具有调控功能的RNA。miRNA没有开放阅读框(ORF)〔7〕。成熟的miRNA是由一系列复杂的核酸酶加工剪切而成〔8〕。将剪切后的RNA被组装到沉默复合体中,可以通过碱基互补作用与靶mRNA结合。miRNA可以阻止mRNA的翻译或者直接降解mRNA。一般情况下,miRNA与靶mRNA不能完全互补的时候,可以阻止相关蛋白质的表达〔9〕。miRNA如果可以完全与靶mRNA互补,就可以直接降解靶mRNA。随着人们对miRNA的不断研究,miRNA的功能也越来越受到重视。已经有研究证明,miRNA参与了细胞的生长和凋亡,与心脏的发育、胚胎发育、神经元的形成、癌症的发生等有密切关系〔10〕。miR-273调控线虫神经系统的发育,miR-196在哺乳动物四肢的发育中具有调控功能,miR-1参与心脏的发育。miR-143在癌细胞中低表达,抑制了癌细胞的凋亡。miRNA在脑缺血疾病中发挥重要作用〔11〕。
miR-181a是一种小分子RNA,在神经系统中存在表达。miR-181a是miR-181家族中的一个成员〔12〕。miR-181a由23个核苷酸组成。miR-181a可以促进B细胞分化,与T细胞表面受体有关〔13〕。此外,miR-181a还与血管的发育、肿瘤的转移、心律失常等有密切关系〔14〕。本研究结果显示,miR-181a在脑缺血大鼠脑组织中过度表达。为了进一步验证脑缺血大鼠脑组织中miR-181a在神经损伤中的作用,构建了过表达miR-181a的质粒。通过尾静脉注射,促进缺血大鼠脑组织中miR-181a的表达。经RT-PCR检测,过表达载体可以有效促进脑缺血大鼠脑组织中miR-181a的表达。
脑缺血发生的神经损伤中,神经元细胞的凋亡是造成神经损伤的重要原因。利用Tunel法检测脑缺血大鼠中细胞凋亡结果,提示过表达miR-181a可以促使脑缺血大鼠神经元细胞的凋亡。根据神经功能评分标准,对脑缺血大鼠的神经损伤进行评分。结果提示miR-181a可以加重大鼠脑缺血的神经损伤。Western印迹检测结果说明miR-181a可以促进脑缺血大鼠脑组织中炎症的发生。
综上所述,miR-181a在脑缺血大鼠脑组织中过表达。miR-181a加重脑缺血神经损伤,促进神经元细胞的凋亡。这为进一步研究miR-181a在脑组织神经损伤中的作用机制奠定了基础,为治疗脑缺血提供了新的思路。
1 徐成成,张鹏飞,丁新生,等.淫羊藿苷对脑缺血大鼠PTEN和GAP-43蛋白表达的影响〔J〕.中风与神经疾病杂志,2015;32(1):4-7.
2 Wang P,Mu YY,Cheng J,etal.Electroacupuncture on serum interleukin level in rat models of cerebral ischemia-reperfusion injury〔J〕.J Acupunct Tuina Sci,2015;13(1):9-14.
3 李 东.miRNA 对垂体瘤细胞株中增生细胞核抗原,垂体瘤转化基因,血管内皮细胞生长因子表达的影响〔J〕.中国老年学杂志,2015;35(24):7033-5.
4 王 阶,李 敏,刘咏梅,等.miRNA 在冠心病治疗中的作用及与中医药的相关性〔J〕.中国实验方剂学杂志,2015;21(22):1-5.
5 王杰华,李国前.人尿激肽原酶对脑缺血再灌注大鼠胶质细胞源性神经营养因子和血小板源性生长因子的影响〔J〕.中国临床药理学杂志,2016;32(5):421-3.
6 邓华江,张 双,明 扬,等.环孢菌素A通过PI3K-Akt通路保护小鼠脑缺血再灌注后血脑屏障损伤〔J〕.第三军医大学学报,2016;38(1):32-7.
7 Ren Z,Ambros VR.Caenorhabditis elegans microRNAs of the let-7 family act in innate immune response circuits and confer robust developmental timing against pathogen stress〔J〕.Proc Natl Acad Sci U S A,2015;112(18):2366-75.
8 Smyth LA,Boardman DA,Tung SL,etal.MicroRNAs affect dendritic cell function and phenotype〔J〕.Immunology,2015;144(2):197-205.
9 Pua HH,Steiner DF,Patel S,etal.MicroRNAs 24 and 27 suppress allergic inflammation and target a network of regulators of T helper 2 cell-associated cytokine production〔J〕.Immunity,2016;44(4):821-32.
10 Zeng K,Zheng W,Mo X,etal.Dysregulated microRNAs involved in the progression of cervical neoplasm〔J〕.Arch Gynecol Obstet,2015;292(4):905-13.
11 Mehta A,Baltimore D.MicroRNAs as regulatory elements in immune system logic〔J〕.Nat Rev Immunol,2016;16(5):279-94.
12 Brockhausen J,Tay SS,Grzelak CA,etal.miR-181a mediates TGF-β-induced hepatocyte EMT and is dysregulated in cirrhosis and hepatocellular cancer〔J〕.Liver Int,2015;35(1):240-53.
13 Figueredo D,Gitaí DL,Andrade TG.Daily variations in the expression of miR-16 and miR-181a in human leukocytes〔J〕.Blood Cells Mol Dis,2015;54(4):364-8.
14 袁世梅,李 欢,杨 敏,等.HIFU通过下调miR-181a进而促进ICAM-1表达增强小鼠抗肿瘤免疫〔J〕.第三军医大学学报,2015;37(1):16-21.
〔2016-06-22修回〕
(编辑 袁左鸣)
胥方元(1970-),男,硕士,硕士生导师,主任医师,主要从事神经康复、骨科康复研究。
汪 丽(1987-),女,医师,在读硕士,主要从事神经康复、骨科康复研究。
R743.3
A
1005-9202(2017)04-0831-03;
10.3969/j.issn.1005-9202.2017.04.020
