他汀药物对p53突变肿瘤细胞的作用及机制
2017-03-24牟汉川杨志宽暴亚锋王玉玲张继虹
牟汉川 杨志宽 暴亚锋 王玉玲 刘 静 张继虹
(昆明理工大学医学院衰老与肿瘤分子遗传学实验室,云南 昆明 650500)
他汀药物对p53突变肿瘤细胞的作用及机制
牟汉川 杨志宽 暴亚锋 王玉玲 刘 静 张继虹
(昆明理工大学医学院衰老与肿瘤分子遗传学实验室,云南 昆明 650500)
目的 研究他汀药物对p53突变的肿瘤细胞的作用及分子机制。方法 采用具有突变p53背景的人结肠癌HT29细胞,通过MTT实验检测他汀药物对细胞增殖的影响,用Western印迹检测他汀药物浓度梯度和时间梯度处理后细胞内突变p53,分子伴侣热休克蛋白(HSP)90、p53信号通路下游靶蛋白PUMA、p21、凋亡相关蛋白PARP的表达情况。结果 MTT实验结果显示,他汀药物会显著抑制HT29细胞的增殖,美伐他汀IC50为(39.95±3.81)μmol/L,辛伐他汀IC50为(24.99±0.70)μmol/L。Western印迹结果显示,随着浓度和时间梯度增加,突变p53和HSP90表达水平没有改变,但是,p53下游靶蛋白PUMA、p21的表达水平升高,PARP蛋白切割增强。结论 他汀药物能够抑制p53突变的肿瘤细胞的增殖,其机制可能是将突变型p53恢复为野生型p53从而发挥其转录激活下游靶基因的功能。
他汀;突变p53;凋亡
野生型p53是一个肿瘤抑制因子,在细胞应激反应中发挥重要作用。突变或功能缺失的p53会导致细胞周期失调,基因组不稳定,对应激信号产生抗性,最终导致肿瘤的发生〔1〕。研究发现,肿瘤细胞中p53的突变率约为50%〔2〕。突变p53失去了野生型p53对细胞应激的保护作用。大多数的p53突变都是发生在DNA结合区的错义突变,这直接导致DNA不能正确与之结合并破坏其转录活性。突变p53使得肿瘤细胞获得对化疗的耐药性,增强细胞生长、代谢和侵入等致癌的新功能〔2〕。正常细胞中野生型p53主要通过MDM2的泛素化途径降解。同样,在肿瘤细胞中突变p53由于细胞应激反应而积累。因此,野生型p53在细胞中积累而抑制肿瘤,突变p53积累使肿瘤细胞产生获得性功能而促肿瘤发生。以突变p53为靶点的抗肿瘤药物的研究中,一方面是使突变p53部分或全部恢复野生型p53功能,并激活其下游蛋白PUMA、p21、NOXA等的表达,从而发挥与野生型p53相似的抗肿瘤活性〔3,4〕。他汀药物作为一种3-羟基-3-甲基-戊二酰辅酶A还原酶抑制剂,可降低胆固醇和抑制类异戊二烯的合成,不仅用于治疗心血管疾病,还可以用于治疗类风湿关节炎、骨质疏松和肿瘤〔5〕。然而,其具体的抗肿瘤作用机制仍不清楚。本研究初步探讨他汀药物中的美伐他汀和辛伐他汀在具有突变p53背景的人结肠癌HT29(R273H)细胞中的抗肿瘤作用及其机制。
1 材料与方法
1.1 实验材料 人结肠癌HT29细胞购自中科院上海细胞库;美伐他汀(mevastatin)和辛伐他汀(simvastatin)购自Sigma公司;胎牛血清、1640培养基购自Gibco公司;MTT购自Sigma公司;DMSO(溶解药物)购自Amresco公司;DMSO(溶解甲瓒)购自Coolaber公司;热休克蛋白(HSP)90、p53抗体购自Santa公司;PARP抗体购自CST公司;PUMA抗体购自Abcam公司;p21抗体购自BD公司。
1.2 实验方法
1.2.1 细胞培养 人结肠癌HT29细胞培养于含10%胎牛血清的1640培养基中。置于37℃,5%CO2培养箱中培养。
1.2.2 MTT实验 取生长状态良好的细胞,用0.25%的胰蛋白酶消化后制成细胞悬液,血球计数板计数,按照一定的细胞密度接种到96孔板中(不同的细胞设置不同的接种密度),37℃培养箱中培养过夜;一种他汀药物设置5个浓度梯度(0.1、1、10、50、100 μmol/L)3个复孔,37℃培养箱中培养72 h后终止培养;每孔加入5 mg/ml的MTT溶液25 μl,放置于培养箱中4 h;吸弃悬液加入150 μl DMSO,置摇床上振荡10 min;于酶联免疫检测仪490 nm波长下测定OD值。根据测定的OD值计算出IC50值和细胞的相对存活率。
1.2.3 Western印迹实验 药物处理后的细胞用细胞刮刮下并收集细胞悬液,1 500 r/min离心5 min,用1×PBS清洗1次,加入细胞裂解液,提取细胞总蛋白。用12%SDS聚丙烯酰胺凝胶对细胞样品进行电泳,电泳结束后将蛋白转移至聚偏二氟乙烯膜(PVDF膜),用5%的脱脂奶粉封闭1 h,加入一抗4℃过夜,用1×TBST清洗3次,加入辣根过氧化物酶标记的二抗,室温2 h。用化学发光检测系统检测。
2 结 果
2.1 美伐他汀和辛伐他汀对细胞增殖的影响 辛伐他汀IC50为(24.99±0.70)μmol/L,美伐他汀IC50为(39.95±3.81)μmol/L。从细胞存活率曲线图中可以直观地看出随着药物浓度的增加,HT29细胞的存活率逐渐降低(图1)。提示他汀药物可抑制具有突变p53背景细胞的增殖。
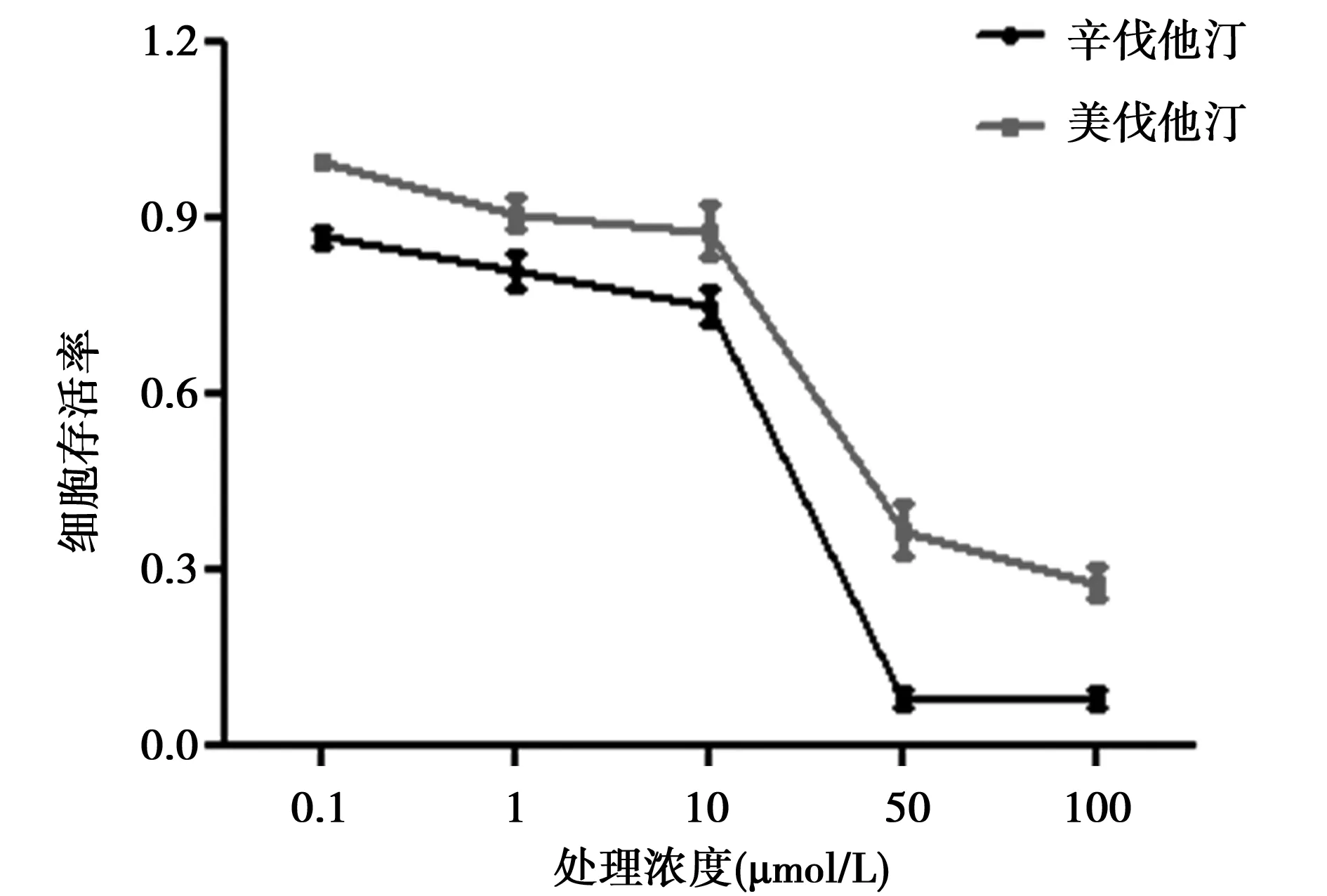
图1 他汀药物对HT29细胞存活率的影响
2.2 美伐他汀和辛伐他汀对p53下游蛋白表达的影响 美伐他汀和辛伐他汀处理HT29后随着浓度的增加细胞中突变p53蛋白表达水平并没有明显改变。同时,可与突变p53形成稳定复合体的HSP90蛋白表达水平也没有改变(图2)。但是,p53下游靶蛋白PUMA和p21随着浓度梯度的增加表达水平上升(图3)。提示他汀药物可能是通过恢复野生型p53的活性,进而激活p53下游凋亡相关的PUMA和细胞周期相关的p21的表达而发挥抗肿瘤作用。
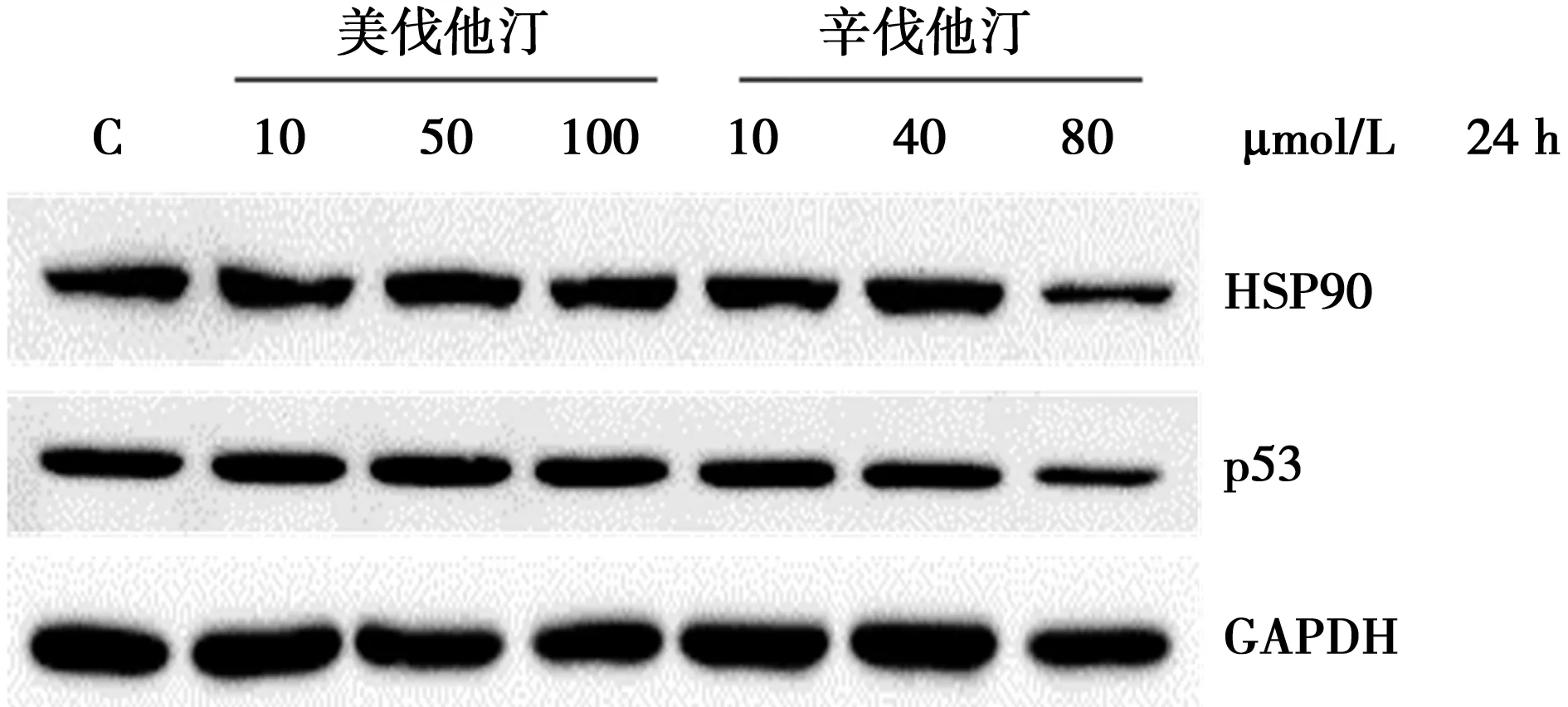
图2 他汀药物对HT29细胞突变p53和HSP90表达的影响
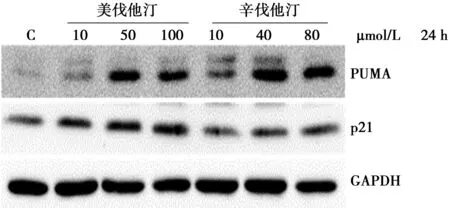
图3 他汀药物对HT29细胞p53信号通路相关蛋白 PUMA和p21表达的影响
2.3 美伐他汀和辛伐他汀对PARP蛋白表达的影响 根据MTT实验的结果,设置浓度梯度和时间梯度处理HT29细胞后进行Western印迹实验。结果显示,随着浓度和时间梯度的增加,美伐他汀和辛伐他汀均能诱导PARP蛋白的切割(图4)。提示他汀药物可促进具有突变p53背景的细胞凋亡的发生。
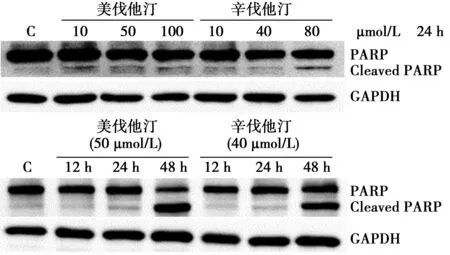
图4 他汀药物对HT29细胞PARP蛋白表达的影响
3 讨 论
不同的胞内应激信号会导致p53信号通路的激活,使p53参与到翻译的调节中并发挥其肿瘤抑制功能〔6〕。在大多数人类肿瘤中的一个共同特征是p53发生突变或p53信号通路紊乱而导致p53功能缺失。75%的突变导致表达的p53蛋白失去其野生型的功能并对残存的野生型p53存在负显性调节〔7〕。并且,突变p53获得原癌基因功能对野生型p53并不依赖〔8〕。已经有研究表明,50%的人类癌症中都会发生p53突变〔9〕。因此,通过作用于突变p53(降解突变p53或恢复为野生型p53)进行抗肿瘤研究具有非常好的前景。
他汀类作为一种治疗心血管疾病的药物,同样也可用于抗肿瘤的治疗中。Murtola等〔10〕对24 723例前列腺癌治疗病例分析后发现,患者使用阿托伐他汀、洛伐他汀和辛伐他汀后可明显降低高级前列腺癌发生的风险。Lakha等〔11〕分析603例结肠癌患者,其中309例使用他汀,294例不使用他汀,发现他汀可明显延长病人的生存期,还可降低向高级转化的风险。在其他高发性癌症中,对肺癌的治疗效果很差,对乳腺癌的治疗效果取得不错的进展。
本实验结果发现,美伐他汀和辛伐他汀对突变p53和HSP90的表达并无明显影响,但是p53下游的靶蛋白PUMA、p21表达上调,凋亡相关蛋白PARP也发生切割。PUMA、p21是p53信号通路下游的靶蛋白,可以参与到凋亡和细胞周期的调控。PARP是存在于多数真核细胞中的一个多功能蛋白质翻译后修饰酶,也是细胞凋亡核心成员caspase的切割底物,因此它在DNA损伤修复和细胞凋亡中发挥重要作用。从蛋白水平的实验结果推测,他汀药物处理HT29细胞后可能导致细胞凋亡和细胞周期阻滞的发生。提示他汀药物可能通过恢复p53的部分或全部功能而发挥抗肿瘤作用。最新研究发现,他汀药物可通过作用于突变p53发挥其抗癌功能。Di Agostino等〔12〕研究发现,他汀药物可破坏突变p53/YAP/NF-Y在细胞核中形成的复合体,使YAP释放到细胞质中,减少Cyclin A、Cyclin B和CDK1的蛋白表达水平,抑制含突变p53肿瘤细胞的生长。Parrales等〔13〕通过高通量筛选证实他汀药物可特异性抑制表达突变p53的肿瘤细胞的生长,他汀通过抑制甲羟戊酸-5-焦磷
酸的合成,削弱突变p53和HSP40的相互作用,诱导突变p53通过CHIP介导的泛素化途径降解而发挥其抗肿瘤作用。
总之,本实验采用p53突变的HT29细胞初步观察到美伐他汀和辛伐他汀可抑制细胞的增殖。在此基础上,采用不同浓度的药物处理,发现p53下游相关蛋白PUMA、p21的表达增强,凋亡相关蛋白PARP发生切割。提示他汀药物抑制HT29细胞增殖的作用机制是通过恢复p53对下游蛋白的调控功能进而诱导细胞发生凋亡,从而发挥抗肿瘤活性。
1 Vijayakumaran R,Tan KH,Miranda PJ,etal.Regulation of mutant p53 protein expression〔J〕.Front Oncol,2015;5:284.
2 Muller PA,Vousden KH.Mutant p53 in cancer:new functions and therapeutic opportunities〔J〕.Cancer Cell,2014;25(3):304-17.
3 Lambert JM,Moshfegh A,Hainaut P,etal.Mutant p53 reactivation by PRIMA-1 MET induces multiple signaling pathways converging on apoptosis〔J〕.Oncogene,2010;29(9):1329-38.
4 Zhang S,Zhou L,Hong B,etal.Small-molecule NSC59984 restores p53 pathway signaling and antitumor effects against colorectal cancer via p73 activation and degradation of mutant p53〔J〕.Cancer Res,2015;75(18):3842-52.
5 Stryjkowska-Gora A,Karczmarek-Borowska B,Gora T,etal.Statins and cancers〔J〕.Contemp Oncol (Pozn),2015;19(3):167-75.
6 Matusewicz L,Meissner J,Toporkiewicz M,etal.The effect of statins on cancer cells〔J〕.Tumour Biol,2015;36(7):4889-904.
7 Petitjean A,Mathe E,Kato S,etal.Impact of mutant p53 functional properties on TP53 mutation patterns and tumor phenotype:lessons from recent developments in the IARC TP53 database〔J〕.Hum Mutat,2007;28(6):622-9.
8 Muller PA,Vousden KH.p53 mutations in cancer〔J〕.Nat Cell Biol,2013;15(1):2-8.
9 Parrales A,Iwakuma T.Targeting oncogenic mutant p53 for cancer therapy〔J〕.Front Oncol,2015;5:288.
10 Murtola TJ,Tammela TL,Lahtela J,etal.Cholesterol-lowering drugs and prostate cancer risk:a population-based case-control study〔J〕.Cancer Epidemiol Biomarkers Prev,2007;16(11):2226-32.
11 Lakha F,Theodoratou E,Farrington SM,etal.Statin use and association with colorectal cancer survival and risk:case control study with prescription data linkage〔J〕.BMC Cancer,2012;12:487.
12 Di Agostino S,Sorrentino G,Ingallina E,etal.YAP enhances the pro-proliferative transcriptional activity of mutant p53 proteins〔J〕.EMBO Rep,2016;17(2):188-201.
13 Parrales A,Ranjan A,Iyer SV,etal.DNAJA1 controls the fate of misfolded mutant p53 through the mevalonate pathway〔J〕.Nat Cell Biol,2016;18(11):1233-43.
〔2016-11-28修回〕
(编辑 曲 莉)
The effect and mechanism of statins on p53 mutant tumor cells
MOU Han-Chuan,YANG Zhi-Kuan,BAO Ya-Feng,etal.
Lab of Molecular Genetics of Aging and Tumor,Faculty of Medicine,Kunming University of Science and Technology,Kunming,650500,Yunnan,China
Objective To explore the effect of statins on p53 mutant tumor cells and the underlying molecular mechanism.Methods The human mutant p53 colon cancer cells HT29(p53 mutant)were in vitro cultured. Cell proliferation was tested by MTT method. The expression of molecular chaperones HSP90,p53 target genes PUMA and p21,apoptosis-related protein PARP were measured by Western blot.Results Statins significantly inhibited the proliferation of HT29 cells,treatment with mevastatin exhibited an IC50 value of (39.95±3.81)μmol/L,the simvastatin exhibited an IC50 value of (24.99±0.70) μmol/L.Compared with those of control group,the protein expressions of mutant p53 and HSP90 were not affected,but statins significantly upregulated the protein expressions of PUMA,p21,and PARP.Conclusions Statins could inhibit the growth of HT29 cells,upregulation of p53 target genes PUMA and p21,but had no effect on the expression of mutant p53,demonstrates that it is possible to restore p53 responses in p53 mutant cells.
Statin;Mutant p53;Apoptosis
国家自然科学基金(81560601);云南省自然科学基金项目(2014FD011)
张继虹(1972-),女,教授,硕士生导师,主要从事分子药理学及抗肿瘤药物机制研究。 刘 静(1987-),女,讲师,硕士生导师,主要从事肿瘤药理学和靶向抗肿瘤药物机制研究。
牟汉川(1992-),男,硕士,主要从事肿瘤药理学研究。
R73
A
1005-9202(2017)04-0788-03;
10.3969/j.issn.1005-9202.2017.04.004
