云雾山草原不同深度土壤的呼吸特征及其对温度变化的响应
2017-03-23叶成龙胡水金
张 浩,叶成龙,王 益,郭 辉,胡水金
(1.生态系统生态学实验室 南京农业大学资源与环境科学学院,江苏 南京 210095;2.黄土与第四纪地质国家重点实验室 中国科学院地球环境研究所,陕西 西安 710061)
云雾山草原不同深度土壤的呼吸特征及其对温度变化的响应
张 浩1,叶成龙1,王 益2,郭 辉1,胡水金1
(1.生态系统生态学实验室 南京农业大学资源与环境科学学院,江苏 南京 210095;2.黄土与第四纪地质国家重点实验室 中国科学院地球环境研究所,陕西 西安 710061)
土壤呼吸及其对温度的敏感性是预测碳循环过程的重要参数,近年来受到了广泛关注。但在黄土高原地区,不同深度土壤微生物呼吸特征及其对温度变化响应的相关研究尚未见报道。本研究选取黄土高原云雾山草原自然保护区围封30年的典型草地作为研究地点,采集了不同深度的土壤样品(0-10、10-20、20-30、30-40、40-50、50-60 cm),在室内25和35 ℃条件下对土壤样品进行培养,探讨不同深度土层的土壤呼吸及其对温度敏感性的变化。结果表明,土壤有机碳、全氮、有效氮、速效磷,全磷及微生物生物量碳氮含量均随土层深度的增加而显著降低(P<0.05)。随着培养时间和土层深度的增加,两个温度培养下的土壤呼吸速率和土壤呼吸累积碳释放量均显著下降(P<0.05)。然而,随着土层深度增加,土壤呼吸温度敏感性呈上升趋势。冗余分析表明,土壤呼吸速率与土壤性质均有较好的正相关,而土壤呼吸温度敏感性与各土壤因子呈负相关。
黄土高原;深层土壤;微生物呼吸;温度敏感性
土壤是陆地生态系统最大的碳库,其储存的碳总量取决于土壤呼吸碳输出和植物光合作用碳输入的平衡,并且这两个过程均受温度的显著调节[1]。土壤呼吸以CO2的形式每年释放大约600亿t碳到大气中[2],其微小的增加就会导致大气CO2浓度显著上升,进而导致全球变暖[3-5]。在碳循环预测模型中,土壤呼吸及其对温度升高的敏感性是其中两个重要的参数,近年来受到广泛关注[6-7]。许多研究表明,不同生态系统土壤呼吸对温度的响应存在显著差异[6,8],导致这些差异的原因主要是受微生物群落[7,9]、分解底物的碳组分[6,10]和环境因子[11-12]等因素的影响。
我国黄土高原半干旱区是世界上最大的黄土集中分布区,总面积62.38万km2,土层平均厚度为50~100 m,是全球陆地生态系统的重要组成部分[13-14]。黄土高原的土壤是通过黄土风成堆积作用形成的,因此,该地区的土质疏松且抗侵蚀能力很弱[14]。同时,该地区不合理的土地利用和植被破坏造成严重的水土流失[15],改变了土壤透气性并造成深层土壤的外露[16]。由于黄土高原生态系统的脆弱性,该地区对全球气候变化十分敏感,相应的土壤碳收支平衡也随之改变[14,17]。然而,当前对于黄土高原地区不同土层深度的土壤呼吸速率及其对不同温度的响应研究还较少。
本研究选取宁夏固原云雾山国家自然保护区中围封30年的典型草地作为试验地区。由于长期封育保护,该地区的土壤土层几乎不受人为干扰,是研究不同深度土壤呼吸速率对温度变化响应的理想区域。本研究通过室内培养试验,测定不同深度的土壤呼吸强度及其对温度变化的敏感性,探讨影响土壤呼吸温度敏感性的潜在因素,以期为研究黄土高原生态系统碳循环过程与机理提供基础数据。
1 材料与方法
1.1 试验区概况
试验站位于宁夏固原东北部的黄土高原云雾山国家自然保护区(106°24′-106°28′ E,36°13′-36°19′ N),总面积4 000 hm2,属典型的暖温带干旱半干旱季风气候,海拔 1 800~2 100 m,雨量少而集中,年平均降水量为411.5 mm,60%的降水集中于7-9月。年均气温6~7 ℃,其中最热的7月可达22 ℃,最冷的1月可达-14 ℃。土壤为黄土母质上发育的淡黑垆土和黄绵土。该保护区建立于1982年,是黄土高原唯一草地类自然保护区,主要植物群落为长芒草(Stipabungeana)和大针茅(S.grandis)。
1.2 样地设置及样品采集
于2015年6月在该自然保护区封育30年的典型样地采集土样,样地大小为120 m×90 m,在样地内按照对角线等距划分5个采样点,每个样点用直径为5 cm的土钻取4钻土壤样品混合为一个样本,每个样点均分层采集0-10、10-20、20-30、30-40、40-50和50-60 cm的土壤,样品用塑料袋密封后立即带回实验室。土壤样品过2 mm筛子并去除植物残体及砂石等杂物之后,将一部分土样置于4 ℃冰箱冷藏用于室内培养试验,另一部分用于土壤基本性质的测定。
1.3 土壤基本性质的测定
土壤理化指标测定均按常规方法[18]进行,其中土壤pH采用酸度计测定(水土比2.5︰1);土壤有机碳(soil organic C,SOC)和全氮(total N,TN)采用元素分析仪(Elementar vario MACRO cube,Germany)测定;土壤全磷(total P,TP)采用高氯酸-浓硫酸消煮-钼锑抗比色法;速效磷(available P,AP)采用碳酸氢钠浸提-钼锑抗比色法;土壤有效氮(available N,AN)采用氯化钾溶液浸提-流动分析仪测定法。土壤微生物生物量碳、氮(microbial biomass C and N,MBC and MBN)采用氯仿熏蒸浸提法[19-20]。
1.4 土壤培养试验
分别称取每个土层25 g(干土重)新鲜土放入到500 mL培养瓶中,土壤含水量调为60%田间持水量,每个土层设置4个重复,分别置于25和35 ℃下的黑暗恒温培养箱中进行培养,并设置空白对照。每周至少调节含水量一次,以保证土壤含水量恒定,同时进行土壤通气,保持培养瓶中氧气充足。
1.5 土壤呼吸速率及温度敏感性的测定
在培养的第1、8、15、22、31、45、60、75和90 天进行土壤呼吸速率的测定。测定方法采用改进的碱液吸收法[21],即在培养瓶中放入含有5.0 mL NaOH溶液(0.25 mol·L-1)的小烧杯,密封培养12 h后,加入2 mL BaCl2溶液(1 mol·L-1)并用0.05 mol·L-1的HCl溶液滴定以确定CO2的释放量。
采用Q10值来表示土壤呼吸速率对温度变化的敏感程度,计算公式如下[7]:
其中,T2和T1分别表示培养温度为35和25 ℃,RT2和RT1分别表示35和25 ℃的土壤呼吸速率。
1.6 数据分析处理
不同土壤深度之间的土壤基本性质、土壤呼吸积累量的差异采用单因素方差分析(one-way ANOVA),并用LSD法进行差异显著性检验(P<0.05)。不同培养时间和土层之间的土壤呼吸速率及呼吸温度敏感性差异采用双因素方差分析(two-way ANOVA)。土壤呼吸速率和呼吸温度敏感性与土壤因子之间的关系采用冗余分析(redundary analysis,RDA)。在RDA排序图中,各土层深度之间的线段长度代表土层深度之间的欧几里德距离,长度越长代表二者之间的差异越大,反之越小;土壤环境因子矢量箭头的长短代表土壤环境因子对土壤呼吸及其温度敏感性影响程度的大小,矢量箭头越长代表影响越大。数据的方差分析采用SPSS 16.0软件,RDA分析采用CANOCO 4.5软件。
2 结果
2.1 不同深度土壤基本性质
随着土层深度的增加,土壤有机碳、全氮、速效磷和全磷含量均显著降低(P<0.05),而土壤pH呈相反趋势,随着土层深度的增加而显著上升(表1)。土壤可利用碳、氮和微生物生物量碳、氮在各土层之间变化更为明显,均表现出随着土层深度的增加,其含量显著降低(P<0.05)(图1)。
2.2 不同深度土壤呼吸速率及碳释放量
随着土层深度的增加,25和35 ℃培养下的土壤呼吸速率均显著下降(P<0.05)(图2)。同时,随着培养时间的增加,两个培养温度下各个土层的土壤呼吸速率也均显著下降(P<0.05)。两个培养温度下0-10和10-20 cm的土壤呼吸累积碳释放量均显著高于其它4个土层(P<0.05),而20-30、30-40、40-50和50-60 cm土层之间累积碳释放量无显著差异(P>0.05)(图2)。
2.3 不同深度土壤呼吸温度敏感性(Q10)
土层深度和培养时间均显著影响Q10(P<0.05),随着培养时间的增加,各土层的Q10逐渐下降(图3)。通过把各个土层的Q10取平均值可知,随着土层深度增加,Q10呈先上升后下降趋势,且10-20和20-30 cm土层的Q10显著高于0-10 cm土层(P<0.05)(图3)。
2.4 土壤呼吸速率和Q10与土壤因子相关性分析
RDA排序图的典型轴1和轴2共同解释了土壤呼吸速率及温度敏感性和土壤因子总体变异的98.7%(图4)。不同土层深度的土壤性质差异明显,0-10 cm土层的土壤呼吸速率和Q10与其它土层表现出明显的差异。同时,从RDA排序图还可以看出,土壤呼吸速率与土壤基本性质均有较好的正相关,而Q10与各土壤因子呈负相关。
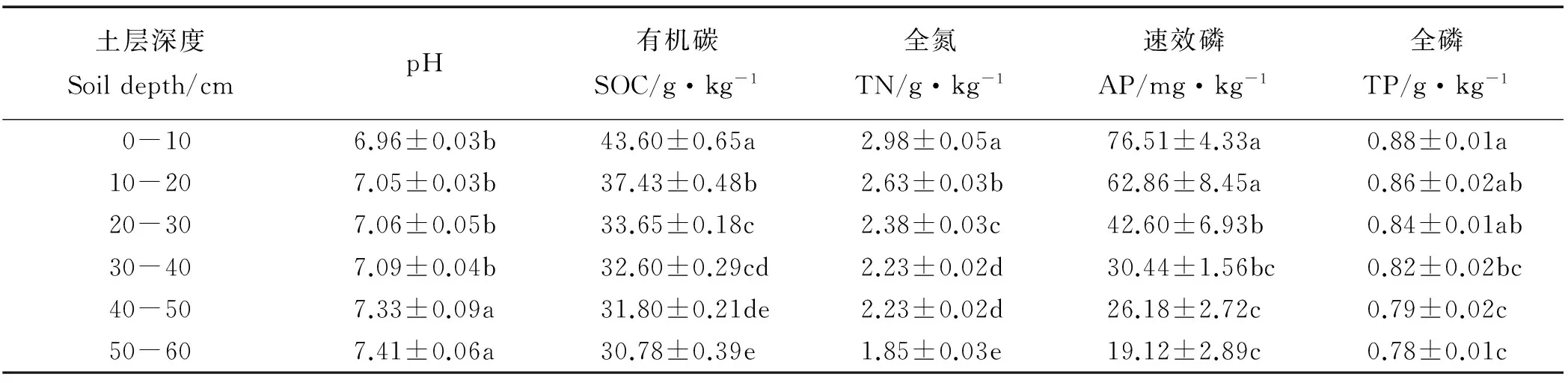
表1 不同土层的土壤基本性质
注:同列不同小写字母表示各土层间差异显著(P<0.05)。
Note: Different lower case letters within the same column indicate significant differences among different soil depths at the 0.05 level.
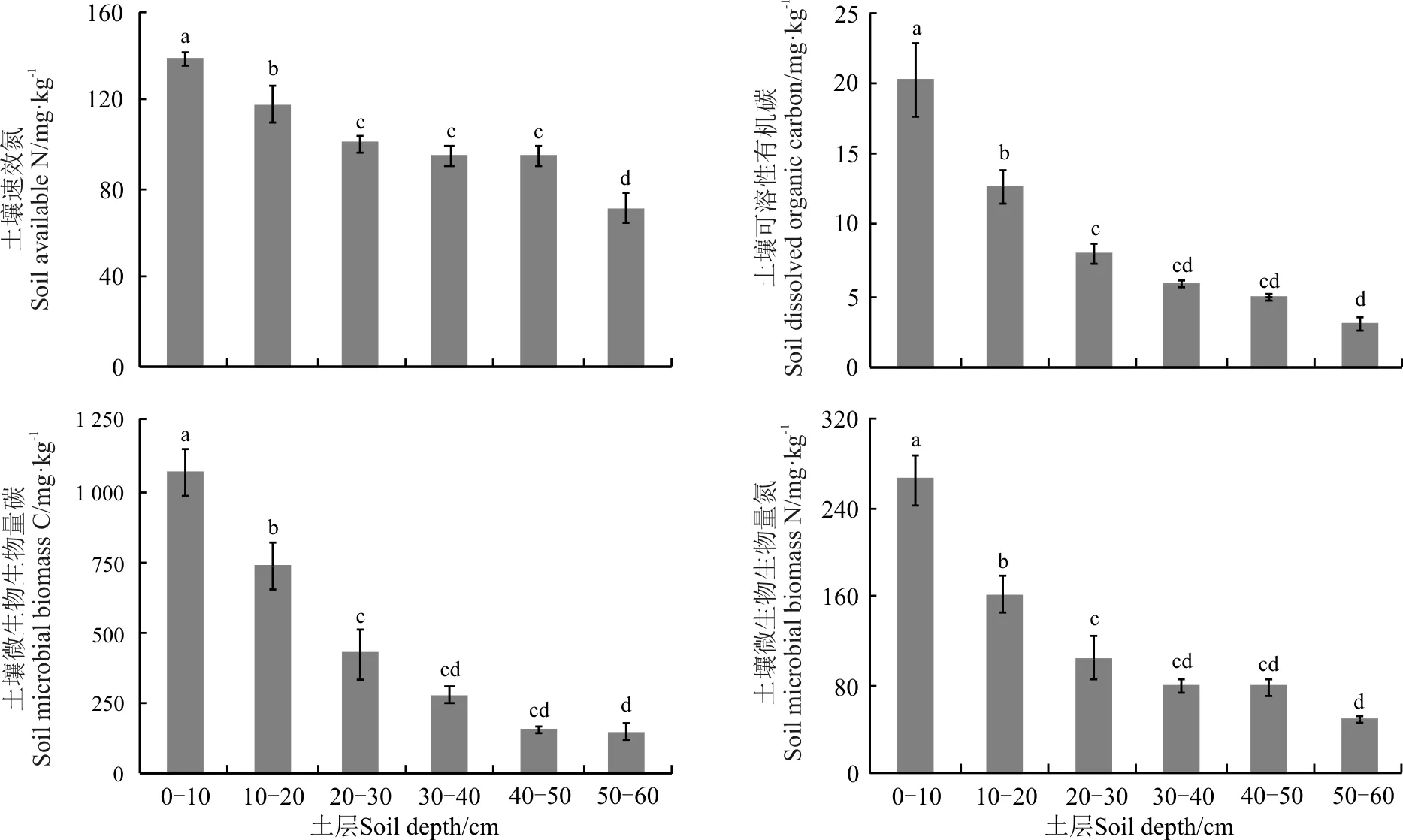
图1 不同土壤深度对土壤速效氮、可溶性有机碳、微生物生物量碳和微生物生物量氮的影响
注:不同小写字母表示不同土层间差异显著(P<0.05)。下同。
Note: Different lower case letters indicate significant difference among different soil depths at the 0.05 level, similarly for the following figures.
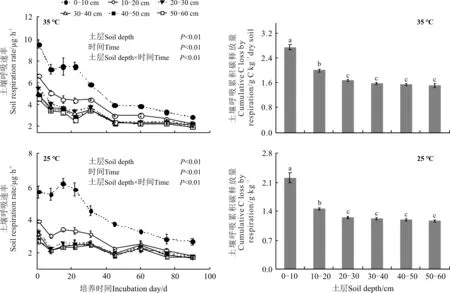
图2 不同土层深度对土壤呼吸速率和土壤呼吸累积碳释放量的影响
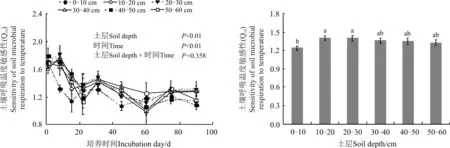
图3 不同土层深度对土壤呼吸温度敏感性的影响
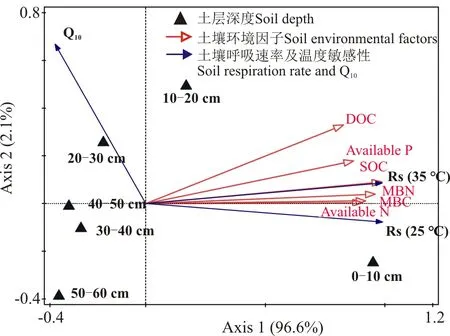
图4 土壤呼吸及其温度敏感性与土壤因子之间相关性的冗余分析排序图
注:DOC,可溶性有机碳;SOC,土壤有机碳;Available P,有效磷;Available N,有效氮;MBC,微生物生物量碳;MBN,微生物生物量氮;Q10,土壤呼吸温度敏感性;Rs,土壤呼吸速率。
Note: DOC, dissolved organic carbon; SOC, soil organic carbon; Available P, available phosphorus; Available N, available nitrogen; MBC, microbial biomass carbon; MBN, microbial biomass nitrogen; Q10, temperature sensitivity of soil respiration; Rs, soil respiration.
3 讨论
3.1 不同深度土层的土壤呼吸速率
本研究中,土壤呼吸释放的CO2主要来源于土壤微生物对有机碳的分解作用,随着土层深度增加,土壤碳含量和微生物生物量显著降低,土壤呼吸速率也相应的显著降低。Fang等[10]也发现底层土壤的呼吸速率显著低于表层土壤。范利超等[22]在茶园和林地也得出,随着土层深度增加,土壤呼吸速率显著降低,且其通过相关分析发现,土壤呼吸速率与土壤有机碳、可溶性有机碳和微生物生物量碳呈显著正相关关系。黄土高原草地生态系统的土壤碳输入主要来源于植物的凋落物和根系,表层土壤更容易接受植物新固定碳的补充,含有较高比例的易分解碳,所以表现出较快的微生物分解速率[23]。下层土壤的新碳输入较少,大部分的碳来源于土壤形成的尘粒沉积过程,可被微生物直接利用的碳很少,所以底层土壤碳的分解速率很低。同时,RDA排序图表明,土壤呼吸速率与土壤可利用碳、有机碳及微生物生物量碳、氮均呈正相关关系,表明土壤有机碳含量及微生物的活性是影响土壤微生物呼吸速率的重要因子[24-25]。随着培养时间的增加,上层土壤呼吸速率迅速下降,在后期降低的速率趋缓,可能是由于表层土的易分解有机碳含量随着培养时间迅速减少引起。而下层矿质土层的土壤呼吸速率在开始的时候就处于较低的水平,且下降的程度较上层的更慢,间接说明下层土壤中可利用碳的含量较少,限制了微生物的分解作用[26]。本研究中,35 ℃培养条件下各土层土壤释放的CO2量高于25 ℃培养条件,说明温度升高刺激了土壤微生物的活性,加快了土壤碳的释放。
3.2 不同土层深度的土壤呼吸温度敏感性(Q10)
土壤呼吸的温度敏感性在一定程度上决定着气候变化与碳循环之间的反馈关系,但是到目前为止,有关土壤呼吸温度敏感性的研究仍存在许多不确定性。本研究发现,随着黄土高原土层加深,土壤呼吸的Q10变大,Fierer等[27]在山谷土壤和Karhu等[28]在北寒带森林土壤同样得出,随着土壤深度的增加,Q10增加。RDA排序图表明,Q10与土壤有机碳及可利用碳均呈负相关关系,这说明土壤碳含量不是促使Q10增加的因素。依据酶动力学假说,低质量的底物(难分解的有机碳)分解需要较高的活化能,因此,其分解的温度敏感性要高于高质量的底物(易分解的有机碳)[6,29-31]。Wagai等[32]通过试验发现Q10与难分解的芳香族碳含量显著正相关,进一步证实了Q10主要受到底物质量的控制。一般而言,表层土壤更容易接受植物新固定碳的补充,含有较高比例的易分解碳,而深层土壤的土壤有机碳大部分多为较难分解的组分。因此,可以推断,深层土壤Q10高于表层土壤的原因很可能是受到底物质量的控制。土壤微生物活性和群落结构也是影响土壤呼吸敏感性的因素之一,虽然本研究表明,随着土层深度增加,土壤微生物量显著降低,但是深层土壤的微生物群落结构可能与表层土存在差异,且在温度升高的情况下,深层土壤微生物分解活性可能会迅速提高,引起有机碳的分解速率高于表层土,从而使深层土壤的Q10值高于表层土壤[7,33]。
综上可知,虽然表层土壤的呼吸速率和碳释放累积量高于底层土壤,但是底层土壤的土壤呼吸温度敏感性高于表层土壤,这预示着未来全球气候变暖会加速刺激该地区深层土壤有机碳的分解。因此,本研究结果对于探究黄土高原土壤有机碳对全球变暖的响应方面具有一定的理论价值。
References:
[1] Jenkison D S,Adams D E,Wild A.Model estimates of CO2emissions from soil in response to global warming.Nature,1991,351:304-306.
[2] Shao P,Zeng X B,Moore D J,Zeng X D.Soil microbial respiration from observations and earth system models.Environmental Research Letters,2013,8(3):034034.
[3] Schimel D S.Terrestrial ecosystems and the carbon cycle.Global Change Biology,1995,1(1):77-91.
[4] Melillo J M,Steudler P A,Aber J D,Newkirk K,Lux H,Bowles F P,Catricala C,Magill A,Ahrens T,Morrisseau S.Soil warming and carbon-cycle feedbacks to the climate system.Science,2002,298:2173-2176.
[5] Powlson D.Will soil amplify climate change? Nature,2005,433:204-205.
[6] Davidson E A,Janssens I A.Temperature sensitivity of soil carbon decomposition and feedbacks to climate change.Nature,2006,440:165-173.
[7] Karhu K,Auffret M D,Dungait J,Hopkins D W,Prosser J I,Singh B K,Subke J A,Wookey P A,Agren G I,Sebastia M T,Gouriveau F,Bergkvist G,Meir P,Nottingham A T,Salinas N,Hartley I P.Temperature sensitivity of soil respiration rates enhanced by microbial community response.Nature,2014,513:81-84.
[8] Lloyd J,Taylor J A.On the temperature dependence of soil respiration.Functional Ecology,1994,8(3):315-323.
[9] Zhou J Z,Xue K,Xie J P,Deng Y,Wu L Y,Cheng X L,Fei S F,Deng S P,He Z L,Nostrand J D,Luo Y Q.Microbial mediation of carbon-cycle feedbacks to climate warming.Nature Climate Change,2012,2(2):106-110.
[10] Fang C M,Smith P,Moncrieff J B,Smith J U.Similar response of labile and resistant soil organic matter pools to changes in temperature.Nature,2005,433:57-59.
[11] Luo Y Q,Wan S Q,Hui D F,Wallace L L.Acclimatization of soil respiration to warming in a tall grass prairie.Nature,2001,413:622-625.
[12] Reichstein M,Subke J A,Angeli A C,Tenhunen J D.Does the temperature sensitivity of decomposition of soil organic matter depend upon water content,soil horizon,or incubation time? Global Change Biology,2005,11(10):1754-1767.
[13] 高阳,程积民,刘伟.黄土高原地区不同类型天然草地群落学特征.草业科学,2011,28(6):1066-1069. Gao Y,Cheng J M,Liu W.Community characteristics of different types of grassland in the Loess Plateau.Pratacultural Science,2011,28(6):1066-1069.(in Chinese)
[14] 袁晓波,尚振艳,牛得草,傅华.黄土高原生态退化与恢复.草业科学,2015,32(3):363-371. Yuan X B,Shang Z Y,Niu D C,Fu H.Advances in ecological degeneration and restoration of Loess.Plateau Pratacultural Science,2015,32(3):363-371.(in Chinese)
[15] Wang D,Liu Y,Shang Z H,Tian F P,Wu G L,Chang X F,David W.Effects of grassland conversion from cropland on soil respiration on the semi-arid Loess Plateau,China.CLEAN-Soil,Air,Water,2015,43(7):1052-1057.
[16] 齐丽彬,樊军,邵明安,王万忠.黄土高原水蚀风蚀交错带不同土地利用类型土壤呼吸季节变化及其环境驱动.生态学报,2008,28(11):5428-5436. Qi L B,Fan J,Shao M A,Wang W Z.Seasonal changes in soil respiration under different land use patterns in the water wind erosion crisscross region of the Loess Plateau.Ecologica Sinica,2008,28(11):5428-5436.(in Chinese)
[17] 李旭东,沈晓坤,张春平,傅华.黄土高原农田土壤呼吸特征及其影响因素.草业学报,2014,23(5):24-30. Li X D,Shen X K,Zhang C P,Fu H.Factors influencing soil respiration in a field in the Loess Plateau.Acta Prataculturae Sinica,2014,23(5):24-30.(in Chinese)
[18] 鲁如坤.土壤农业化学常规分析方法.北京:科学出版社,2000. Lu R K.Methods of soil agricultural chemical analysis.Beijing:Science Press,2000.(in Chinese)
[19] Vance E D,Brookes P C,Jenkinson D S.An extraction method for measuring soil microbial biomass C.Soil Biology and Biochemistry,1987,19(6):703-707.
[20] Brookes P C,Landman A,Pruden G,Jenkinson D S.Chloroform fumigation and the release of soil nitrogen:A rapid direct extraction method to measure microbial biomass nitrogen in soil.Soil Biology and Biochemistry,1985,17(6):837-842.
[21] Bekku Y,Koizumi H,Oikaw T,Iwaki H.Examination of four methods for measuring soil respiration.Applied Soil Ecology,1997,5(3):247-254.
[22] 范利超,韩文炎,李鑫,李治鑫.茶园与相邻林地土壤有机碳及基础呼吸的垂直分布特征.农业环境科学学报,2015,34:1149-1157. Fan L C,Han W Y,Li X,Li Z X.Vertical distribution of soil organic carbon and soil basal respiration in tea soil and adjacent woodland.Journal of Agro-Environment Science,2015,34:1149-1157.(in Chinese)
[23] 李建平,谢应忠.封育对黄土高原天然草地深层土壤碳、氮储量的影响.草业科学,2016,33(10):1981-1988. Li J P,Xie Y Z.Effects of natural grassland enclosure on carbon and nitrogen storage in deep soil in the Loess Plateau of China.Pratacultural Science,2016,33(10):1981-1988.(in Chinese)
[24] Chen S T,Huang Y,Zou J W,Shen Q R,Hu Z H,Qin Y M,Chen H S,Pan G X.Modeling interannual variability of global soil respiration from climate and soil properties.Agricultural and Forest Meteorology,2010,150(4):590-605.
[25] Fontaine S,Barot S.Size and functional diversity of microbe populations control plant persistence and long-term soil carbon accumulation.Ecology Letters,2005,8(10):1075-1087.
[26] Lovell R D,Jarvis S C.Soil microbial biomass and activity in soil from different grassland management treatments stored under controlled conditions.Soil Biology and Biochemistry,1998,30(14):2077-2085.
[27] Fierer N,Allen A S,Schimel J P,Holden P A.Controls on microbial CO2production:A comparison of surface and subsurface soil horizons.Global Change Biology,2003,9(9):1322-1332.
[28] Karhu K,Fritze H,Tuomi M.Temperature sensitivity of organic matter decomposition in two boreal forest soil profiles.Soil Biology and Biochemistry,2010,42(1):72-82.
[29] Conant R T,Ryan M G,Agren G I,Birge H E,Davidson E A,Eliasson P E,Evans S E,Frey S D,Giardina C P,Hopkins F M,Hyvonen R,Kirschbaum M,Lavallee J M,Leifeld J,Parton W J,Steinweg J M,Wallenstein M D,Wetterstedt J A,Bradford M A.Temperature and soil organic matter decomposition rates——Synthesis of current knowledge and a way forward.Global Change Biology,2011,17(11):3392-3404.
[30] Hartley I P,Ineson P.Substrate quality and the temperature sensitivity of soil organic matter decomposition.Soil Biology and Biochemistry,2008,40(7):1567-1574.
[31] Conant R T,Drijber R A,Haddix M L,Parton W J,Paul E A,Plante A F,Six J,Steinweg J M.Sensitivity of organic matter decomposition to warming varies with its quality.Global Change Biology,2008,14(4):1-10.
[32] Wagai R,Kishimoto-Mo A W,Yonemura S,Shirato Y,Hiradate S,Yagasaki Y.Linking temperature sensitivity of soil organic matter decomposition to its molecular structure,accessibility,and microbial physiology.Global Change Biology,2013,19(4):1114-1125.
[33] 杨庆朋,徐明,刘洪升,王劲松,刘丽香,迟永刚,郑云普.土壤呼吸温度敏感性的影响因素和不确定性.生态学报,2011,31(8):2301-2311. Yang Q P,Xu M,Liu H S,Wang J S,Liu L X,Chi Y G,Zheng Y P.Impact factors and uncertainties of the temperature sensitivity of soil respiration.Ecologica Sinica,2011,31(8):2301-2311.(in Chinese)
(责任编辑 武艳培)
Characteristics of soil microbial respiration and its response to temperature change in different soil depths in Yunwu Mountain grassland
Zhang Hao1, Ye Cheng-long1, Wang Yi2, Guo Hui1, Hu Shui-jin1
(1.Laboratory of Ecosystem Ecology, College of Resources and Environmental Science,Nanjing Agricultural University, Nanjing 210095, China; 2.State Key Laboratory of Loess and Quaternary, Institute of Earth Environment, Chinese Academy of Sciences, Xi’an 710061, China)
Soil respiration and its temperature sensitivity are two important parameters to predict carbon cycling. In the Loess Plateau region, however, soil microbial respiration and its temperature sensitivity at different soil depths have not been investigated. This study focused on the characteristics of soil microbial respiration and temperature sensitivity at different soil depths, by taking advantage of a typical grassland in the Yunwu Mountain Natural Conservation area of the Loess Plateau, which has been fenced for 30 years. In this study, soils were sampled from different soil layers (0-10, 10-20, 20-30, 30-40, 40-50, and 50-60 cm) and incubated at 25 ℃ or 35 ℃, and the changes of soil respiration were examined. We found that soil organic carbon, total nitrogen, available nitrogen, available phosphorus, total phosphorus, microbial biomass carbon, and microbial nitrogen contents decreased significantly with increasing soil depth (P<0.05). In addition, soil respiration rate and cumulative C loss by respiration at both temperatures significantly decreased with increasing incubation period and soil depth (P<0.05). However, temperature sensitivity showed an increasing trend with increasing soil depth. Redundancy analysis showed that soil respiration rate was positively correlated with soil properties, while temperature sensitivity of soil respiration was negatively correlated with all soil factors.
the Loess Plateau; deep soil; microbial respiration; temperature sensitivity
Guo Hui E-mail:hui.guo@njau.edu.cn
S154.2
A
1001-0629(2017)2-0224-07
2016-05-23接受日期:2016-06-13
中央高校基本业务费重点项目(0306j0887);国家自然科学基金(41201259);中国科学院西部之光
张浩(1990-),男,山东烟台人,在读硕士生,研究方向为生态学。E-mail:2013103025@njau.edu.cn
郭辉(1981-),男,河南周口人,副教授,博士,研究方向为生态学。E-mail:hui.guo@njau.edu.cn
