60Co-γ辐射对桂花幼苗生长及生理指标的影响
2017-03-23耿兴敏杨秀莲王良桂
李 瑜,王 萍,耿兴敏,杨秀莲,李 娜,王良桂
(南京林业大学 风景园林学院,南京 210037)
60Co-γ辐射对桂花幼苗生长及生理指标的影响
李 瑜,王 萍,耿兴敏,杨秀莲,李 娜,王良桂
(南京林业大学 风景园林学院,南京 210037)
为了研究核辐射技术在桂花诱变育种上的应用,以60Co-γ射线辐照‘潢川金桂’与‘籽银桂’种子,测定不同剂量对2个桂花品种M1代的影响,确定桂花种子的适宜诱变剂量,为开展桂花诱变育种工作奠定理论基础。结果表明:随着辐射剂量的增加,幼苗出苗率、苗高、地径、干质量显著下降;叶绿素质量分数、可溶性蛋白质量分数减少;SOD活性及POD活性都呈先升后降的趋势,在50 Gy时达到峰值。60Co-γ射线对‘籽银桂’的影响程度大于‘潢川金桂’,表明‘籽银桂’的辐射敏感性大。通过对桂花种子出苗率的回归分析知:低剂量率60Co-γ射线辐照‘潢川金桂’的半致死剂量和临界致死剂量分别为135.94 Gy和170.12 Gy,‘籽银桂’半致死剂量与临界致死剂量分别为86.27 Gy和114.68 Gy。综合上述各指标,低剂量率条件下(2 Gy/min)‘潢川金桂’的种子以135~155 Gy的诱变剂量较适宜,而‘籽银桂’以80~100 Gy较适宜。
潢川金桂;籽银桂;60Co-γ射线;诱变育种
桂花(OsmanthusfragransLour.)为木犀科(Oleaceae)木犀属(Osmanthus)常绿灌木或乔木,是一种集绿化、香化、美化、观赏于一体的优良园林绿化树种,也是香精工业、食品工业、轻工业、药材工业等宝贵的原料[1]。因其花期正值中国传统中秋佳节,开花时数里飘香,有“独占三秋压群芳”之美誉。目前,有关桂花的研究主要集中在品种分类[2]、开花进程中生理生化变化[3]、光合作用[4]及抗逆性[5-6]等方面,鲜有桂花育种相关的研究。随着观赏园艺业的迅速发展,人们对植物的观赏要求日益提高。在桂花长期的栽培历史进程中,尽管经人类不断地选择和天然杂交丰富其品种类型,但变异性小,育种目标时间长、成本高、观赏性过于单一。
辐射诱变育种是利用γ射线等射线诱发植物基因和染色体畸变,突变率高,可引起植物形态结构和生理生化等多方面的变异,可在较短的时间内育出新品种[7]。1928年植物育种学家Stadler[8]证实X射线对玉米和大麦有诱变效应,揭开了植物诱变育种的新篇章。辐射剂量与植物的形态变化和生物学响应有密切的联系,低剂量(1~5 Gy)辐射促进种子的萌发及幼苗的生长,高剂量(50 Gy)有显著的抑制作用,且影响细胞的结构和代谢的变化,如:引发植物类囊体扩张,改变光合作用,调节抗氧化系统[9-11]。Breslavets(1946)证实,低剂量辐照能刺激种子的萌发、植物的生长和开花[12],此种现象被称为“毒物兴奋效应”[13]。
近年来辐射农作物、观赏花卉、果树类等,筛选出大量的优良品种,但关于木本植物辐射育种的报道仅见于观赏桃[14]、水蜡[15]、紫薇[16]、榆[17]等。而有关桂花辐射育种的研究极少。桂花花粉收集困难,生活力低,去雄、授粉操作精细,致使人工杂交育种十分困难,因此对桂花开展新方式的育种尤为重要。本试验以‘潢川金桂’和‘籽银桂’成熟种子为材料,开展不同剂量的60Co-γ射线辐射处理对桂花种子出苗率和幼苗生长及生理指标的研究,以确定适宜桂花辐射诱变的剂量范围,旨在为进一步开展桂花辐射育种奠定理论基础。
1 材料与方法
1.1 试验材料及处理
‘潢川金桂’和‘籽银桂’的成熟种子于2013年5月初采自南京林业大学校园。将采集的桂花种子送至江苏省农业科学院原子能农业利用研究所辐射,照射源为60Co-γ射线,剂量率2 Gy/min,辐照剂量为50、100、150、200、250 Gy,以未辐射种子为对照。将上述种子用质量分数为0.1%的赤霉素浸泡24 h[18],4 ℃低温沙藏5个月,沙藏过程中有种子萌发[18](胚根长度大于种子长度)现象,于10月初随机挑选萌发的桂花种子在温室中播种。每个处理的播种量为70粒,设置3个重复。并对播种苗进行常规管理。
1.2 形态指标及生理指标测定
出苗率:播种后,每周统计各处理的出苗情况,连续8周不再有出苗时终止。各处理以不再增加时的出苗率为最终出苗率。出苗率=(出苗数/播种数)×100%,出苗以子叶平展为标准。
苗高:用直尺测定播种1 a后的幼苗苗高。
地径:用千分尺测定播种1 a后的幼苗地径。
生物量:每处理随机选定3株,挖取整株植株,在根部剪断,将植株分为根、茎2部分,冲洗干净,再将植株置烘箱内105 ℃杀青15 min,然后于90 ℃恒温烘干至恒量,最终的质量即为干质量,地下部分与地上部分质量的比值即为根冠比。
叶绿素质量分数:待各处理幼苗长出6片以上真叶时,采用丙酮乙醇混合液的方法[19]测定。
SOD活力测定采用NBT光还原法[20]。POD活力测定采用愈创木酚比色法[20]。可溶性蛋白质量分数测定采用考马斯亮蓝法[19]。
1.3 数据处理
采用Excel 2003软件处理数据,SPSS 19.0软件进行方差分析及Duncan’s新复极差法进行显著性检验。
2 结果与分析
2.1 辐射对桂花种子出苗率的影响
出苗率是种子活力的直接表现,反映种子发芽并可正常破土生长的能力。不同辐射剂量处理桂花种子对其出苗率具有不同程度的影响。各处理的最终出苗率如图1所示,‘潢川金桂’出苗率随着辐射剂量的增加其总体趋势为先升后降,对照组出苗率为60.95%,各辐射处理中以100 Gy的出苗率最高,达到65.24%,较对照提高7.04%,250 Gy种子出苗率为0。低辐射剂量(50~100 Gy)与对照出苗率的差异不显著,高辐射剂量(150~250 Gy)与对照差异均显著。
‘籽银桂’随着辐射剂量的增加,其出苗率呈递减的趋势,对照的出苗率为80.00%,当辐照剂量为200 Gy时,种子几乎不出苗。各处理间的出苗率差异均显著。60Co-γ辐射对桂花种子有损伤作用,且随着辐射剂量的增加损伤加剧,‘籽银桂’出苗率的辐射敏感性大于‘潢川金桂’。

小写字母代表差异显著(P<0.05),下同。
Different lowercase letters in same row means significant differences (P<0.05),the same as below.
图1 ‘潢川金桂’与‘籽银桂’在不同辐射剂量下的出苗率
Fig.1 Eemergence rate of ‘Huangchuan Jingui’ and ‘Zi Yingui’ at different degrees of radiation
2.2 辐射对桂花幼苗生长的影响
2.2.1 苗 高 辐射处理后桂花的幼苗高度如表1所示,辐射处理对2种桂花的苗高生长均有显著的抑制作用,苗高随剂量的增大呈递减趋势。幼苗的生长对辐射很敏感,辐射剂量的大小明显影响生长速率,150 Gy以上剂量明显抑制幼苗的生长。‘潢川金桂’各处理与对照的差异均显著,分别比对照减少33.05%、38.14%、46.61%、55.60%,处理50 Gy、处理100 Gy、处理150 Gy之间差异不显著,处理200 Gy与处理150 Gy差异不显著。
‘籽银桂’各处理与对照的差异均显著,分别比对照减少30.18%、40.18%、54.11%,处理50 Gy与处理100 Gy之间差异不显著,但均与处理150 Gy差异显著。
2.2.2 地 径 统计各组桂花幼苗地径的结果见表1,辐射处理对桂花幼苗茎秆的粗细的影响较大,有显著的减小效应,各处理幼苗茎粗均显著低于对照。‘潢川金桂’各处理与对照的差异均显著,各处理间差异不显著,各处理分别比对照减少18.28%、27.24%、27.93%、31.38%。
‘籽银桂’各处理与对照的差异均显著,分别比对照减少18.79%、20.57%、36.52%。处理50 Gy与处理100 Gy之间差异不显著,但均与处理150 Gy差异显著。
2.2.3 干质量 如表1所示,2种桂花种子幼苗的干质量随辐射剂量的增加呈递减趋势,各处理均明显小于对照,幼苗的生长量受到抑制。‘潢川金桂’各处理与对照相比,干质量差异均显著,各处理干质量分别比对照减少45.87%、66.73%、79.27%、87.15%。
‘籽银桂’50、100 Gy处理与对照相比,干质量差异均显著,150 Gy处理与对照差异显著,各处理干质量分别比对照减少36.01%、38.73%、68.97%。
2.2.4 根冠比 植物根冠比的大小反映植物地下部分与地上部分的相关性。辐射处理后,‘潢川金桂’幼苗根冠比除100 Gy处理比对照小以外,其他处理均大于对照,但与对照间的差异均不显著。‘籽银桂’各处理的根冠比均大于对照,但与对照间的差异也不显著。说明辐射可以增大根冠比,但作用效果并不显著。
表1 不同剂量辐射后‘潢川金桂’与‘籽银桂’群体幼苗生长的形态指标(±s)Table 1 Morphological indicators of ‘Huangchuan Jingui’ and ‘Zi Yingui’ seedlings at different degrees of radiation
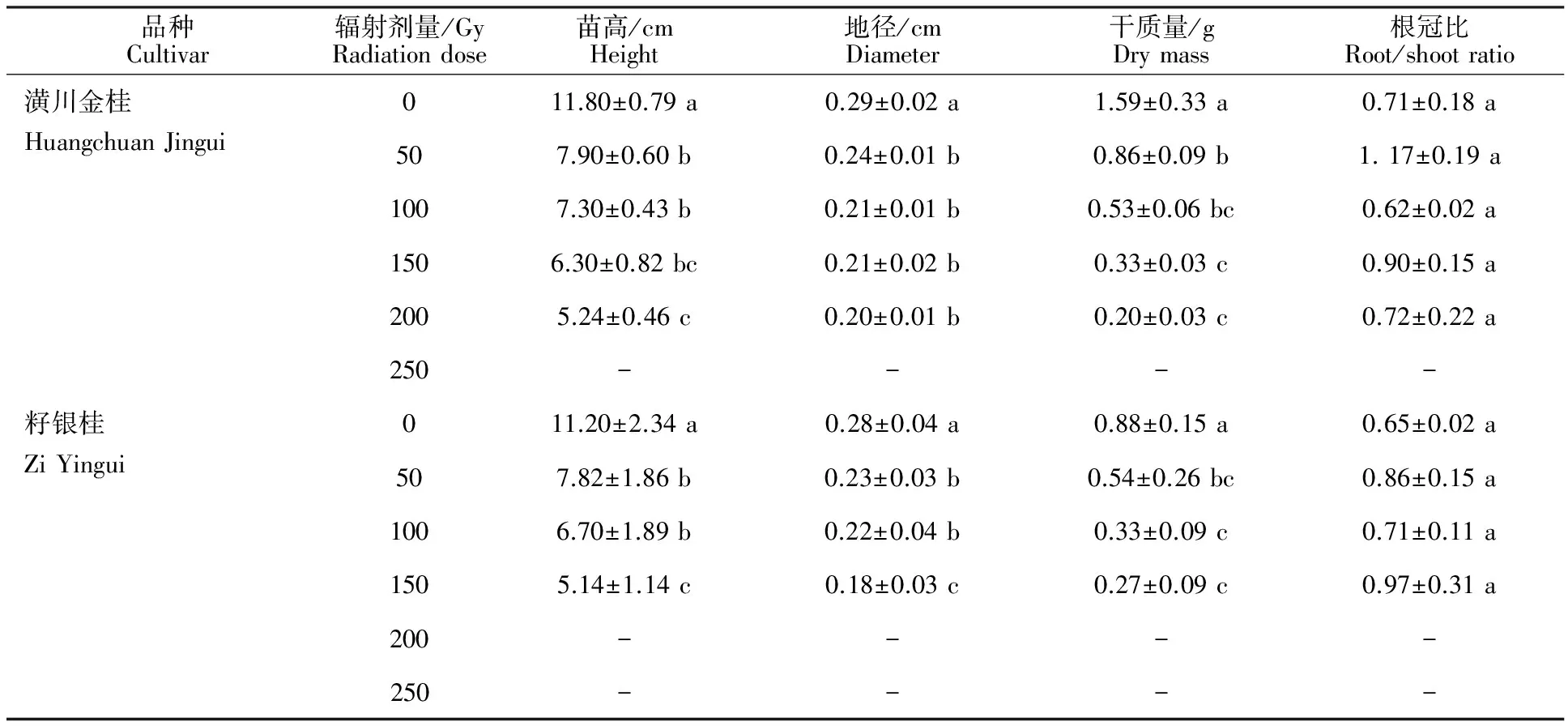
表1 不同剂量辐射后‘潢川金桂’与‘籽银桂’群体幼苗生长的形态指标(±s)Table 1 Morphological indicators of ‘Huangchuan Jingui’ and ‘Zi Yingui’ seedlings at different degrees of radiation
品种Cultivar辐射剂量/GyRadiationdose苗高/cmHeight地径/cmDiameter干质量/gDrymass根冠比Root/shootratio潢川金桂011.80±0.79a0.29±0.02a1.59±0.33a0.71±0.18aHuangchuanJingui507.90±0.60b0.24±0.01b0.86±0.09b1.17±0.19a1007.30±0.43b0.21±0.01b0.53±0.06bc0.62±0.02a1506.30±0.82bc0.21±0.02b0.33±0.03c0.90±0.15a2005.24±0.46c0.20±0.01b0.20±0.03c0.72±0.22a250----籽银桂011.20±2.34a0.28±0.04a0.88±0.15a0.65±0.02aZiYingui507.82±1.86b0.23±0.03b0.54±0.26bc0.86±0.15a1006.70±1.89b0.22±0.04b0.33±0.09c0.71±0.11a1505.14±1.14c0.18±0.03c0.27±0.09c0.97±0.31a200----250----
注:同列小写字母表示差异显著(P<0.05)。
Note:The different small letters mean significant difference(P<0.05).
2.3 辐射对叶片叶绿素质量分数的影响
叶绿素是衡量植物光合作用的一个重要指标,在一定范围内,光合速率随着叶绿素质量分数的增大而增大。辐照对叶绿素质量分数的影响如图2所示:相同剂量处理情况下,对2个品种苗期叶片叶绿素质量分数的影响程度类似。低剂量的辐射处理对桂花幼株叶片的叶绿素影响不大,2个品种桂花的叶绿素a、叶绿素b和叶绿素a+b 随着辐射剂量的增加均呈递减趋势。‘潢川金桂’的各处理间的叶绿素a、叶绿素b、叶绿素a+b均与对照差异显著,质量分数最少的处理(200 Gy)分别比对照减少43.00%、31.61%、39.91%。‘籽银桂’在50 Gy剂量处理下,叶绿素a、叶绿素b、叶绿素a+b均与对照差异均不显著,在100 Gy以上剂量处理下差异显著,最少的处理(150 Gy)分别比对照减少26.61%、23.51%、25.72%。叶绿素a/b随着辐射剂量的增加也呈现递减的趋势,但处理间的差异不显著。
2.4 辐射对叶片生理特征的影响
2.4.1 POD酶活性 在正常情况下,保护酶和一些抗氧化物质能消除细胞内的活性氧,降低细胞内活性氧,使植物免遭伤害。由图3可知,‘潢川金桂’与‘籽银桂’幼苗期叶内的POD酶活性都呈先升后降的趋势,在50 Gy剂量下POD酶活性最大,分别比对照增加83.07%和128.79%,随后快速下降,但各处理均大于对照。‘潢川金桂’在50~100 Gy处理下,POD活性与对照相比均差异显著,50 Gy处理与其他处理均差异显著;‘籽银桂’各处理与对照相比均差异显著,50 Gy处理与其他处理均差异显著。可以得出:低剂量辐射能显著增强POD酶活性,但随着辐射剂量的增大,POD酶活性显著下降。
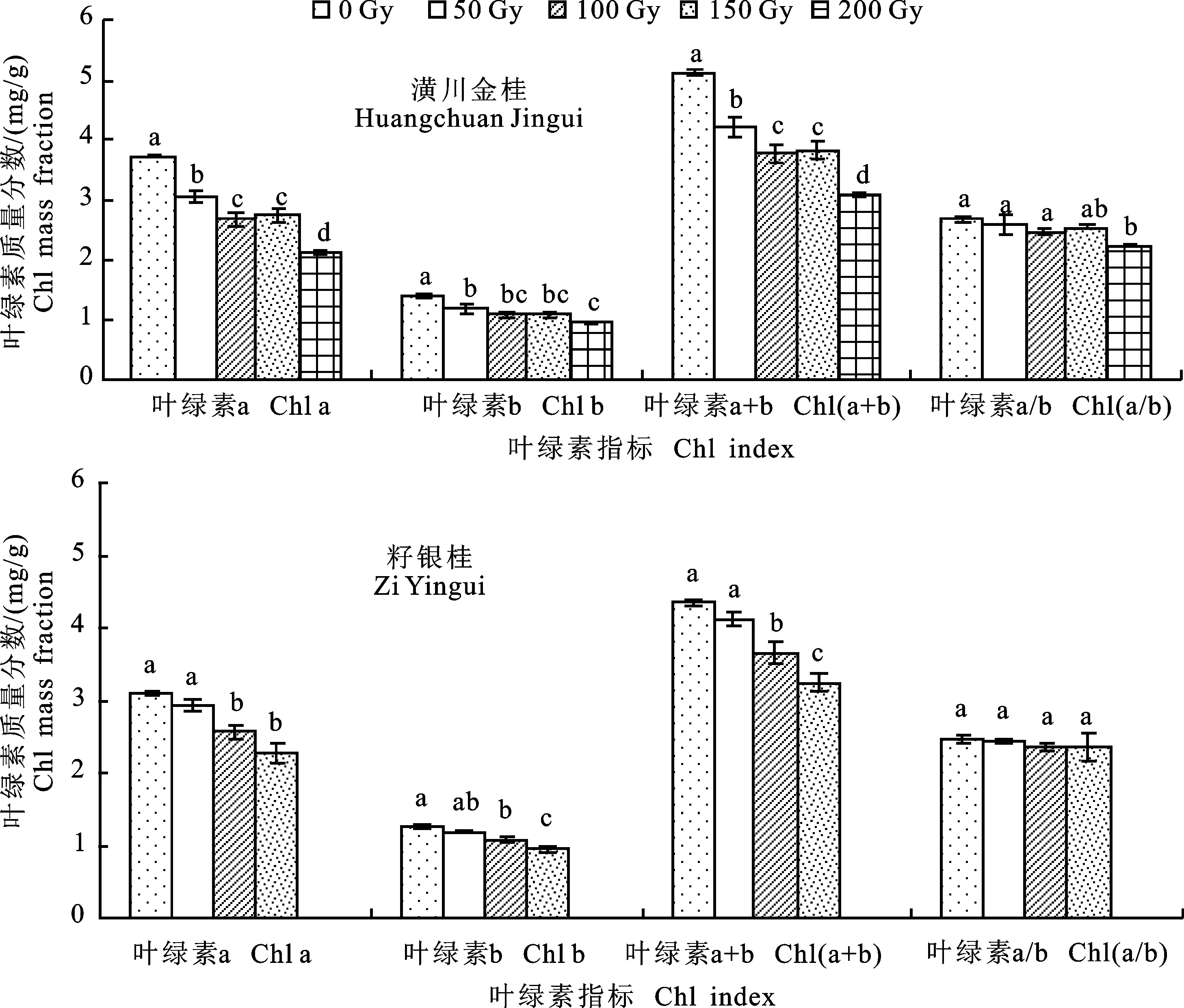
图2 不同剂量辐射后‘潢川金桂’和‘籽银桂’苗期叶片叶绿素指标Fig.2 Chlorophyll indicators of ‘Huangchuan Jingui’ and ‘Zi Yingui’ seedlings at different degrees of radiation
2.4.2 SOD酶活性 由图3可知,‘潢川金桂’与‘籽银桂’幼苗期叶内的SOD酶活性都呈先升后降的趋势,在50 Gy剂量下SOD酶活性最大,分别比对照增加16.54%和9.91%。‘潢川金桂’在50~100 Gy处理下,SOD活性与对照相比差异显著,当辐射剂量达到150 Gy及以上时,SOD酶活性均小于对照;‘籽银桂’在50 Gy剂量处理下,SOD酶活性大于对照,但差异不显著,当辐射剂量达到100 Gy及以上时,SOD酶活性均小于对照。说明低辐射剂量能提高桂花幼苗的防御能力,这表现在SOD酶活性的增强上,随着辐射剂量的增高,幼苗损伤严重,SOD酶已经失去了防御和修复的能力,酶活性逐步下降,导致幼苗生长不正常。
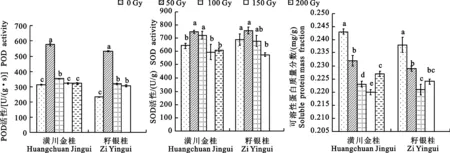
图3 不同剂量的60Co-γ辐射后‘潢川金桂’和‘籽银桂’的生理指标Fig.3 Physiology indexes of ‘Huangchuan Jingui’ and ‘Zi Yingui’ among 60Co-γ ray of different doses
2.4.3 可溶性蛋白 由图3可知,在辐射处理下,‘潢川金桂’与‘籽银桂’幼苗的可溶性蛋白的质量分数均显著小于对照,说明辐射显著减少了可溶性蛋白,‘潢川金桂’在150 Gy剂量下,可溶性蛋白最少,为0.220 mg/g;‘籽银桂’在100 Gy剂量下,可溶性蛋白最少,为0.221 mg/g。
2.5 ‘潢川金桂’与‘籽银桂’辐射诱变剂量的选择
不同植物的种子对辐射剂量的敏感性不同,因此所产生的效应就会有差异,一般而言,辐射剂量增大,变异率增加,出苗率降低;反之,剂量过小,变异率也小,达不到试验预期的目标。因此,在辐射诱变育种时,剂量的选择十分重要。通常以半致死剂量作为既能保持后代群体数量,又能产生有益变异的辐射剂量。
本试验中,依据桂花出苗率(y)与辐射剂量(x)的相关性进行回归分析,拟合曲线见图4,得到‘潢川金桂’和‘籽银桂’的回归方程分别为y=-0.001 3x2+0.105 3x+59.71,其中R2=0.833;y=0.000 2x2-0.392 2x+82.347,其中R2=0.971。从回归方程中计算出‘潢川金桂’和‘籽银桂’的理论半致死剂量(LD50)分别为135.94 Gy和86.27 Gy;理论临界剂量(LD40)分别为170.12 Gy和114.68 Gy。‘籽银桂’的半致死剂量要低于‘潢川金桂’,说明辐射处理后‘籽银桂’较‘潢川金桂’更敏感。

图4 桂花出苗率与剂量的回归曲线Fig.4 Regression curve of radiating dose and emergence rate
3 讨 论
3.1 辐射对桂花生长量的影响
幼苗的生长状况是辐射生物学效应的重要参考指标[21]。苗高能作为辐射处理后种子活力早期生长的良好指标[22]。研究表明:γ射线辐照会引起植物形态的改变,通常低剂量辐照会促进种子的萌发、幼苗的生长;高剂量反之[9,23-25]。Kim等[23]研究发现:低剂量(1~2 Gy)γ辐射拟南芥种子,其幼苗苗高较对照组有轻微的增加,当剂量大于50 Gy时,幼苗的生长抑制显著。尽管目前还未得出低剂量的刺激效应是如何产生的这一结论,但多数研究者一致得出低剂量的辐照可能改变植物信号转导,刺激植物激素的合成,增强植物细胞的抗氧化能力,使其更好的抵御外界的干扰。反之,高剂量产生的抑制作用是由于体细胞分裂时细胞周期G2/M受阻,整个基因组受损伤[26]。本试验中,从对桂花种子的处理结果来看,60Co-γ射线照射对桂花均有不同程度的损害:抑制苗高、地径的生长、阻碍干物质的积累、提前分枝、致变率明显提高、生长点停止生长等特征。Zaka等[12]研究发现豌豆在大于6 Gy的剂量下,其生长受到严重的抑制。王瑞玲[15]得出水蜡种子在30 Gy剂量辐射下,其幼苗鲜质量明显下降。以上表明:植物种类不同,其敏感性有差异,这与植物本身基因组的差异有关,基因组小的物种可能更具抗辐射性[27]。因此,植物种类差异及辐射剂量高低均会影响植物的生长。
3.2 辐射对桂花光合色素的影响
本试验中,桂花处理组的叶绿素质量分数均显著低于对照,辐射抑制叶绿素的产生。此结果与范菁[28]研究茭白、Thiede等[29]研究金荞麦得出的结论一致。辐射抑制桂花叶绿素的产生,可能与辐射后叶绿素酶促进叶绿素的分解有关。相关研究表明:辐射能引发植物类囊体扩张,阻碍叶内同化产物的转运及叶绿素的合成,改变光合作用[29-30]。此外,叶绿素中的激发能可直接转化为单线态氧,PSI中Mehler’s反应中的单价氧的减少会产生ROS,导致叶绿体成为氧化胁迫的来源[31],所以,叶绿素质量分数的减少可能与叶绿体中产生大量的ROS及抗氧化系统平衡遭到破坏有关。Fan等[32]研究100 Gy60Co-γ辐照茭白时,叶绿素a显著减少,电子传递速率下降,Kim等[11]研究拟南芥也得出一致的结论。以上表明:植物在适应高剂量辐射时,植物叶片会产生一种保护机制,如叶绿素质量分数减少,光合作用能力增强的光合作用保护机制。
3.3 辐射对桂花酶活性的影响
在逆境环境中,植物的抗氧化剂和抗氧化酶能有效的清除活性氧的毒害,调节植物正常生理生化过程,维持细胞内氧化还原平衡。在植物细胞保护酶系统中,SOD可清除超氧自由基对细胞膜带来损伤,但SOD和POD保护酶有一定的限度。低剂量辐射条件下,SOD活性的上升是植物对辐射胁迫的自我保护现象;高剂量辐射时,SOD活性下降,超氧自由基大量积累,膜透性受损。POD能降解细胞中的H2O2,避免细胞中过量的H2O2氧化细胞中蛋白质和脂类,对细胞膜产生伤害。本试验中‘潢川金桂’与‘籽银桂’的POD、SOD酶活性均随着辐射剂量的增加呈现先增后减的趋势,在50 Gy剂量下达到最大。此结论与Zaka等[33]研究针茅、Vandenhove等[34]研究拟南芥、王瑞玲[15]研究水蜡得出低剂量辐射促进幼苗酶活性增加,高剂量起抑制作用的结论相似。POD活性先升后降,但依旧维持在较高的水平,此为桂花对低剂量辐射胁迫的一种主动适应方式;但辐射剂量高于100 Gy时,桂花细胞体内的酶活性系统损害,POD活性迅速降低。
3.4 辐射对桂花可溶性蛋白的影响
可溶性蛋白质量分数与植物的抗逆性有密切的联系,在一定范围内,植物可主动积累可溶性蛋白以适用外界环境的改变,对自身起保护作用。此外,蛋白质也是细胞的重要组成物质,且促进植物生理生化反应的酶多为蛋白质。本试验在供试剂量范围内,桂花的可溶性蛋白质量分数均有所下降,与郑宾国等[35]研究鱼腥藻得出的结论一致,可能是由于辐射增强桂花蛋白质分解与代谢,造成蛋白质结构、蛋白酶活性上升,可溶性蛋白质量分数下降。
3.5 桂花半致死剂量的确定
种子的敏感性与品种、种子的生理状态有关,辐射处理剂量应综合种子的生理状态等具体情况确定。通常将半致死剂量[36-37]作为进行辐射育种的适宜剂量,具体以何种指标来确定半致死剂量目前还未有统一的标准,近年来多以相对出苗率[36]、出苗率[38]、相对萌发率[39]、成苗率[40]等作为计算半致死剂量指标。蔡春菊等[41]认为,出苗率、M1植株生长和形态等性状指标、内源物质、酶活性等生理指标及染色体变异等细胞学效应均可作为辐射剂量确定的依据。本试验参照前人的研究结果,并依据实际情况选择50~250 Gy的辐射剂量,以出苗率作为指标确定半致死剂量。在实际应用中,可在预测剂量的基础上依据不同的育种目标对辐射剂量作相应的调整。
4 结 论
试验结果表明,60Co-γ辐射对桂花种子的辐射效应明显,种子出苗率下降,幼苗生长缓慢,株高矮化,茎秆变细。辐射对幼苗叶绿素、SOD、POD酶等生理指标的影响小于种子效应,这可能是随着幼苗的生长,植株修复部分损伤,但高剂量的辐射影响仍显著。植物种类不同,其辐射敏感性也不同,本试验中,‘籽银桂’的敏感性大于‘潢川金桂’。综合分析种子出苗、幼苗生长及生理指标的结果表明:在γ射线诱变育种中,‘潢川金桂’种子以135~155 Gy较适宜,而‘籽银桂’以80~100 Gy较适宜。
本试验仅仅比较同一剂量率条件下不同剂量对桂花种子的辐射差异,而不同剂量率对桂花的辐射效应有待进一步研究。此外,为了加快桂花辐射育种进程,还可选取桂花的其他材料进行辐射,如茎干、枝条、花粉等,并将现代分子生物学技术与辐射技术相结合,以期提高对有利变异的筛选和利用。
Reference:
[1] 尚富德,韩远记,袁王俊,等.木犀属及桂花品种分类研究进展[J].河南大学学报(自然科学版),2012,42(5):608-612.
SHANG F D,HAN Y J,YUAN W J,etal.Review on classification ofOsmanthusandOsmanthusfragranscultivars[J].JournalofHenanUniversity(NaturalScienceEdition),2012,42(5):608-612(in Chinese with English abstract).
[2] 臧德奎.桂花品种分类研究[D].南京:南京林业大学,2004.
ZANG D K.Studies on the cultivar classification of sweetOsmanthusmedia[D].Nanjing:Nanjing Forestry University,2004(in Chinese with English abstract).
[3] 朱 诚,曾广文.桂花衰老过程中的某些生理生化变化[J].园艺学报,2000,27(5):356-360.
ZHU CH,ZENG G W.Physiological and biochemical changes in flower senescence ofOsmanthusfragransLour.[J].JournalofActaHorticulturaeSinica,2000,27(5):356-360(in Chinese with English abstract).
[4] 张晓琳.桂花光合特性的研究[D].山东泰安:山东农业大学,2010.
ZHANG X L.Research on photosynthetic characteristics ofOsmanthusfragransmedia[D].Taian Shandong:Shandong Agricultural University,2010(in Chinese with English abstract).
[5] 俞建妹,唐树生,王凌晖.水分胁迫对桂花幼苗生长及生理特性的影响[J].安徽农业科学,2010,38(4):2107-2109.
YU J M,TANG SH SH,WANG L H.Effects of water stress on the seedling growth and physiological characteristics ofOsmanthusfragrans(Thunb.) Lour.[J].JournalofAnhuiAgriculturalSciences,2010,38(4):2107-2109(in Chinese with English abstract).
[6] 韩瑞超,邱乾栋,臧德奎,等.低温胁迫下桂花品种的生理变化及耐寒性评价[J].山东农业科学,2011,12(25):27-30.
HAN R CH,QIU Q D,ZANG D K,etal.Physiological variation and cold resistance evaluation of different sweetOsmanthuscultivars under low temperature stress [J].JournalofShandongAgriculturalSciences,2011,12(25):27-30(in Chinese with English abstract).
[7] 杨再强,王立新.观赏植物辐射诱变育种研究进展[J].四川林业科技,2006,27(3):19-23.
YANG Z Q,WANG L X.Advancces in radiation-induced mutation breeding of ornamental plants [J].JournalofSichuanForestryScienceandTechnology,2006,27(3):19-23(in Chinese with English abstract).
[8] STADLER L J.Genetic effects of X-rays in maize[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1928,14(1):69.
[9] KIM J H,CHUNG B Y,KIM J S,etal.Effects of in plant a gamma-irradiation on growth,photosynthesis,and antioxidative capacity of red pepper (CapsicumannuumL.) plants[J].JournalofPlantBiology,2005,48(1):47-56.
[10] JIA C F,LI A L.Effect of gamma radiation on mutant induction ofFagopyrumdibotrysHara [J].Photosynthetica,2008,46(3):363-369.
[11] KIM J H,MOON Y R,LEE M H,etal.Photosynthetic capacity ofArabidopsisplants at the reproductive stage tolerates γ irradiation [J].JournalofRadiationResearch,2011,52(4):441-449.
[12] ZAKA R,CHENAL C,MISSET M T.Effects of low doses of short-term gamma irradiation on growth and development through two generations ofPisumsativum[J].ScienceoftheTotalEnvironment,2004,320(2):121-129.
[13] WI S G,CHUNG B Y,KIM J S,etal.Effects of gamma irradiation on morphological changes and biological responses in plants[J].Micron,2007,38(6):553-564.
[14] 李树举,涂超峰,周振林,等.观赏桃辐射诱变育种研究初报[J].核农学报,2010,24(2):287-291.
LI SH J,TU CH F,ZHOU ZH L,etal.Preliminary study on irradiation breeding of ornamental peach [J].JournalofNuclearAgriculturalSciences,2010,24(2):287-291(in Chinese with English abstract).
[15] 王瑞玲.水蜡种子辐射诱变及突变体筛选的研究[D].哈尔滨:东北农业大学,2009.
WANG R L.The study on the radiation induced mutation of privetseeds and mutant selecting media[D].Harbin:Northeast Agricultural University,2009(in Chinese with English abstract).
[16] 原蒙蒙,李 妍,王 献.60Co-γ辐射对紫薇种子生物学效应的影响[J].河南农业科学,2015,44(1):101-104.
YUAN M M,LI Y,WANG X.Biological effects of60Co-γ radiation on seed ofLagerstroemiaindica[J].JournalofHenanAgriculturalSciences,2015,44(1):101-104 (in Chinese with English abstract).
[17] 张 兴.榆树辐射诱变育种的研究[D].哈尔滨:东北农业大学,2003.
ZHANG X.The research on the radiation induced mutation breeding of elm media[D].Harbin:Northeast Agricultural University,2003(in Chinese with English abstract).
[18] 杨秀莲,郝其梅.桂花种子休眠和萌发的初步研究[J].浙江林学院学报,2010,27(2):272-276.
YANG X L,HAO Q M.Dormancy and germination ofOsmanthusfragransseeds [J].JournalofZhejiangForestryCollege,2010,27(2):272-276(in Chinese with English abstract).
[19] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
LI H SH.Experimental Principle and Technology of Plant Physiology and Biochemistry[M].Beijing:Higher Education Press,2000:130-137(in Chinese).
[20] 陈建勋,王晓峰.植物生理学实验指导(第2版)[M].北京:高等教育出版社,2006.
CHEN J X,WANG X F.The Experimental Guide for Plant Physiology(2nd)[M].Beijing:Higher Education press,2006(in Chines).
[21] 刘秀清,章 铁.60Coγ射线低剂量辐射对生菜种子萌发、幼苗生长及酶活性的影响[J].核农学报,2012,26(6):868-872.
LIU X Q,ZHANG T.Effect of low dose irradiation of60Co-γ rays on seed germination seedling growth and enzymes activity ofLactucasativa[J].JournalofNuclearAgriculturalSciences,2012,26(6):868-872 (in Chinese with English abstract).
[22] 李玉明,杨世梅,纪海波,等.60Coγ射线对西瓜种子萌发和幼苗生长的效应[J].西北农业学报,2013,22(3):115-120.
LI Y M,YANG SH M,JI H B,etal.Effect of60Co-γ irradiation intensity on watermelon seed germination and seedling growth [J].ActaAgriculturaeBoreali-occidentalisSinica,2013,22(3):115-120 (in Chinese with English abstract).
[23] KIM J H,BAEK M H,CHUNG B Y,etal.Alterations in the photosynthetic pigments and antioxidant machineries of red pepper (CapsicumannuumL.) seedlings from gamma-irradiated seeds[J].JournalofPlantBiology,2004,47(4):314-321.
[24] KOVACS E,KERESZTES A.Effect of gamma and UV-B/C radiation on plant cells [J].Micron,2002,33(2):199-210.
[25] SEUNG G W,BYUNG Y C,KIM J H,etal.Ultrastructural changes of cell organelles inArabidopsisstems after gamma irradation[J].JournalofPlantBiology,2005,48(2):195-200.
[26] PREUSS S B,BRITT A B.A DNA-damage-induced cell cycle checkpoint inArabidopsis[J].Genetics,2003,164(1):323-334.
[27] SPARROW A H,MIKSCHE J P.Correlation of nuclear volume and DNA content with higher plant tolerance to chronic radiation[J].Science,1961,134(3474):282-283.
[28] 范 菁.60Co-γ辐射对茭白生长和生理特性的影响[D].杭州:浙江大学,2012.
FAN J.Effects of in planta60Co-γ irradiation on growth and physiological characteristics ofZizanialatifoliamedia[D]Hangzhou:Zhejiang University,2012(in Chinese with English abstract).
[29] THIEDE M E,LINK S O,FELLOWS R J,etal.Effects of gamma radiation on stem diameter growth,carbon gain and biomass partitioning inHelianthusannuus[J].EnvironmentalandExperimentalBotany,1995,35(1):33-41.
[30] ROY S,BEGUM Y,CHAKRABORTY A,etal.Radiation-induced phenotypic alterations in relation to isozymes and RAPD markers inVignaradiata(L.) Wilczek [J].InternationalJournalofRadiationBiology,2006,82(11):823-832.
[31] FOYER C H,SHIGEOKA S.Understanding oxidative stress and antioxidant functions to enhance photosynthesis[J].PlantPhysiology,2011,155(1):93-100.
[32] FAN J,SHI M,HUANG J Z,etal.Regulation of photosynthetic performance and antioxidant capacity by 60 Co γ-irradiation inZizanialatifoliaplants [J].JournalofEnvironmentalRadioactivity,2014,129(3):33-42.
[33] ZAKA R,VANDECASTEELE C M,MISSET M T.Effects of low chronic doses of ionizing radiation on antioxidant enzymes and G6PDH activities inStipacapillata(Poaceae) [J].JournalofExperimentalBotany,2002,53(376):1979-1987.
[34] VANDENHOVE H,VANHOUDT N,CUYPERS A.Life-cycle chronic gamma exposure ofArabidopsisthalianainduces growth effects but no discernable effects on oxidative stress pathways [J].PlantPhysiologyandBiochemistry,2010,48(9):778-786.
[35] 郑宾国,崔节虎,彭伟功,等.不同γ-射线辐照剂量对鱼腥藻生长及生理特性的影响[J].西北农林科技大学学报(自然科学版),2013,41(8):182-188.
ZHENG B G,CUI J H,PENG W G,etal.Effect of gamma-ray irradiation on the growth and physiological characteristics ofAnabaenasp.[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2013,41(8):182-188 (in Chinese with English abstract).
[36] 王瑞静,王瑞文,沈宝仙.60Co-γ射线对杨树种子的辐射效应[J].核农学报,2009,23(5):762-765.
WANG R J,WANG R W,SHEN B X.Effect of60Co-γ rays irradiation on poplar seeds [J].JournalofNuclearAgriculturalSciences,2009,23(5):762-765 (in Chinese with English abstract).
[37] GAUL H.Present aspect of induced mutation in plant breeding [J].Euphytica,1958,7(3):275-278.
[38] 谭美莲,汪 磊,严明芳,等.辐射对蓖麻种子生长及生理指标的影响[J].作物研究,2012,26(1):35-39.
TAN M L,WANG L,YAN M F,etal.Effect of60Co-γ rays irradiation on seed growth and physiological indexes of castor BEAN[J].ActaAgronomicaSinica,2012,26(1):35-39(in Chinese with English abstract).
[39] 原蒙蒙,李 妍,王 献.60Co-γ辐射对紫薇种子生物学效应的影响[J].河南农业科学,2015,44(1):101-104.
YUAN M M,LI Y,WANG X.Biological effect of60Co-γ radiation on seed ofLagerstroemiaindica[J].JournalofHenanAgriculturalSciences,2015,44(1):101-104 (in Chinese with English abstract).
[40] 聂莉莉,刘仲齐,张 越,等.椿树辐射诱变育种初报[J].核农学报,2009,23(4):577-580.
NIE L L,LIU ZH Q,ZHANG Y.Preliminary study on irradiation breeding ofAilanthusaltissimaswingle [J].JournalofNuclearAgriculturalSciences,2009,23(4):577-580 (in Chinese with English abstract).
[41] 蔡春菊,高 健,牟少华.60Co-γ射线对毛竹种子活力及早期幼苗生长的影响[J].核农学报,2007,21(5):436-440.
CAI CH J,GAO J,MOU SH H.Effect of60Co-γ rays radiation on seed vigor and young seedling growth ofPhyllostachysedulis[J].JournalofNuclearAgriculturalSciences,2007,21(5):436-440 (in Chinese with English abstract).
(责任编辑:成 敏 Responsible editor:CHENG Min)
Effect of60Co-γ Rays Irradiation on Seedling Growth and Physiological Indexes ofOsmanthusfragrans
LI Yu,WANG Ping,GENG Xingmin,YANG Xiulian,LI Na and WANG Lianggui
(College of Landscape Architecture, Nanjing Forestry University,Nanjing 210037,China)
Irradiation mutagenesis is an effective method to improve varieties characters and create new germplasm resources.At present, the use of radiation technology in mutagenesis study of grape seeds of fragrans is seldom .‘Huangchuan Jingui’ and ‘Zi Yingui’ were irradiated by different doses of60Co-γ ray in this experiment, and the effect of irradiation on the M1generation was studied. The results showed that with the gradual enhancement of irradiation dosage, the growth of the fragrans were distinctly suppressed, the rate of seedling emergence, height, diameter, dry mass were dramatically reduced ; and the mass fraction of chlorophyll and the maximum values of soluble protein decreased at the seeding stage, the activities of superoxide dismutase(SOD) and peroxidase(POD) increased at first,and then declined, the largest value was presented at the 50 Gy irradiation. The effect of60Co-γ ray on ‘Zi Yingui’ was obviously larger than that of the ‘Huangchuan Jingui’, the radio sensitivity emergence rate and the60Co-γ ray irradiation with low rate on ‘Huangchuan Jingui’ showed that the half lethal dosage(LD50) and the critical dosage(LD40) were 135.94 Gy and 170.12 Gy respectively,while,the ‘Zi Yingui’ were 86.27 Gy and 114.68 Gy .Based on above results,the appropriate dosage of60Co-γ ray for ‘Huangchuan Jingui’ seeds was 135-155 Gy, 80-100 Gy for ‘Zi Yingui’.
Huangchuan Jingui;Zi Yingui;60Co-γ ray;Irradiation-induced breeding
LI Yu, female.master student.Research area:germplasm resources collection and innovation in plant.E-mail:1364576275@qq.com
WANG Lianggui, male,professor,doctoral supervisor.Research area:cultivation and application of the landscape plant.E-mail:wlg@njfu.com.cn
2015-11-07
2016-01-17
“十二五”科技支撑计划(2013BA001B06);江苏高校优势学科建设工程资助项目(PAPD)。
李 瑜,女,硕士研究生,从事植物资源收集与创新研究。E-mail:1364576275@qq.com
王良桂,男,教授,博士生导师,主要从事园林植物栽培与应用研究。E-mail:wlg@njfu.com.cn
日期:2016-12-20
S685.13
A
1004-1389(2017)01-0061-09
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161220.1640.016.html
Received 2015-11-07 Returned 2016-01-17
Foundation item Chinese Science-Technology Support Program of 12thFive-year Plan (No.2013BAD01B06);Construction Program for Leading Disciplines of Universities of Jiangsu Province (No.PAPD).
