胰腺癌中Ring1B、LSD1及P16表达及其与预后的关系
2017-03-23陈辉星陈实李小燕陈明源严茂林黄龙
陈辉星,陈实,李小燕,陈明源,严茂林,黄龙
(福建医科大学附属协和医院 1. 肝胆外科 3. 病理科,福建 福州 350001;2. 福建省立医院 肝胆外科/福建医科大学附属省立临床医学院,福建 福州 350001)
胰腺癌具有极强的生长、侵袭和转移能力,预后差,长期生存率仅5%[1-5]。E3泛素连接酶亚单位Ring1B和组蛋白赖氨酸特异性去甲基化酶1(LSD1)分别作为组蛋白泛素化和甲基化修饰过程中的重要酶,在肿瘤发生过程中发挥重要作用;而细胞周期调节因子P16为重要的抗癌基因,一旦失活,则会引起细胞恶性增殖。P16基因转录的调控机制还不清楚。因此研究Ring1B、LSD1及P16与预后的关系,及其可能的联系,对深入探讨胰腺癌的发病机制、寻求有效抑制肿瘤细胞生长的治疗靶点具有重要的临床意义。
1 材料与方法
1.1 临床标本
选取2004年1月—2016年1月福建医科大学附属协和医院与福建省立医院施行的85例胰腺癌手术的临床组织标本,癌组织和癌旁组织制作石蜡切片进行免疫组化检测[1]。并选取其中6对新鲜胰腺癌组织及对应癌旁组织标本,在手术切除后立即取样,迅速冷冻于液氮并于-80℃冻存,分别提取组织细胞mRNA和蛋白。随访方式主要采取定期门诊复查及电话咨询,85例患者的中位随访时间为24(1~62)个月,无失访 。本研究均已通过福建医科大学附属协和医院和福建省立医院伦理委员会审核批准。
1.2 实验试剂
RNA提取试剂TRizol购自美国Invitrogen公司,qRT-PCR反应试剂盒购自TaKaRa生物技术公司,引物由上海生工生物公司合成,qRT-PCR引物系列:Ring1B引物:正向5'-GGC AAC AAA GAA TGT CCTA CC-3',反向5'-GTC ACC ATT ATC TTC TGC TCC A-3';LSD1:正向5'-CTC TTC TGG AAC CTC TAT AAA GC-3',反向5'-CAT TTC CAG ATG ATC CTG CAG CAA-3';P16引物:正向5'-AGC AGC ATG GAG CCT TC-3',反向5'-GCC TCC GAC CGT AAC TAT TC-3';内参GAPDH引物:正向5'-GTC TCC TCT GAC TTC AAC AGC GC-3',反向5'-ACC ACC CTG TTG CTG TAG CCA A-3'。BCA蛋白定量分析试剂盒购自美国Thermo Scientific公司,PVDF膜购自美国Milipore公司,Ring1B、LSD1及P16一抗为兔抗人多克隆抗体购自上海彰真生物科技有限公司,免疫组化稀释浓度1:50,Western blot稀释浓度1:100;内参β-actin一抗为鼠抗人单克隆抗体(Sigma公司),Western blot稀释浓度 1:1 000;DAB显色试剂盒购自福建迈新生物有限公司。
1.3 实验方法
1.3.1 免疫组化 采用EliVisionTMplus法,DAB显色。由1名具有高级职称的病理医师进行严格阅片,选取肿瘤组织超过90%的视野对其进行评分;组织免疫组化染色结果判读由2名高年资病理医师独立进行等级评定。组化染色为黄棕色者肿瘤细胞,按染色强弱程度分为4个等级:0,+,++,+++,分别对应0~3分;同时确定阳性肿瘤细胞所占比例,按百分率高低亦分为4个等级,<25%为 1分,25%~50%为 2分,51%~75%为 3分,>75%为4分;将染色强度与阳性率分值相乘,评分介于0~12分,以4分以上者为蛋白高表达。
1.3.2 qRT-PCR 通过 TRIzol reagent提取细胞总RNA,取2 µg RNA作为模板进行反转录。随后加入 5× 反转录缓冲液 5 µL、dNTP(10 mmol/L)1 µL、引物(0.3 µg/µL)2 µL、反转录酶 12 U 和RNA酶抑制剂20 U,总反应体系25 µL;反转录条件为 42℃ 1 h,95℃ 5min 灭活反转录酶;在StrataGeneMP3000实时荧光定量PCR仪(美国StrataGene公司)上行实时定量扩增:2×SYBR@Green Real-time PCR mix 12.5 µL、cDNA l µL、上下游引物各 0.4 pmol/L、总反应体系 25 µL;PCR 反应条件:95℃ 10min;95℃ 15 s、60℃15 s×40循环;所有qRT-PCR的实验结果重复3次。每个样本设3个复孔,分别记录Ring1B、LSD1、P16 和内参 GAPDH 的循环阈值(Cycle threshold,Ct), 采 用 2-△△Ct法 计 算 Ring1B、LSD1及P16的mRNA相对水平。
1.3.3 Western blot 用RIPA裂解液提取组织总蛋白,BCA法检测蛋白浓度。蛋白样品混合上样缓冲液后 100℃变性 10min,取 50 μg总蛋白上样,以10%SDS-PAGE电泳分离后经电转移至PVDF膜上;PBST漂洗3次后将PVDF膜置入Ring1B、LSD1、P16及内参β-actin一抗液体内4℃孵育过夜;PBST洗膜10min×3次,置入1:10 000稀释的HRP标记的相应二抗室温孵育30min,再次PBST洗涤后ECL化学发光法显影、定影,曝光摄片。
1.4 统计学处理
应用GraphPad Prism 6.0软件包进行统计学分析。两种蛋白之间的相关性采用Spearman秩相关分析; 整体生存率分析应用Kaplan-Meier曲线进行分析并经Log-rank检验进行检验,分别比较Ring1B、LSD1及P16高表达组和低表达组生存时间的差别。P<0.05为差异有统计学意义。
2 结 果
2.1 免疫组化检测结果
通过85例胰腺癌组织切片免疫组化检测,Ring1B与LSD1蛋白表达于细胞浆内,癌组织表达高,癌旁组织表达低;P16蛋白表达于细胞核,癌组织表达低,癌旁组织表达高,差异均有统计学意义(均P<0.05)(表1)(图1)。上述3种蛋白在胰腺癌中的免疫组化评分结果,经Spearman秩相关分析发现Ring1B、LSD1与P16的表达分布均呈负相关(r=-476,P<0.0001;r=-0.673,P<0.0001)(图2)。

表1 Ring1B、LSD1、P16在胰腺癌组织和癌旁组织中阳性表达率(或表达评分)比较Table 1 Comparison of the positive expression rates of Ring1B, LSD1 and P16 between pancreatic tissue and adjacent tissue

图1 免疫组化检测结果(×200)Figure 1 Immunohistochemical fi ndings (×200)
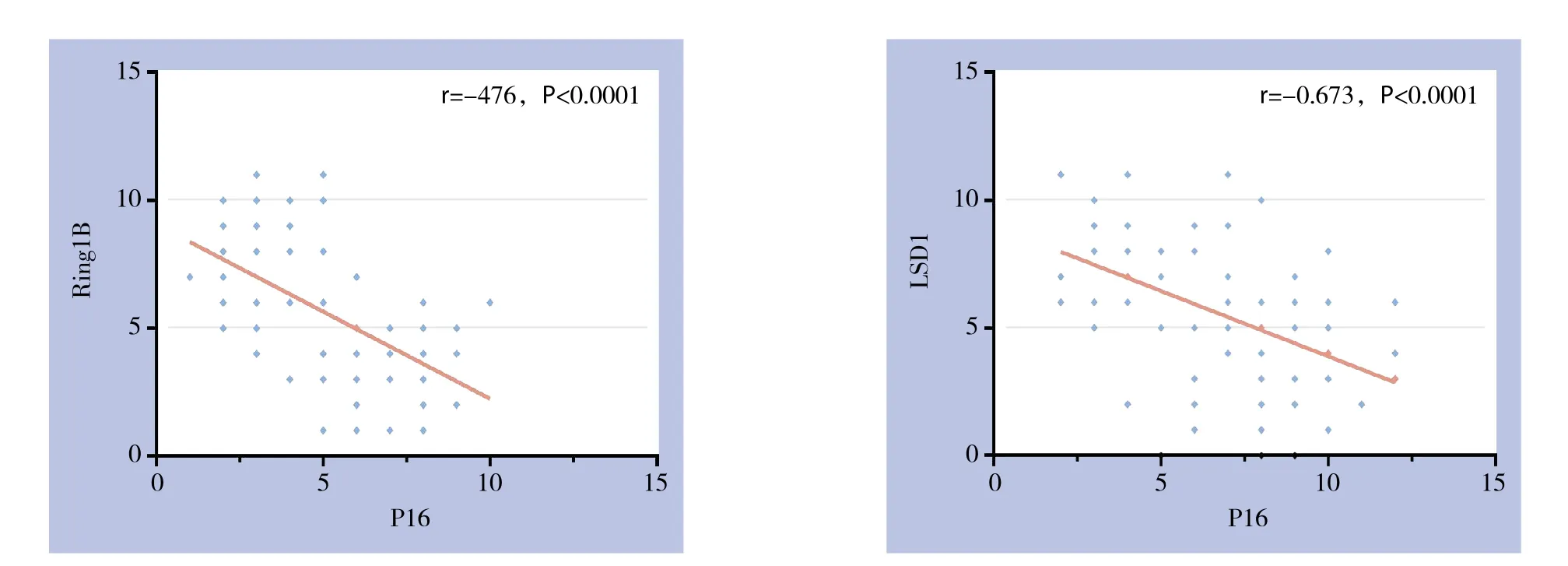
图2 Spearman秩相关分析Figure 2 Spearman rank correlation analysis
2.2 qRT-PCR检测结果
qRT-PCR检测6对胰腺癌组织和癌旁组织标本,胰腺癌组织和癌旁组织中Ring1B、LSD1、P16 mRNA的相对水平分别为8.908±3.204与1.947±0.938,7.126±2.948与1.940±0.654,1.269±0.311与5.237±1.586,3种mRNA的相对水平在胰腺癌组织和癌旁组织间的差异均有统计学意义(均P<0.05)。
2.3 Western blot检测结果
Ring1B、LSD1、P16的蛋白表达趋势与其mRNA一致,胰腺癌组织Ring1B、LSD1蛋白表达高于癌旁组织,P16蛋白表达低于癌旁组织(图3)。

图3 Western blot检测结果Figure 3 Results of Western blot analysis
2.4 生存分析结果
根据免疫组化结果,将患者分为Ring1B高表达组与低表达组、LSD1高表达组与低表达组、P16高表达组与低表达组。Kaplan-Meier生存曲线提示,Ring1B高表达胰腺癌患者生存率明显低于其低表达者(χ2=8.958,P=0.012)、LSD1高表达胰腺癌患者生存率明显低于其低表达者(χ2=8.856,P=0.010),相反,P16高表达胰腺癌患者生存率明显高于其低表达者(χ2=7.867,P=0.024)(图4)。

图4 不同Ring1B、LSD1、P16表达状态胰腺癌患者的生存曲线Figure 4 The survival curves of pancreatic cancer patients with different Ring1B, LSD1 or P16 expression statuses
3 讨 论
胰腺癌近年来发病率呈明显上升趋势(男性第4位,女性第5位),在所有消化道肿瘤中预后最差,中位生存期仅4~6个月,长期生存率仅5%[1-5]。胰腺癌增殖、侵袭和转移能力极强,是导致预后极差的主要原因。
表观遗传学改变是基因的DNA序列未发生改变的情况下,基因表型发生可遗传性变化,包括组蛋白甲基化、泛素化、DNA甲基化。研究证实胰腺癌的发生涉及凋亡、细胞周期等多基因多步骤参与,表观遗传学改变在胰腺癌的发生中可能起到重要作用[6]。
P16是重要的细胞周期调节因子,定位于细胞核内,抑制CDK4活性,可能通过抑制pRb蛋白磷酸化,将细胞周期阻断在G1期,最终阻止细胞进入S期。一旦P16发生基因缺失、启动子甲基化、其编码产物被癌基因蛋白所结合及转录后修饰等变异导致功能失活,细胞则恶性增殖,导致肿瘤发生[7-11]。研究[12-14]表明胰腺癌标本中p16蛋白表达水平降低,与肿瘤分化程度明显相关。本研究经RNA和蛋白水平检测也发现胰腺癌组织P16表达水平明显低于癌旁组织。P16在胰腺癌的发生中起到重要作用,P16基因的转录抑制调控可能与组蛋白修饰有关。
Ring1B是Polycomb(PcG)家族的重要成员,Ring1B介导组蛋白H2A第119位赖氨酸发生单泛素化(H2K119Ub1),调控细胞增殖[15-17]。已知PcG另一家族成员原癌基因Bmi-1,可作用于其下游的编码p16INK4A/Rb的INK4A-ARF位点,以甲基化方式参与Pl6等抑癌基因的异常沉默,导致细胞周期蛋白依赖性激酶持续活化和细胞周期失控[18-19]。本研究检测发现Ring1B在癌组织中的转录和表达水平高于癌旁组织,Spearman秩相关系分析发现Ring1B与P16的表达呈负相关。Ring1B可能通过组蛋白泛素化,参与P16的转录调控,导致胰腺癌发生。
LSD1是黄素腺嘌呤二核苷酸依赖的组蛋白去甲基化酶,LSD1能够去除组蛋白H3K4和H3K9的单、双甲基,从而调节组蛋白并影响基因转录的激活、抑制等过程。LSD1广泛参与了肿瘤的发生、增殖、侵袭、转移和复发,其在维持肿瘤的恶性生物学特性的过程中发挥了重要作用,是一个潜在的干预肿瘤恶性潜能的靶点[20-24]。本研究经IHC检测发现LSD1在胰腺癌组织中的表达水平高于癌旁组织,进一步通过RNA转录和蛋白表达水平证实了上述结果。Spearman秩相关系分析发现LSD1与P16的表达呈负相关。因此,我们推测LSD1也参与了Pl6的调控。
本研究发现Ring1B、LSD1与P16的表达均呈负相关,并且通过Kaplan-Meier生存分析发现高表达Ring1B、LSD1和低表达P16的胰腺癌患者预后差,提示Ring1B、LSD1及P16在胰腺癌组织中的表达及其之间的相关性与肿瘤的恶性生物学行为可能相关。Ring1B、LSD1可能分别通过组蛋白泛素化和去甲基化调控P16的转录表达,影响胰腺癌的发生与发展,胰腺癌的发生与表观遗传学改变有关。具体调控区域与相互作用方式有待进一步研究。
[1]曾复, 葛春林. 胰腺癌185例诊治回顾分析[J]. 中国普通外科杂志,2015, 24(3):336–342. doi:10.3978/j.issn.1005–6947.2015.03.006.Zeng F, Ge CL. Diagnosis and treatment of pancreatic cancer:a retrospective analysis of 185 cases[J]. Chinese Journal of General Surgery, 2015, 24(3):336–342.doi:10.3978/j.issn.1005–6947.2015.03.006.
[2]Jemal A, Siegel R, Xu J, et al. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60(5):277–300. doi: 10.3322/caac.20073.
[3]杨尹默. 胰腺癌外科治疗的现状、存在问题与展望 [J]. 中国普通外科杂志, 2016, 25(9): 1231–1235.doi:10.3978/j.issn.1005–6947.10.3978/j.issn.1005–6947.2016.09.001.Yang YM. Surgical managements of pancreatic cancer: current status and future directions[J]. Chinese Journal of General Surgery,2016, 25(9): 1231–1235. doi: 10.3978/j.issn.1005–6947.10.3978/j.issn.1005–6947.2016.09.001.
[4]Puri A, Saif MW. Pharmacogenomics update in pancreatic cancer[J].JOP, 2014, 15(2):114–117. doi: 10.6092/1590–8577/2285.
[5]Dimou A, Syrigos KN, Saif MW. Update on novel therapies for pancreatic neuroendocrine tumors: 2013[J]. JOP, 2013, 14(4):377–380. doi: 10.6092/1590–8577/1647.
[6]黄焕军, 王敏, 秦仁义, 等. 人胰腺癌干细胞差异性基因的表达[J]. 中华实验外科杂志, 2009, 26(7):845–848. doi:10.3760/cma.j.issn.1001–9030.2009.07.010.Huan GJ, Wang M, Qin RY, et a1. Analysis on gene expression profile of human pancreatic cancer stem cells by gene microarray[J]. Chinese Journal of Experimental Surgery, 2009,26(7):845–848. doi: 10.3760/cma.j.issn.1001–9030.2009.07.010.
[7]Lutful Kabir FM, Agarwal P, Deinnocentes P, et al. Novel frameshift mutation in the p16/INK4A tumor suppressor gene in canine breast cancer alters expression from the p16/INK4A/p14ARF locus[J]. J Cell Biochem, 2013, 114(1):56–66. doi: 10.1002/jcb.24300.
[8]张征, 陈先祥, 董荣坤, 等. zebularine对人胃癌SGC-7901细胞株抑癌基因p16表达的影响[J]. 中国普通外科杂志, 2015,24(6):889–891.doi:10.3978/j.issn.1005–6947.2015.06.025.Zhang Z, Chen XX, Dong RK, et al. The effect of zebularine on p16 mRNA expression in SGC-7901 cell line[J]. Chinese Journal of General Surgery, 2015, 24(6): 889–891.doi:10.3978/j.issn.1005–6947.2015.06.025.
[9]Sperka T, Wang J, Rudolph KL. DNA damage checkpoints in stem cells, ageing and cancer[J]. Nat Rev Mol Cell Biol, 2012,13(9):579–590. doi: 10.1038/nrm3420.
[10]Bertoli C, Skotheim JM, de Bruin RA. Control of cell cycle transcription during G1 and S phases[J]. Nat Rev Mol Cell Biol,2013, 14(8):518–528. doi:10.1038/nrm3629.
[11]曾令瑞, 韩玉贞, 朱玉红, 等. 乳腺癌中Wnt信号蛋白β-catenin和cyclin D1的表达及其与侵袭转移的关系[J]. 中国普通外科杂志, 2014, 23(11):1517–1521. doi:10.7659/j.issn.1005–6947.2014.11.012.Zeng LR, Han YZ, Zhu YH, et al. Expression of Wnt signaling protein β-catenin and cyclin D1 in breast cancer and its relation with invasion and metastasis[J]. Chinese Journal of General Surgery, 2014, 23(11):1517–1521. doi:10.7659/j.issn.1005–6947.2014.11.012.
[12]王爱萍, 高美华. 抑癌基因P16在胰腺癌癌旁组织中的表达及意义[J]. 医学信息, 2015, (z2):266. doi:10.3969/j.issn.1006–1959.2015.z2.406.Wang AP, Gao MH. Expression and significance of cancer suppressor gene P16 in cancer-adjacent tissue of pancreatic cancer[J]. Medical Information, 2015, (z2):266. doi:10.3969/j.issn.1006–1959.2015.z2.406.
[13]冷政伟, 夏清华, 殷涛, 等. Bmi-1通过抑制p16基因的表达促进人胰腺癌细胞的增殖[J]. 中华实验外科杂志, 2013, 30(1):20–22.doi:10.3760/cma.j.issn.1001–9030.2013.01.005.Leng ZW, Xia QH, YIN T, et al. B-cell speci fi c moloney leukemia virus insertion site 1 promote sproliferation of pancreatic cancer cells PANC-1 via inhibiting the expression of p16 gene[J]. Chinese Journal of Experimental Surgery, 2013, 30(1):20–22.doi:10.3760/cma.j.issn.1001–9030.2013.01.005.
[14]潘烽平, 徐鹿平, 陆松春, 等. 大黄素联合5AzA-cdR对胰腺癌抑癌基因p16、RASSF1A去甲基化作用研究[J]. 浙江医学, 2016,38(5):322–325.Pang FP, Xu LP, Lu SC, et al. Emodin enhances 5AzA-cdR-induced demethylation of p16 and RASSF1A genes in pancreatic cancer cells[J]. Zhejiang Medical Journal, 2016, 38(5):322–325.
[15]Li J, Wang Z, Hu Y, et al. Polycomb Group Proteins RING1A and RING1B Regulate the Vegetative Phase Transition in Arabidopsis[J]. Front Plant Sci, 2017, 8:867. doi: 10.3389/fpls.2017.00867.
[16]Chitale S, Richly H. Nuclear organization of nucleotide excision repair is mediated by RING1B dependent H2A-ubiquitylation[J].Oncotarget, 2017, 8(19):30870–30887. doi:10.18632/ oncotarget.16142.
[17]Hernandez-Muñoz I, Figuerola E, Sanchez-Molina S, et al.RING1B contributes to Ewing sarcoma development by repressing the NaV1.6 sodium channel and the NF-κB pathway, independently of the fusion oncoprotein[J]. Oncotarget, 2016, 7(29):46283–46300.doi:10.18632/oncotarget.10092.
[18]Liu YL, Jiang SX, Yang YM, et al. USP22 acts as an oncogene by the activation of BMI-1-mediated INK4a/ARF pathway and Akt pathway[J]. Cell Biochem Biophys, 2012, 62(1):229–235. doi:10.1007/s12013–011–9287–0.
[19]刘宏伟, 谢文练, 韩金利, 等. Bmi-1在膀胱移行细胞癌组织的表达及与p16 INK4a和p14 ARF的关系[J]. 中华实验外科杂志, 2010,27(10):1542.doi: 10.3760/cma.j.issn.1001–9030.2010.10.062.Liu HW, Xie WL, Hang JL, et al. Bmi-1 expression in bladder transitional cell carcinoma and its relations with p16 INK4a and p14 ARF[J]. Chinese Journal of Experimental Surgery, 2010,27(10):1542. doi: 10.3760/cma.j.issn.1001–9030.2010.10.062.
[20]Fang J, Ying H, Mao T,et al. Upregulation of CD11b and CD86 through LSD1 inhibition promotes myeloid differentiation and suppresses cell proliferation in human monocytic leukemia cells[J].Oncotarget, 2017, doi:10.18632/oncotarget.[Epub ahead of print].
[21]Haydn T, Metzger E, Schuele R, et al. Concomitant epigenetic targeting of LSD1 and HDAC synergistically induces mitochondrial apoptosis in rhabdomyosarcoma cells[J]. Cell Death Dis, 2017,8(6):e2879. doi: 10.1038/cddis.2017.239.
[22]Zou ZK, Huang YQ, Zou Y, et al. Silencing of LSD1 gene modulates histone methylation and acetylation and induces the apoptosis of JeKo-1 and MOLT-4 cells[J]. Int J Mol Med, 2017,40(2):319–328. doi: 10.3892/ijmm.2017.3032.
[23]Lee JY, Park JH, Choi HJ, et al. LSD1 demethylates HIF1α to inhibit hydroxylation and ubiquitin-mediated degradation in tumor angiogenesis[J]. Oncogene, 2017, doi:10.1038/onc. 2017.158.[Epub ahead of print]
[24]徐近, 秦毅, 张波, 等. 胰腺癌细胞PANC-1中LSD1负向调控抑癌基因SIRT3的实验研究[J]. 中国癌症杂志, 2014, 24(2):87–92.doi:10.3969/j.issn.1007–3969.2014.02.002.Xu J, Qin Y, Zhang B, et al. LSD1 negatively regulates the expression of tumor suppressor gene SIRT3 in pancreatic cancer cell line PANC-1[J]. China Oncology, 2014, 24(2):87–92.doi:10.3969/j.issn.1007–3969.2014.02.002.
