基于离子迁移谱技术对冰鲜鸡肉和解冻鸡肉的鉴别
2017-03-23于林宏王淑玲孙京新李鹏
于林宏++王淑玲++孙京新++李鹏

摘 要:为实现冰鲜鸡肉和解冻鸡肉的快速鉴别,本实验采用离子迁移谱技术,取新鲜(对照组)、冰鲜和解冻鸡胸肉各10 g并搅碎成肉糜状,测定其剪切力、保水性(蒸煮损失率、汁液流失率、滴水损失率及加压损失率)、色泽和质构等理化指标并进行离子迁移谱的图谱采集,对其进行标准变量正态变换处理,利用主成分分析及判别函数分析进行鉴别。结果表明:冰鲜鸡肉的各项理化指标与新鲜鸡肉相比无显著性差异(P>0.05),而与解冻鸡肉相比差异显著(P<0.05);冰鲜鸡肉与解冻鸡肉的主成分分析得分达到98.60%,判别函数法得分高达99.17%,完全能够将2 种样品进行区分。因此,离子迁移谱用于鉴别冰鲜鸡肉和解冻鸡肉是可行的。
关键词:离子迁移谱;冰鲜鸡肉;解冻鸡肉;理化指标;主成分分析;判别函数分析
Discrimination of Fresh, Chilled and Frozen-Thawed Chicken Based on Ion Mobility Spectrometry
YU Linhong1, WANG Shuling1, SUN Jingxin1,*, LI Peng1, WANG Shubai1, ZHOU Xinghu2
(1.College of Food Science and Engineering, Qingdao Agricultural University, Qingdao 266109, China;
2.Nanjing Nongda Meat Co. Ltd., Nanjing 210095, China)
Abstract: This research was done in an attempt to quickly discriminate fresh chilled and frozen-thawed chicken employing ion mobility spectrometry (IMS). Samples (10 g each) of fresh (as control), chilled and frozen-thawed chicken breast were minced for physiochemical measurements such as shear force, water-holding properties (cooking loss, exudate loss, drip loss and pressing loss), color and texture properties. Moreover, IMS spectra were acquired and processed by standard normal variate (SNV) transformation. The discrimination was performed using principal component analysis (PCA) and discriminant function analysis (DFA). Results showed that no significant differences in all investigated parameters were seen between fresh and chilled samples (P > 0.05), yet significant differences existed between chilled and frozen-thawed samples (P < 0.05). PCA scores for chilled and frozen-thawed samples were 98.60%, and DFA scores were 99.17%, suggesting successful discrimination between the two samples. Consequently, IMS is feasible to be used to discriminate chilled and frozen-thawed chicken.
Key words: ion mobility spectrometry (IMS); chilled chicken; frozen-thawed chicken; physicochemical indexes; principle component analysis (PCA); discriminant function analysis (DFA)
DOI:10.7506/rlyj1001-8123-201703010
中圖分类号:TS251.4 文献标志码:A 文章编号:1001-8123(2017)03-0051-05
引文格式:
于林宏, 王淑玲, 孙京新, 等. 基于离子迁移谱技术对冰鲜鸡肉和解冻鸡肉的鉴别[J]. 肉类研究, 2017, 31(3): 51-55. DOI:10.7506/rlyj1001-8123-201703010. http://www.rlyj.pub
YU Linhong, WANG Shuling, SUN Jingxin, et al. Discrimination of fresh, chilled and frozen-thawed chicken based on ion mobility spectrometry[J]. Meat Research, 2017, 31(3): 51-55. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-201703010. http://www.rlyj.pub
鸡肉属于高蛋白低脂肪的食品,味道鲜美、营养丰富,深受广大消费者的喜爱[1]。现宰肉鸡在宰杀、流通及销售过程中极容易受沙门氏菌等细菌的感染[2],成为广大消费者极为关注的焦点。冰鲜鸡是指经屠宰后冷却至0~4 ℃并在该温度范围内流通的现宰活鸡[3]。随着我国经济水平的不断提高,冰鲜鸡在市场上逐渐被消费者所接受,其以安全、卫生及方便快捷等优点正逐步占据禽肉市场[4]。冰鲜鸡肉因其流通保存过程需要全程冷却处理,因而销售成本比现宰活鸡成本要高。然而,一些不法商家利用消费者对冰鲜鸡的喜爱心理,将经过冷冻后的鸡肉解冻充当冰鲜鸡出售,这种做法不仅欺骗了消费者的知情权,更扰乱了市场秩序。
离子迁移谱(ion mobility spectrometry,IMS)技术是将气化后的待测物进行化学电离,在电场作用下使之移动形成随时间变化的离子图谱的一种检测技术[5]。
由于灵敏度高、检测速率快等优点,近年来IMS在食品检测方面受到不少的青睐。彭丽英等[6]利用IMS检测白酒中的邻苯二甲酸酯,最小分析周期可小于95 s,检出限为0.02~0.44 mg/L,检测速率和灵敏度均有很大的提高。Garrido-Delgado等[7]通过IMS对橄榄油进行检测,并依据风味进行分类,结果显示,其准确率高达86.1%~100%。窦怀志等[8]在检测乳品中的三聚氰胺时,将设备样机与IMS结合,实现了对三聚氰胺的快速检测。Krapas等[9]将IMS用于检测肉品中的挥发性生物胺,并成功绘制出肉品中生物胺与温度及时间的关系图,推动了IMS在食品检测及监测方面的应用。但目前,IMS用于禽肉新鲜度鉴别方面的研究较少。本研究通过利用IMS技术,以新鲜鸡肉作对照,对冰鲜鸡肉和解冻鸡肉进行测定,得出相应的离子迁移谱图,进一步结合二者的理化指标如剪切力、蒸煮损失、质构及色泽等进行分析,这在国内外尚未见报道。
1 材料与方法
1.1 材料
新鲜活鸡 青岛市城阳区农贸市场;冰鲜鸡肉(取于公司冷链,下同) 青岛市正大食品有限公司;解冻鸡肉 青岛市城阳区大润发超市。
1.2 仪器与设备
UDK142型嫩度仪 北京同德创业科技有限公司;
TA-XT.plus物性测定仪 英国Stable Micro Systems
公司;Minolta CR200便携式色差仪 日本Konica公司;JYL-C50T型料理机 九阳股份有限公司;PCY-Ⅱ膨胀压缩仪 湘潭湘仪仪器有限公司;AOOA26Q202型离子迁移谱 武汉矽感科技有限公司。
1.3 方法
1.3.1 剪切力测定
参照王春青等[10]的方法测定。统一取新鲜鸡肉(对照组)、冰鲜鸡肉和解冻鸡肉的右侧鸡胸肉样品,沿肌纤维方向切取5 cm×2 cm×0.5 cm的长方条,用嫩度仪沿肌纤维方向剪切肉条,分别测定剪切力。每种样品平行测定10 次。
1.3.2 蒸煮损失率测定
参照冯宪超等[11]的方法测定。分别取新鲜鸡肉(对照组)、冰鲜鸡肉和解冻鸡肉的右侧鸡胸肉肉样,用手术刀切成2 cm×2 cm×1 cm的条块,用滤纸吸去表面的水分并进行称量(m1);然后在100 ℃水浴锅中煮制20 min,取出后于4 ℃冰箱中放置1 h,用滤纸吸去表面的水分,再进行称量(m2),每种样品平行测定10 次。蒸煮损失率按照式(1)计算。
(1)
1.3.3 汁液流失率测定
参照余小领等[12]的方法测定。测定空托盘的质量(m),将肉样放进空托盘,称量空托盘和肉的总质量(m3),用保鲜膜覆盖空托盘表面直至恒质量,取出肉样称量其质量(m4)。汁液流出率按照式(2)计算。
(2)
1.3.4 滴水损失率测定
参照邹华锋等[13]的方法测定。测量肉样质量(m5),将肉样真空包装后置于0~4 ℃环境下24 h,后取出用吸水纸吸干表面水分测量其质量(m6)。滴水损失率按照式(3)计算。
(3)
1.3.5 加壓失水率测定
参照Farouk等[14]的方法测定。测量加压前肉样质量(m7),将肉样用18层滤纸上下覆盖,然后将其放在膨胀压缩仪平台上,加压至35 kg并保持5 min,消除压力后称其质量(m8)。加压失水率按照式(4)计算。
(4)
1.3.6 质构测定
参照刘功明等[15]的方法测定。分别取新鲜鸡肉(对照组)、冰鲜鸡肉和解冻鸡肉的右侧鸡胸肉肉样,切成3 cm×2 cm×1 cm的小块,在物性测定仪下分别对2 种样品做质构剖面分析(texture profile analysis,TPA),从而得出2 种样品的硬度、弹性及黏着性。设置参数:探头型号为P/0.5R柱状,以1.6 mm/s速率进入测试肉样,再恢复至初位,下压距离8 mm。每种样品平行测定10 次。
1.3.7 色泽测定
参照廖勇[16]的方法测定。分别取新鲜鸡肉(对照组)、冰鲜鸡肉和解冻鸡肉的右侧鸡胸肉肉样,用色差仪测定其L*、a*和b*,其中L*表示亮度,a*表示红绿范围,b*表示蓝黄范围。色差仪使用前要先进行校正,经过标准化之后将镜头垂直置于肉面之上,检测光源为D65,测量直径为8 mm,然后将镜口紧压肉面,按下按钮,进行测定。每个样品均进行6 个位点的测定,并加以标记,尽量使得样品之间测定位点相同,减小误差,然后将6 个位点的测量值取平均值即为该样品的测量值。每种样品平行测定10 次。
1.3.8 离子迁移谱测定
分别取新鲜鸡肉(对照组)、冰鲜鸡肉和解冻鸡肉的右侧鸡胸肉肉样各10 g,用料理机将其搅碎成肉糜状,装入测量瓶进行测定。测定参数为:进样端温度为200 ℃;迁移管内部温度60 ℃;放电时间(T2)676 μs;引出起始时间(T3)728 μs;引出时间(T4)1 534 μs;进样量为0.6 mg;测试时间30 s。每种样品平行测定3 次。
1.4 数据处理
采用统计软件SPSS 17.0及Origin 9.0对理化指标进行统计分析并作图,采用Metabo Analyst 2.0进行离子迁移谱的预处理和数据分析[17]。
2 结果与分析
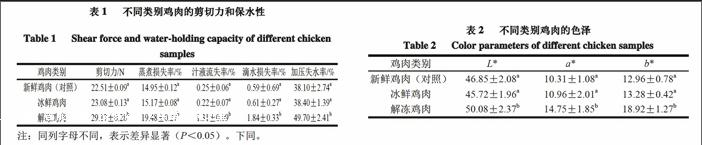
2.1 不同类别鸡肉剪切力和保水性测定
肉质的嫩度高低与剪切力大小成反比,影响肉质质量的5 个品质指标中,嫩度是最主要的指标[18]。与禽肉嫩度有关的因素包括家禽的品种、部位、年龄、屠宰方法、加工方法等,从微观结构看都是对肌肉的组织结构产生了一定影响,尤其是有关结缔组织的结构、肌原纤维蛋白中肌动蛋白与肌球蛋白结合的紧密度以及肌间脂肪的含量方面[19]。由表1可知,冰鲜鸡肉与新鲜鸡肉(对照)剪切力值差异并不显著(P>0.05),而解冻鸡肉与前两者相比差异显著(P<0.05)。这表明鸡肉在冷冻和解冻过程中,结缔组织遭到破坏,肌原纤维发生断裂[20],肌球蛋白紧密度降低等原因导致剪切力增大,嫩度下降。
肉的保水性的测量指标有很多,包括蒸煮损失率、汁液流失率、滴水损失率及加压失水率等,不同的指标表示的是肌肉处于不同状况下的水分流失情况[21]。冰鲜鸡肉的蒸煮损失率为15.17%与对照组的新鲜鸡肉14.95%无显著差异(P>0.05),解冻鸡肉的蒸煮损失率高达19.48%,与冰鲜鸡肉存在显著差异(P<0.05);汁液流失率方面,冰鲜鸡肉和新鲜鸡肉分别为0.25%和0.22%,二者之间无显著差异(P>0.05),解冻鸡肉的汁液流失率为1.31%,显著高于前者(P<0.05);冰鲜鸡肉和新鲜鸡肉的滴水损失率分别为0.59%和0.61%,与解冻鸡肉的1.84%之间存在显著差异(P<0.05);而解冻鸡肉的加压损失率为49.70%,显著高于冰鲜鸡肉的38.40%和新鲜鸡肉的38.10%(P<0.05)。综合几个指标分析,鸡肉在解冻之后,其保水性显著低于新鲜鸡肉和冰鲜鸡肉
(P<0.05),而冰鮮鸡肉的保水性与新鲜鸡肉相比,无显著性差异(P>0.05)。
肌肉中的水分含量在75%左右,主要存在于肌原纤维中、肌原纤维与细胞膜之间、肌原纤维间以及细胞和肌束之间的空隙中[22],当外界环境发生变化,如加热、冷冻、pH值改变、加压、存放时间过长等都会导致细胞结构、肌原纤维蛋白、细胞内外空隙及细胞膜通透性的变化[23-24],造成肌肉水分含量发生改变。解冻鸡肉与新鲜鸡肉相比之所以保水性下降,正是因为在冷冻-解冻过程中,细胞内外的间隙变小造成部分失水,且冷冻条件下,肌原纤维蛋白和肌浆蛋白变性、冰晶增大使得肌肉细胞破坏导致的[25],
该结果与余小领[26]的结论相一致,而冰鲜鸡肉因其所有环节均保持在0~4 ℃范围内,肌纤维未遭到破坏,因此其保水性与新鲜鸡肉(对照)无显著差别。
2.2 不同类别鸡肉色泽测定
在CIE L*a*b*色空间中,L*值代表样品的亮度值,其值越低则表明越暗;a*表示样品的红绿值,正值为红色,负值为绿色,其绝对值越高表示颜色越深;b*表示样品的黄蓝值,正值为黄色,负值为蓝色,同样是绝对值越高颜色越深[27]。由表2可知,冰鲜鸡肉的L*、a*和b*分别为45.72、10.96和13.28,与新鲜鸡肉(对照)的46.85、10.31和12.96相比均无显著性差异(P>0.05),而与解冻鸡肉的50.08、14.75及18.92相比,色差值存在差异,L*、a*和b*均显著提高
(P<0.05)。这表明鸡肉在冷冻解冻过程中,色泽发生改变,a*的改变是由于变化的温度使得鸡肉中的肌球蛋白变性,被破坏掉的细胞中的亚铁血红素发生水解[28],酸性物质增多同时蛋白聚合和卟啉环遭到破坏[29],导致高铁肌红蛋白大量积累[20],从而使红色加深;而b*的改变与脂肪氧化有关,冻融后细胞膜上的不饱和脂肪酸被氧化与肉中的胺类物质反应导致黄色素的生成[30]。
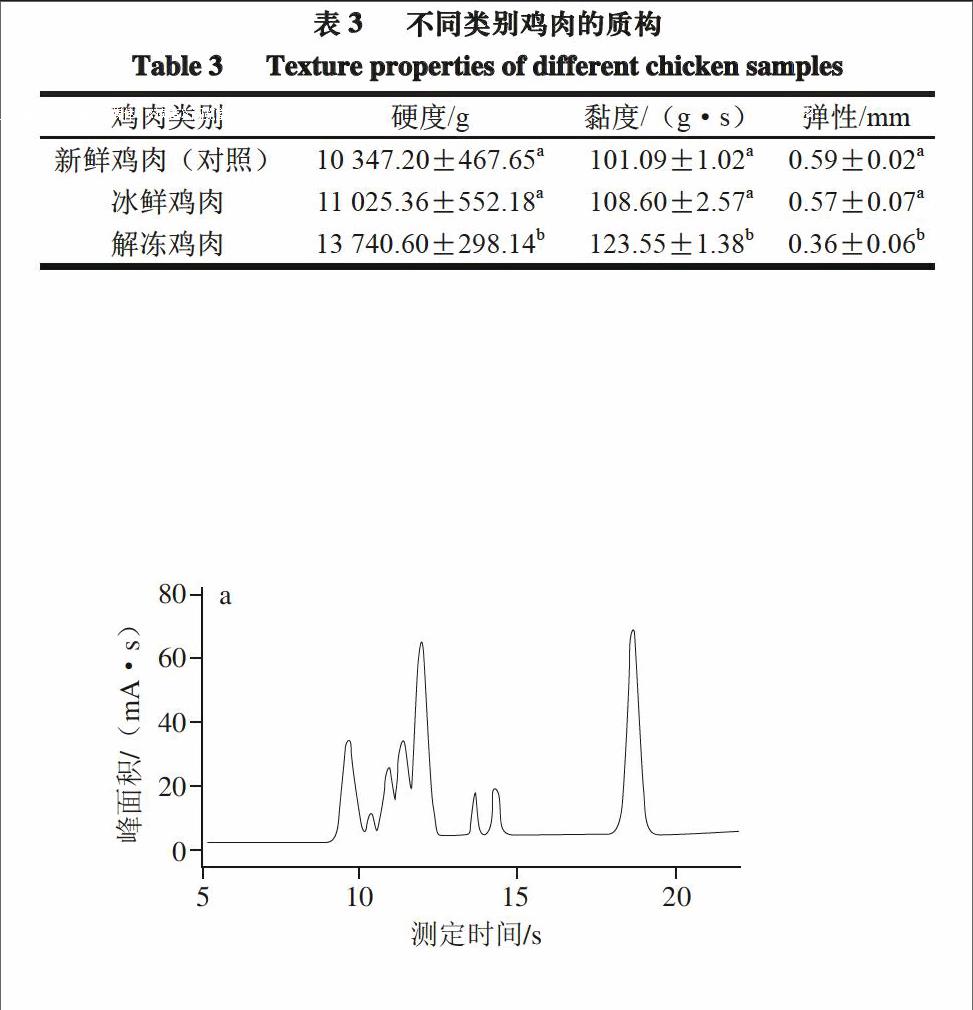
2.3 不同类别鸡肉质构测定
肉的口感和嫩度与其质构有着密切关系,肉的质构常用的指标包括硬度、黏度和弹性。由表3可知,冰鲜鸡肉与新鲜鸡肉(对照)的硬度、黏度和弹性均无显著性差异(P>0.05);而解冻鸡肉的硬度高达13 740.60 g、黏度为123.55 g·s,与冰鲜鸡肉相比显著增加
(P<0.05),弹性为0.36 mm,与冰鲜鸡肉的0.57 mm相比显著降低(P<0.05)。这是由于鸡肉在冷冻解冻过程中,冰晶的增长对肌肉结构造成机械损伤[31],肌原纤维蛋白结构遭到破坏导致蛋白的变性[32],同时低温冷冻条件下使得肌肉细胞中的钙离子酶失去活性,使肌肉中的支撑蛋白无法水解,宏观表现出硬度增加,弹性降低[33]。另外,变化的温度使细胞表面的膜蛋白发生变性和水解从而引起肌肉表面黏度增加。
2.4 不同类别鸡肉离子迁移谱测定
图1是新鲜鸡肉(对照组)、冰鲜鸡肉和解冻鸡肉3 种样品的测定时间与峰面积的IMS图谱。在测定时间5~20 s内,冰鲜鸡肉与新鲜鸡肉(对照组)的出峰时间与峰面积基本吻合,表明二者之间并无显著性差异
(P>0.05),这与其理化指标结果相一致。但图1b与图1c相比,二者总体出峰范围明显不一致,冰鲜鸡肉出峰多集中在10~15 s及18~20 s范围内,而解冻鸡肉则集中在9~12 s;冰鲜鸡肉最高峰出现在9 s左右,解冻鸡肉则出现在11 s左右;由此可知,2 种鸡肉存在显著性差异
(P<0.05)。研究表明,解冻鸡肉在反复冻融后,其总蛋白和肌浆蛋白溶解性相对于新鲜鸡肉均显著降低,并且鸡肉的肌纤维空隙面积增加、肌节长度变短[34],这就导致其IMS图谱的波峰出现的位置不同,这一结果与牛力[35]的结论具有一致性。
2.5 不同类别鸡肉主成分分析
为消除实验产生的误差,对所得的图谱进行标准变量正态变换(standard normal variate transformation,SNVT)处理,建立3 种样品的IMS数据库,并进一步进行主成分判别。图4为IMS图谱经过标准变量正态变换处理以后的主成分得分图。
由图4可知,第1主成分得分为87.1%,第2主成分得分为11.5%,总得分为98.6%,完全可以区分2 种鸡肉(主成分得分大于80%均视为有效值)。冰鲜鸡肉和新鲜鸡肉(对照)的PCA图有大部分重叠,表明二者之间在理化性质及结构非常接近,但冰鲜鸡肉与解冻鸡肉相比,分布在不同的区域,分布趋势明显不一致,表明二者之间存在差异,这与上述理化指标的测定结论完全统一,该结论与王文秀等[36]对新鲜猪肉和解冻猪肉的研究结果相一致。
2.6 不同类别鸡肉判别函数分析
进一步建立所得数据的判别函数:设一共n个样本体,分别为M1, M2, M3,...,Mn,判别函数为
F(X)=f1X1+f2X2+,..., fkXk,f1, f2,...,fn为变量系数,
X1, X2,..., Xn为变量。分别把30 个样本的IMS数据带入函数式中,根据规则进行判定[37]。得到判别函数为F=-0.132X1+0.550X2+0.079X3-0.168X4-0.903X5+0.039X6。随机带入5 个样本数值进行判别,准确率达到99.17%,能够很好地对2 种样品进行区分。
3 结 论
本研究利用离子迁移谱技术对冰鲜鸡肉与解冻鸡肉进行鉴别,以新鲜鸡肉作为对照,得到3 种样品的离子迁移谱图,对比发现,解冻鸡肉与冰鲜鸡肉的出峰时间及面积均有差异,后通过对离子迁移谱图进行标准变量正态变换处理,得出主成分得分图及判别函数并进行分析,其中主成分得分为98.60%,判别函数判别率为99.17%。同时对3 种样品进行理化指标的测定,包括剪切力、保水性(蒸煮损失率、汁液损失率、滴水损失率及加压损失率)色泽及质构,结果显示,冰鲜鸡肉与解冻鸡肉理化指标均存在显著性差异(P<0.05)。通过2 种分析方法并结合相应的理化指标可以得出结论,利用离子迁移谱技术能够准确地将冰鲜鸡肉和解冻鸡肉区分开,这一技术检测时间短、成本低、准确率高,为快速鉴别冰鲜鸡肉和解冻鸡肉提供了有效的理论依据。
参考文献:
[1] 周光宏. 畜产品加工学[M]. 北京: 中国农业出版社, 2002: 6.
[2] 崔可琦, 李静怡, 冯赛祥, 等. 冰鲜鸡生产链中沙门氏菌的分离鉴定及PFGE分型研究[J]. 中国畜牧兽医, 2014, 41(12): 62-66.
[3] 姜石红, 杨锡洪, 陈秋红. HACCP体系在供港冰鲜鸡加工中的运用[J]. 现代食品科技, 2012, 28(2): 214-217.
[4] 赵华, 范梅华. 活鸡向冰鲜鸡消费转型亟需解决的六大问题[J]. 中国畜牧杂志, 2015, 51(16): 8-10.
[5] 颜毅坚, 何东平, 曹文明, 等. 离子迁移谱技术快速识别地沟油[J]. 食品安全导刊, 2014(13): 45-48.
[6] 彭丽英, 王卫国, 王新, 等. 离子迁移谱快速筛查白酒中痕量邻苯二甲酸酯的研究[J]. 分析化学, 2014, 42(2): 278-282.
[7] GARRIDO-DELGADO R, MERCADER-TREJO F, SIELEMANN S,
et al. Direct classification of olive oils by using two types of ion mobility spectrometers[J]. Analytica Chimica Acta, 2011, 696(12): 108-115. DOI:10.1016/j.aca.2011.03.007.
[8] 竇怀志, 江涛, 张晓冬, 等. 新型离子迁移谱技术应用于乳品中三聚氰胺的检测[J]. 化学通报, 2014, 77(2): 178-181.
[9] KARPAS Z, TILMAN B, GDALEVSKY B, et al. Determination of volatile biogenic amines in muscle food products by ion mobility spectrometry[J]. Analytica Chimica Acta, 2002, 463(2): 155-163. DOI:10.1016/S0003-2670(02)00378-1.
[10] 王春青, 李侠, 张春晖, 等. 不同品种鸡蒸煮加工适宜性评价技术研究[J]. 中国农业科学, 2015, 48(15): 3090-3100.
[11] 冯宪超, 陈琳, 徐幸莲, 等. 风冷和水冷生鲜鸡肉品质的比较[J]. 南京农业大学学报, 2009, 32(4): 172-175.
[12] 余小领, 李学斌, 赵良, 等. 常规冷冻冻藏对猪肉保水性和组织结构的影响[J]. 农业工程学报, 2008, 24(12): 264-268.
[13] 邹华锋, 文美英, 魏星华, 等. 生猪宰前不同静养时间和屠宰方式对背长肌肌肉pH值和滴水损失的影响[J]. 肉类工业, 2013(5): 19-21.
[14] FAROUK M M, WIELICZKO K J, MERTS I. Ultra-fast freezing and low storage temperatures are not necessary to maintain the functional properties of manufacturing beef[J]. Meat Science, 2004, 66(1): 171-179. DOI:10.1016/S0309-1740(03)00081-0.
[15] 刘功明, 孙京新, 黄明, 等. 纳地青霉发酵灭菌鸭肉食用品质变化研究[J]. 现代食品科技, 2015, 40(2): 163-168.
[16] 廖勇. 茶多酚短乳杆菌灌喂对鸡肉品质影响的研究[D]. 长沙: 湖南农业大学, 2014, 6.
[17] 周健, 成浩, 叶阳. 基于近红外的Fisher分类法识别茶叶原品种的研究[J]. 光学学报, 2009, 29(4): 1117-1121.
[18] 朱仁俊, 黄启超, 唐臻睿, 等. 云南武定鸡肌肉组织学特性与嫩度分析[J]. 食品科技, 2012, 37(7): 128-130.
[19] 戴瑞彤, 吴国强. 肉嫩度的研究进展[J]. 肉类工业, 2000(10): 32-35.
[20] 姜晴晴, 刘文娟, 鲁珺, 等. 冻结与解冻处理对肉类品质影响的研究进展[J]. 食品工业科技, 2015, 36(8): 383-388.
[21] HOFFANN E K, MILLS J W. Membrane events involved in volume regulation[J]. Current Topics in Membranes, 1999, 48: 123-196.
[22] LANG F, BUSCH G L, RITTER M, et al. Functional significance of cell volume regulatory mechanisms[J]. Physiological Reviews, 1998, 78: 247-306.
[23] BERTRAM H C, ANDERSEN R H, ANDERSEN H J. Development in myofibrillar water distribution of two pork qualities during 10-month freezer storage[J]. Meat Science, 2007, 75: 128-133. DOI:10.1016/j.meatsci.2006.06.020.
[24] MORTENSENA M, ANDERSEN H J, ENGELSEN S B, et al. Effect of freezing temperature, thawing and cooking rate on water distribution in two pork qualities[J]. Meat Science, 2006, 72: 34-42. DOI:10.1016/j.meatsci.2005.05.027.
[25] 黃彬, 徐玉娟, 唐道邦, 等. 反复冻融对不同卤制条件盐水鸡肉品质的影响[J]. 食品科技, 2014, 39(1): 141-145.
[26] 余小领. 冷冻和解冻工艺对猪肉保水性和组织结构的影响研究[D]. 南京: 南京农业大学, 2007.
[27] 孙京新, 罗欣, 周光宏, 等. 不同加工和贮藏条件对鸡肉制品颜色的影响[J]. 食品工业科技, 2009, 30(6): 69-75.
[28] 廖彩虎, 芮汉明, 张立彦, 等. 超高压解冻对不同方式冻结的鸡肉品质的影响[J]. 农业工程学报, 2012, 26(2): 331-337.
[29] JUNG S, GHOUL M, LAMBALLERIE-ANTON M. Influence of high pressure on the color and microbial quality of beef meat[J]. LWT-Food Science and Technology, 2003, 36: 625-631. DOI:10.1016/S0023-6438(03)00082-3.
[30] THANONKAEW A, BENJAKUL S, VISESSANGUAN W, et al. The effect of metal ions on lipid oxidation, colour and physicochemical properties of cuttlefish (Sepia pharaonis) subjected to multiplefreeze-thaw cycles[J]. Food Chemistry, 2006, 95(4): 591-599. DOI:10.1016/j.foodchem.2005.01.040.
[31] RUIZ-RAMREZ J, AMAU J, SERRA X, et a1. Relationship between water content, NaCl content, pH and texture parametersin dry-cured muscles[J]. Meat Science, 2005, 70: 579-587. DOI:10.1016/j.meatsci.2005.02.007.
[32] NIAMNUY C, DEVAHASTIN S, SOPONRONNARIT S. Changes in protein compositions and their effects on physical changes of shrimp during boiling in salt solution[J]. Food Chemistry, 2008, 108(1):
165-175. DOI:10.1016/j.foodchem.2007.10.058.
[33] MUELA E, SANUDO C, CAMPO M M, et al. Effect of freezing method and frozen storage duration on lamb sensory quality[J]. Meat Science, 2012, 90(1): 209-215. DOI:10.1016/j.meatsci.2011.07.003.
[34] 祝超智. 生鲜鸡肉保水机制及控制技术研究[D]. 郑州: 河南工业大学, 2011.
[35] 牛力. 冻结和冻藏对鸡胸肉食用品质的影响[D]. 南京: 南京农业大学, 2012.
[36] 王文秀, 彭彦昆. 基于近红外光谱的冷鲜肉-解冻肉的判别研究[J]. 食品安全质量检测学报, 2014, 5(3): 754-760.
[37] 帅茜, 张良晓, 李培武, 等. 基于离子迁移谱的葡萄籽油掺伪鉴别研究[J]. 分析化学研究简报, 2014, 24(10): 1530-1534.
